Содержание
- 2. Проблема связывания азота Мировые потребности в связанном азоте около 150 млн. т / год Мировое производство
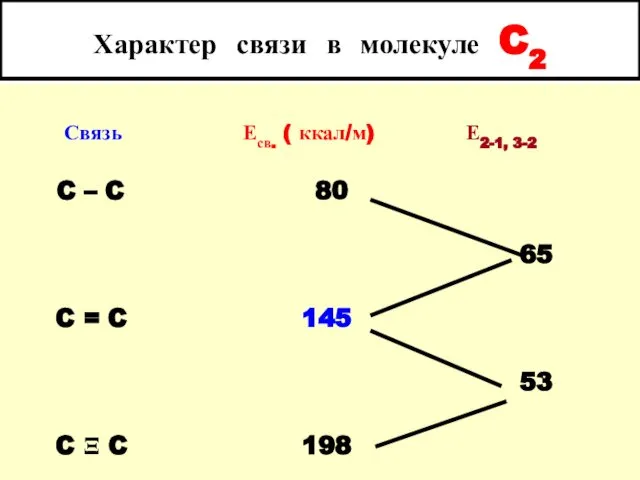
- 3. Характер связи в молекуле C2 Связь Есв. ( ккал/м) Е2-1, 3-2 C – C 80 65
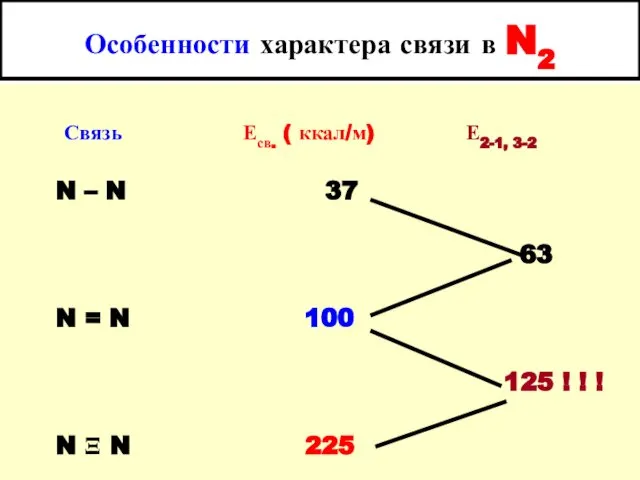
- 4. Особенности характера связи в N2 Связь Есв. ( ккал/м) Е2-1, 3-2 N – N 37 63
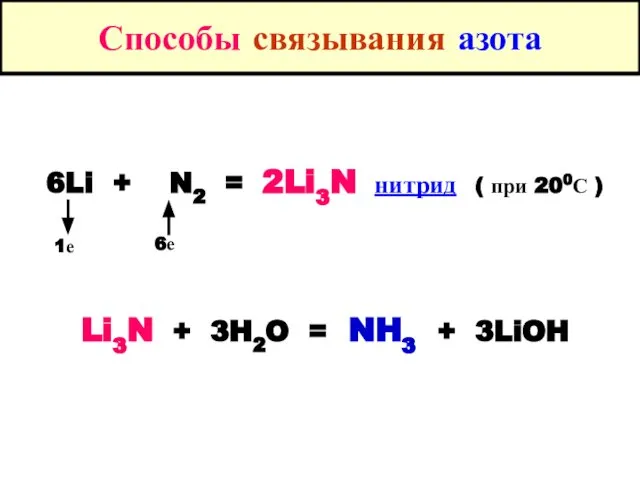
- 5. Способы связывания азота 6Li + N2 = 2Li3N нитрид ( при 200С ) Li3N + 3H2O
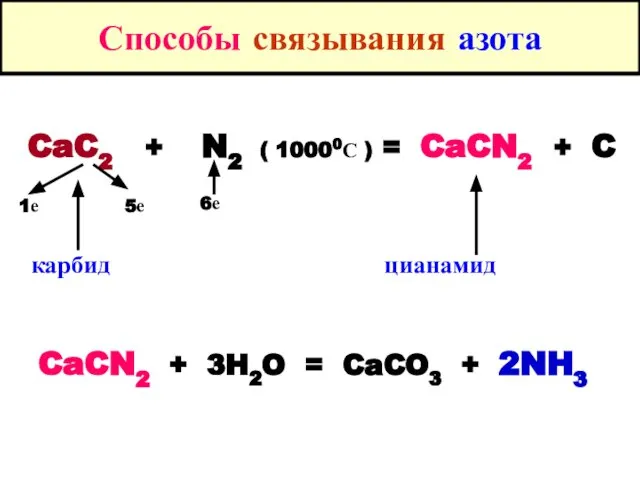
- 6. Способы связывания азота CaC2 + N2 ( 10000С ) = CaCN2 + C карбид цианамид CaCN2
- 7. Промышленный способ синтеза NH3 Способ Габера - Боша : N2 + 3H2 = 2NH3 ( 400
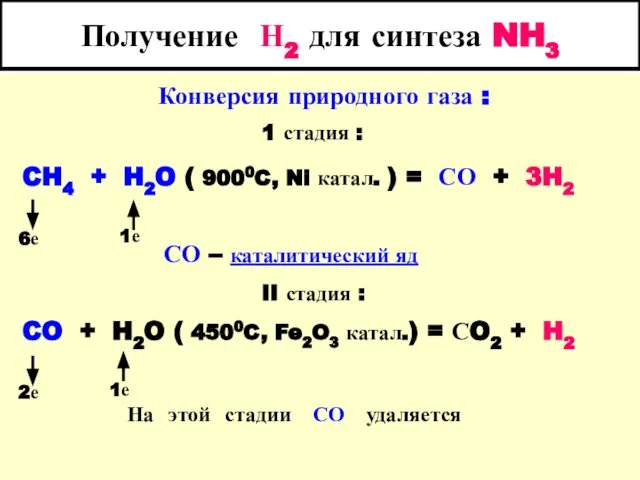
- 8. Получение Н2 для синтеза NH3 Конверсия природного газа : 1 стадия : CH4 + H2O (
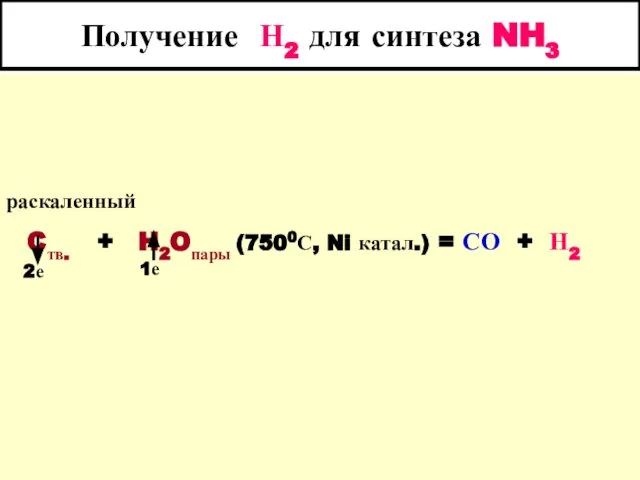
- 9. Получение Н2 для синтеза NH3 раскаленный Cтв. + H2Oпары (7500С, Ni катал.) = СО + Н2
- 10. Получение N2 для синтеза аммиака Азот ( N2 ) получают путем дистилляции из жидкого воздуха :
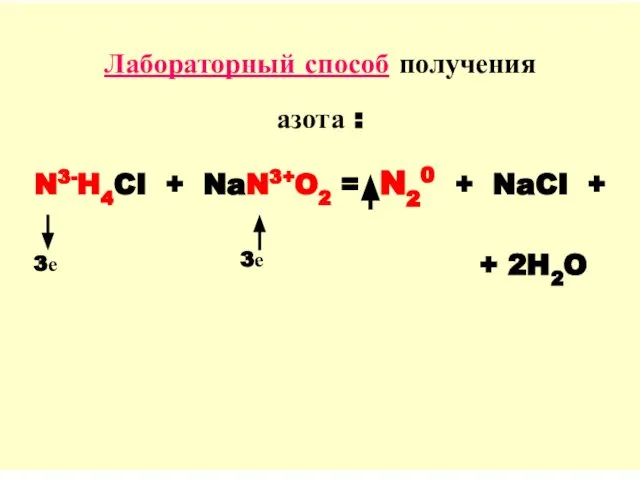
- 11. Лабораторный способ получения азота : N3-H4CI + NaN3+O2 = N20 + NaCI + + 2H2O 3е
- 12. Торжество 3 - го знака В 1892 г Рамзай заметил, что 1 л N2 , полученного
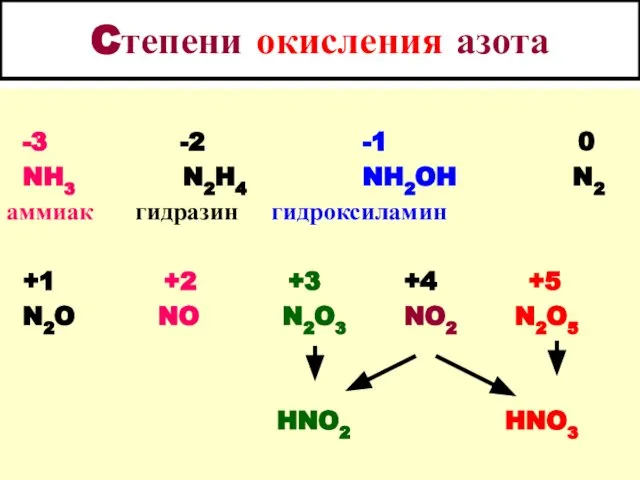
- 13. Cтепени окисления азота -3 -2 -1 0 NH3 N2H4 NH2OH N2 аммиак гидразин гидроксиламин +1 +2
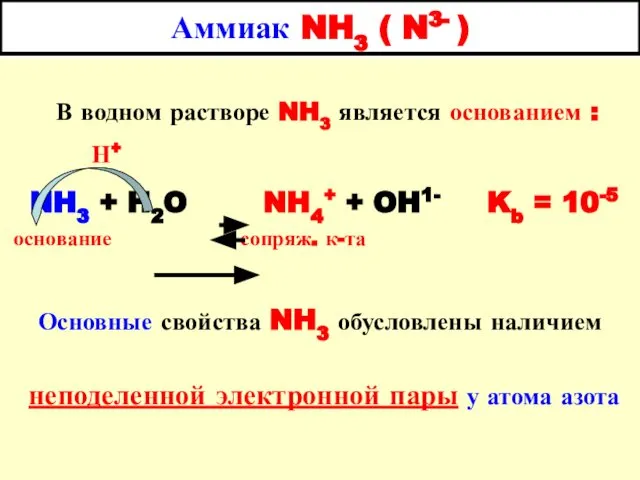
- 14. Аммиак NH3 ( N3- ) В водном растворе NH3 является основанием : Н+ NH3 + H2O
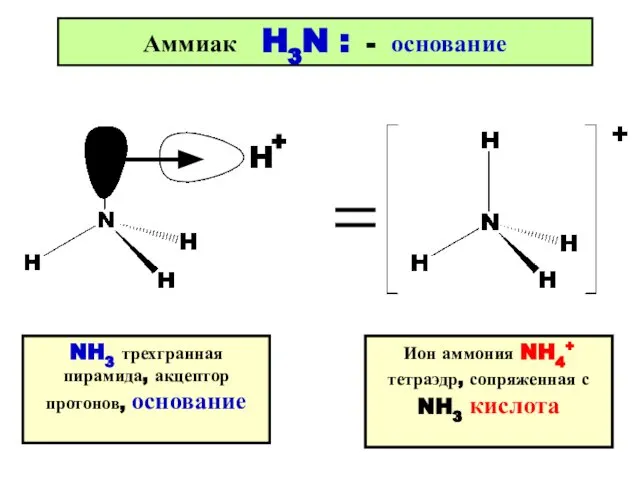
- 15. + + Аммиак H3N : - основание NH3 трехгранная пирамида, акцептор протонов, основание Ион аммония NH4+
- 16. Аммиак NH3 ( N-3 ) Молекула NH3 – трехгранная пирамида ( р3 атомные орбитали ) Молекула
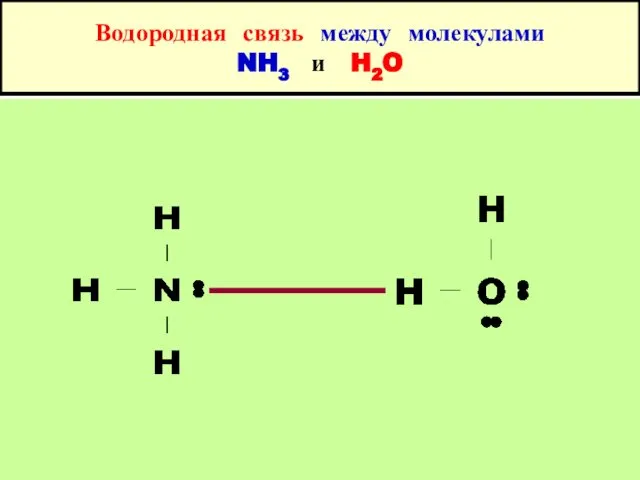
- 17. Водородная связь между молекулами NH3 и H2O
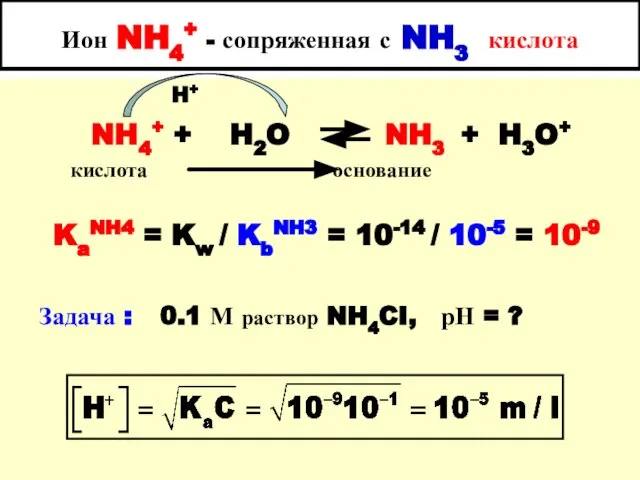
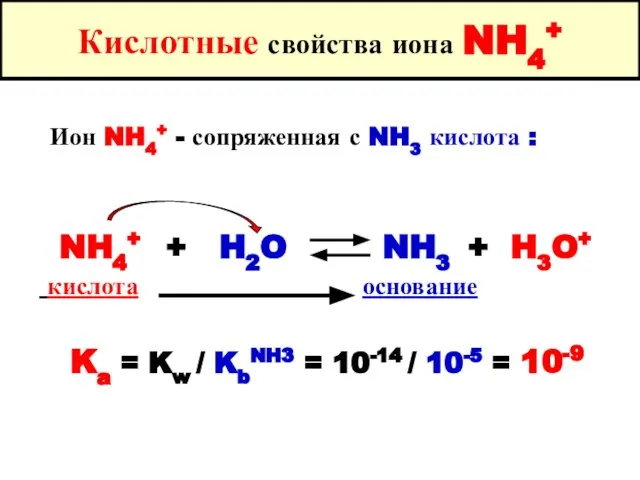
- 18. Ион NH4+ - сопряженная с NH3 кислота H+ NH4+ + H2O NH3 + H3O+ кислота основание
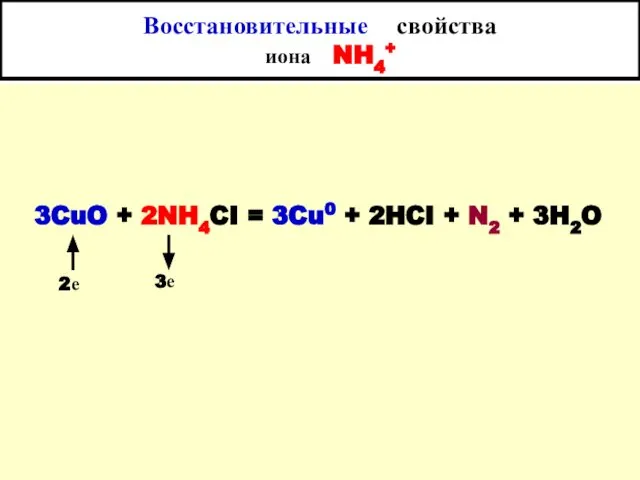
- 19. Восстановительные свойства иона NH4+ 3CuO + 2NH4CI = 3Cu0 + 2HCI + N2 + 3H2O 2е
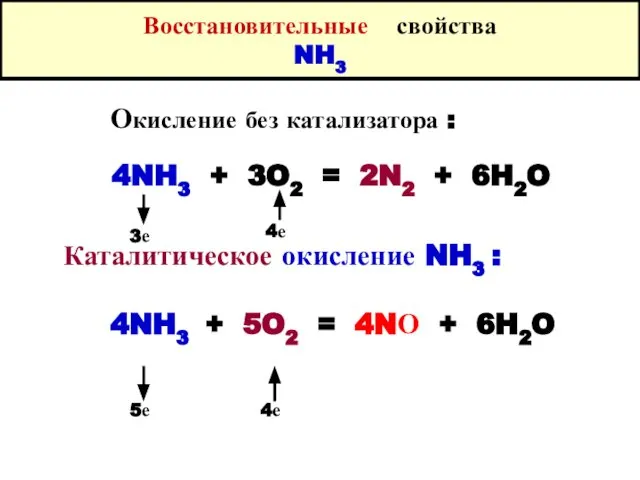
- 20. Восстановительные свойства NH3 Окисление без катализатора : 4NH3 + 3O2 = 2N2 + 6H2O Каталитическое окисление
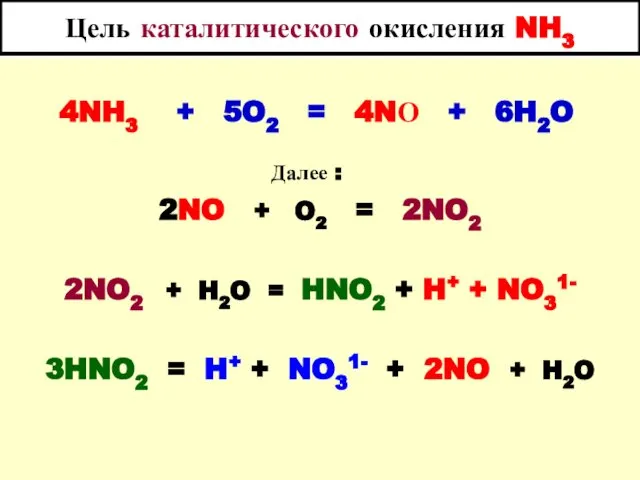
- 21. Цель каталитического окисления NH3 4NH3 + 5O2 = 4NО + 6H2O Далее : 2NO + O2
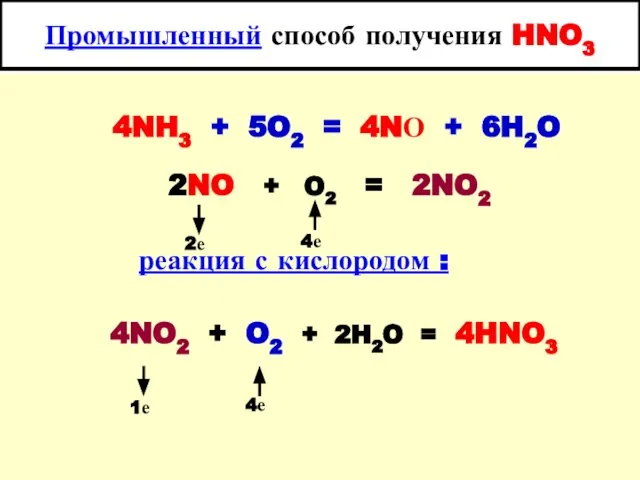
- 22. Промышленный способ получения HNO3 4NH3 + 5O2 = 4NО + 6H2O 2NO + O2 = 2NO2
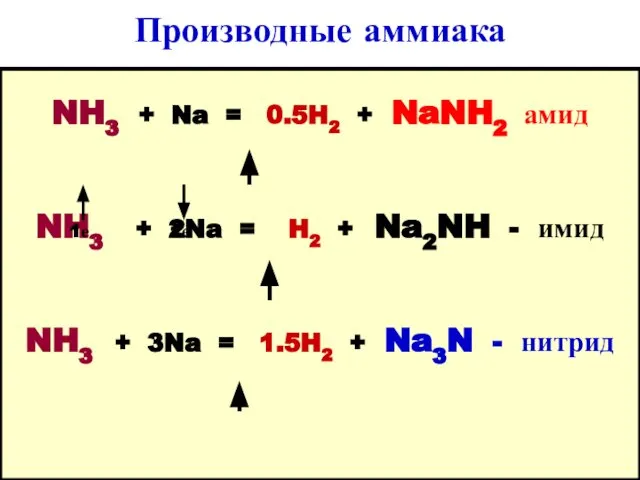
- 23. Производные аммиака NH3 + Na = 0.5H2 + NaNH2 амид NH3 + 2Na = H2 +
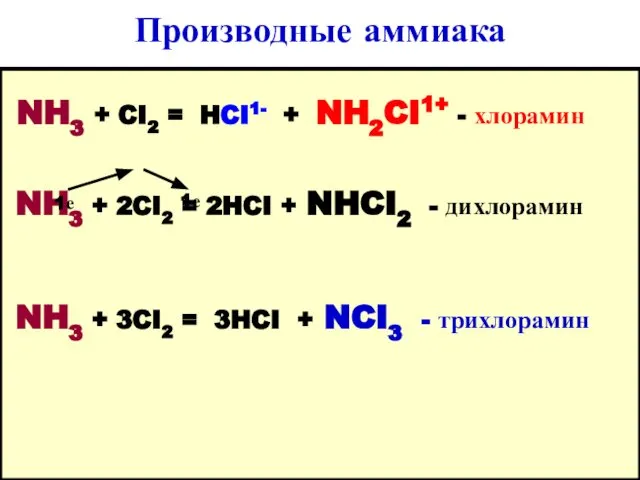
- 24. Производные аммиака NH3 + CI2 = HCI1- + NH2CI1+ - хлорамин NH3 + 2CI2 = 2HCI
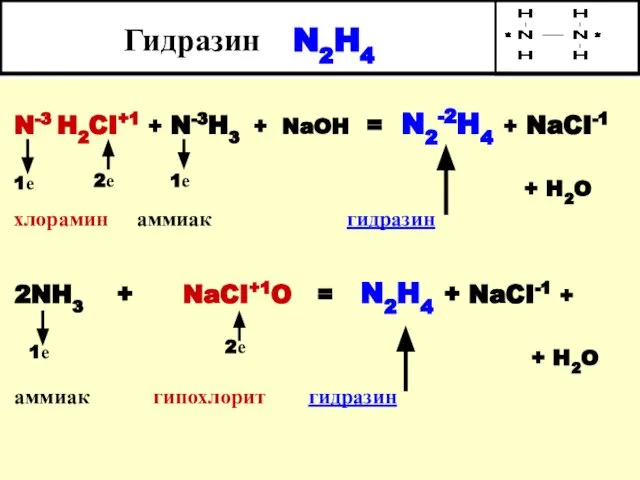
- 25. Гидразин N2H4 N-3 H2CI+1 + N-3H3 + NaOH = N2-2H4 + NaCI-1 + H2O хлорамин аммиак
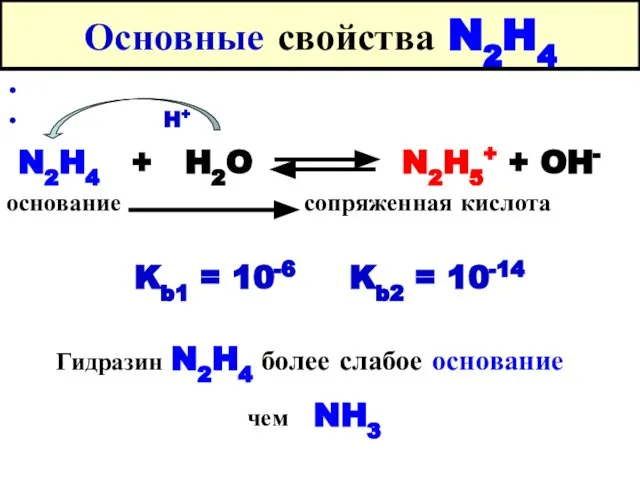
- 26. Основные свойства N2H4 H+ N2H4 + H2O N2H5+ + OH- основание сопряженная кислота Kb1 = 10-6
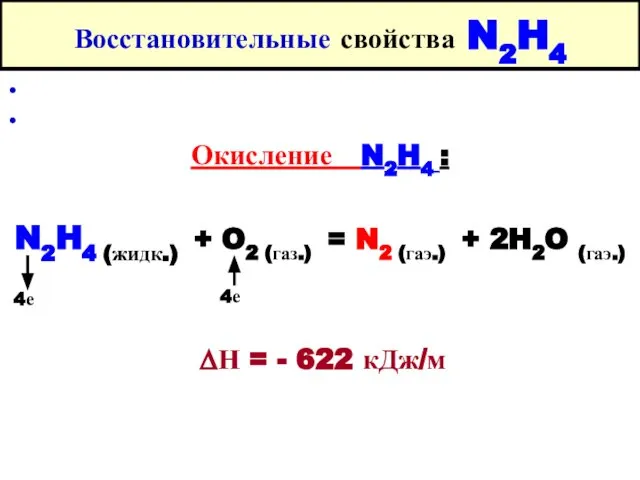
- 27. Восстановительные свойства N2H4 Окисление N2H4 : N2H4 (жидк.) + O2 (газ.) = N2 (гаэ.) + 2H2O
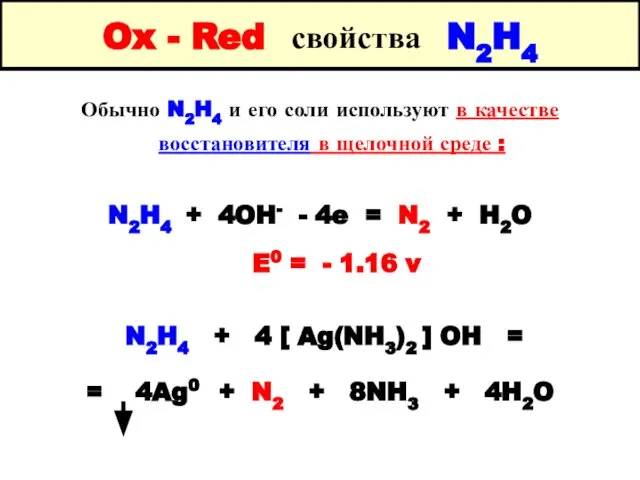
- 28. Ox - Red свойства N2H4 Обычно N2H4 и его соли используют в качестве восстановителя в щелочной
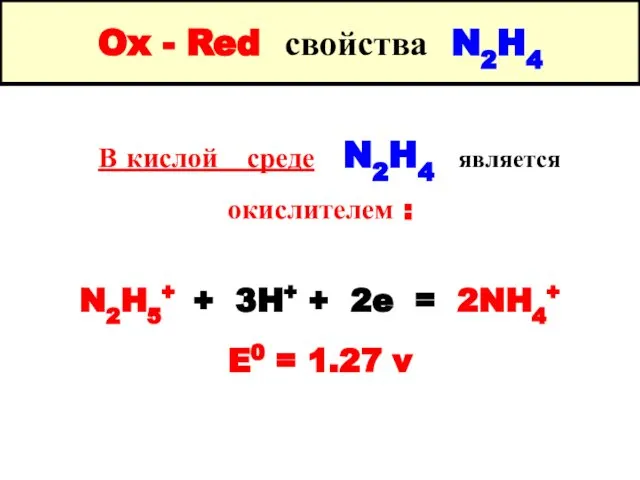
- 29. Ox - Red свойства N2H4 В кислой среде N2H4 является окислителем : N2H5+ + 3H+ +
- 30. Кислотные свойства иона NH4+ Ион NH4+ - сопряженная с NH3 кислота : NH4+ + H2O NH3
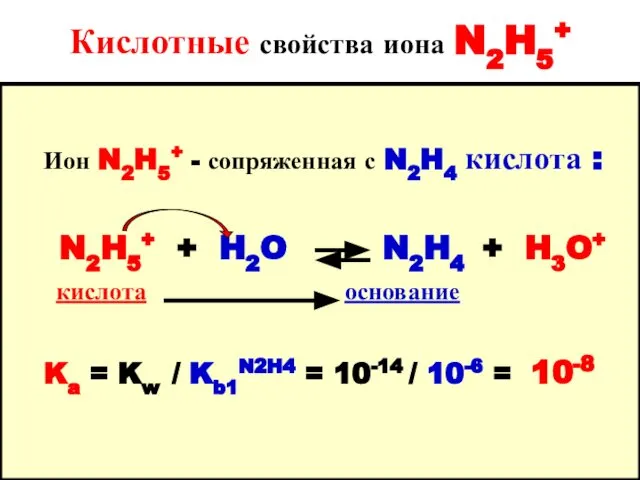
- 31. Кислотные свойства иона N2H5+ Ион N2H5+ - сопряженная с N2H4 кислота : N2H5+ + H2O N2H4
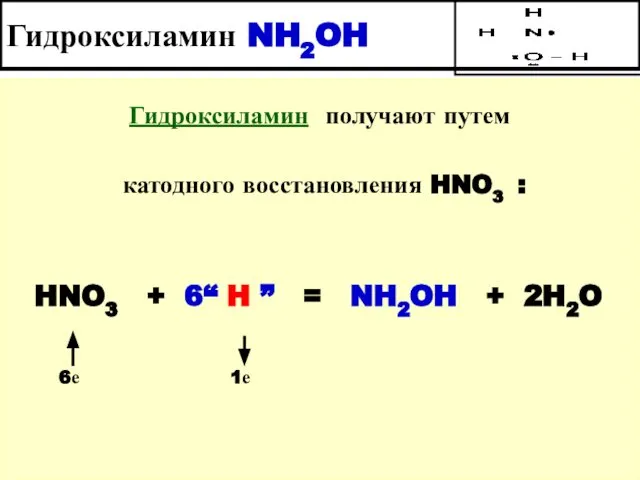
- 32. Гидроксиламин NH2OH Гидроксиламин получают путем катодного восстановления HNO3 : HNO3 + 6“ H ” = NH2OH
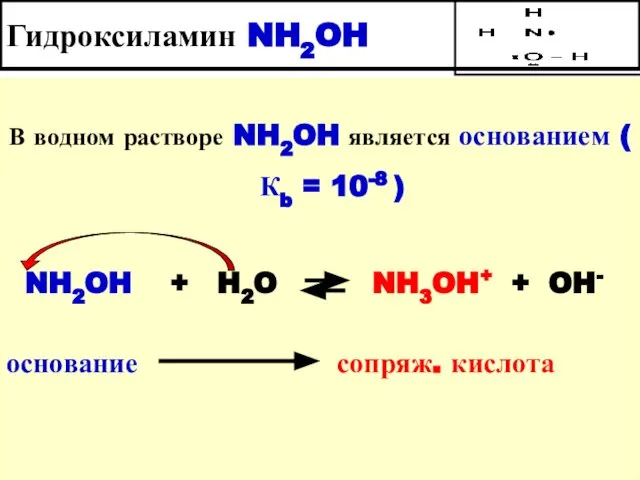
- 33. Гидроксиламин NH2OH В водном растворе NH2OH является основанием ( Кb = 10-8 ) NH2OH + H2O
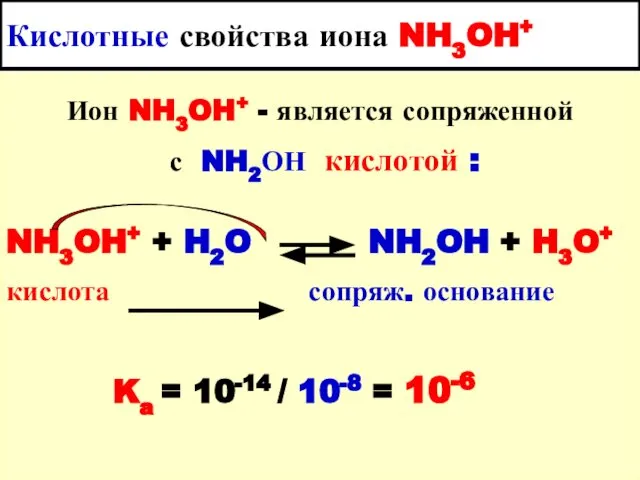
- 34. Кислотные свойства иона NH3OH+ Ион NH3OH+ - является сопряженной с NH2ОН кислотой : NH3OH+ + H2O
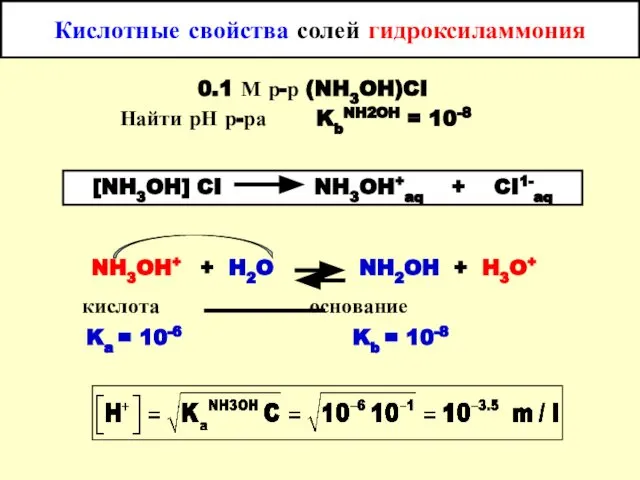
- 35. Кислотные свойства солей гидроксиламмония 0.1 М р-р (NH3OH)CI Найти рН р-ра KbNH2OH = 10-8 NH3OH+ +
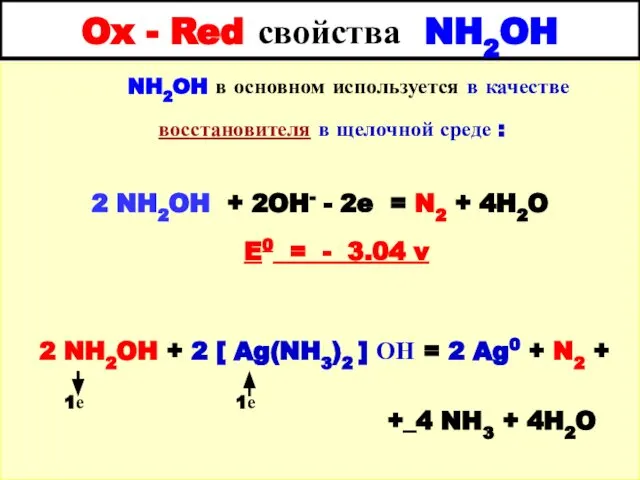
- 36. Ox - Red свойства NH2OH NH2OH в основном используется в качестве восстановителя в щелочной среде :
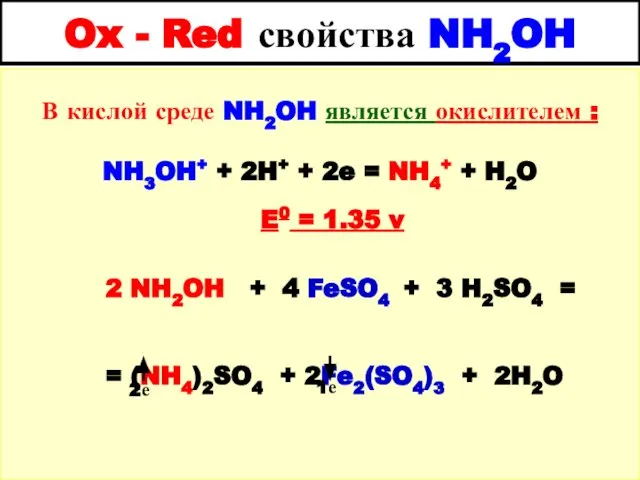
- 37. Ox - Red свойства NH2OH В кислой среде NH2OH является окислителем : NH3OH+ + 2H+ +
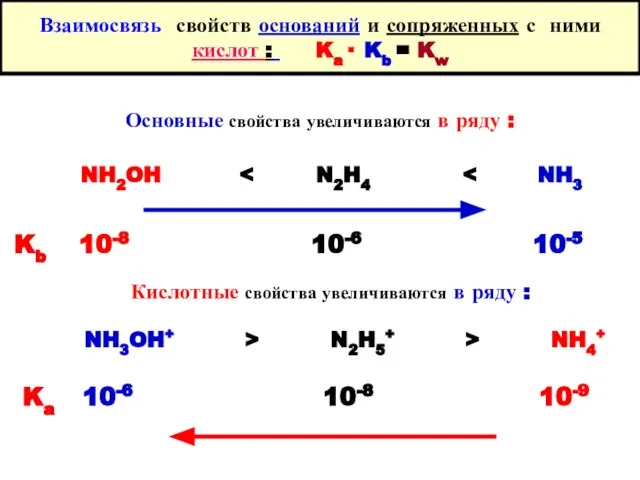
- 38. Взаимосвязь свойств оснований и сопряженных с ними кислот : Ka· Kb = Kw Основные свойства увеличиваются
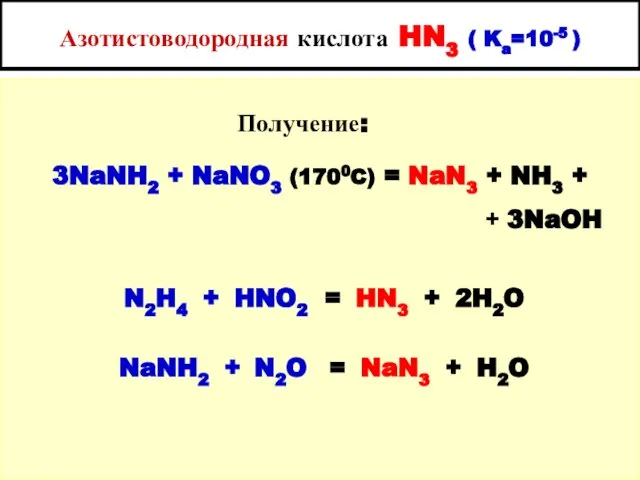
- 39. Азотистоводородная кислота HN3 ( Ka=10-5 ) Получение: 3NaNH2 + NaNO3 (1700C) = NaN3 + NH3 +
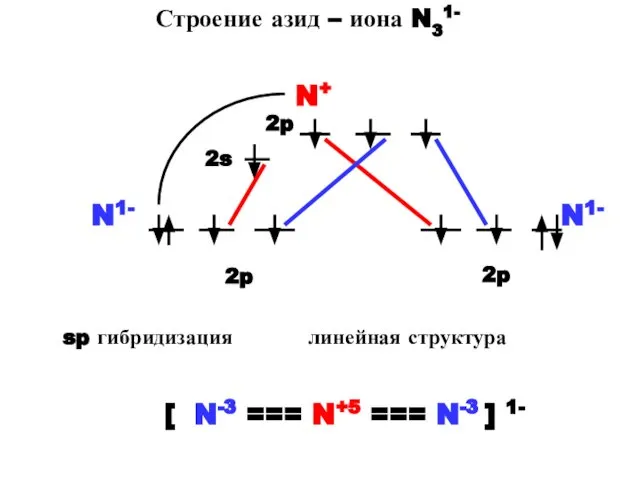
- 40. Строение азид – иона N31- [ N-3 N+5 N-3 ]1- sp гибридные орбитали центрального атома N
- 41. Строение азид – иона N31- N+ N1- N1- sp гибридизация линейная структура [ N-3 === N+5
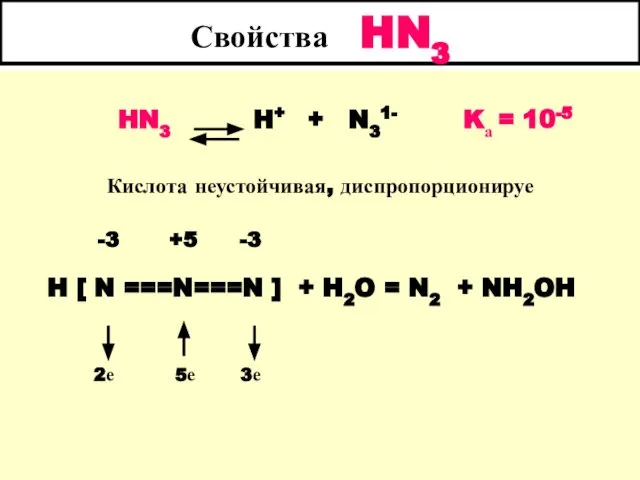
- 42. Свойства HN3 HN3 H+ + N31- Kа = 10-5 Кислота неустойчивая, диспропорционируе -3 +5 -3 H
- 43. Свойства солей HN3 Соли – азиды тяжелых металлов мало растворимы и обладают детонирующими свойствами : Pb(N3)2
- 44. Свойства солей HN3 Азид натрия NaN3 является реагентом в защитных подушках автомобилей. В подушке, содержащей 200
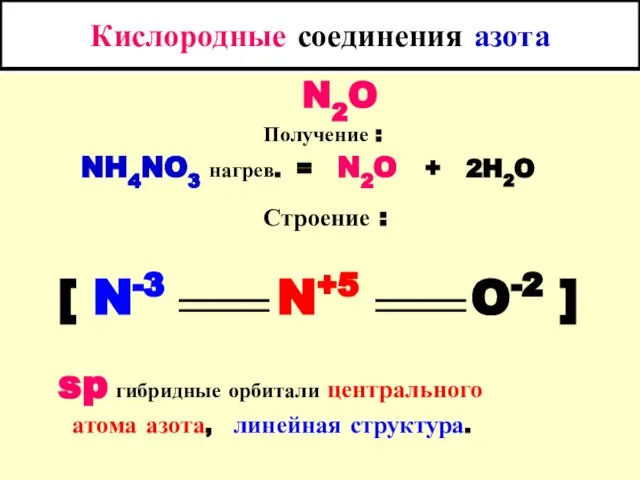
- 45. Кислородные соединения азота N2O Получение : NH4NO3 нагрев. = N2O + 2H2O Строение : [ N-3
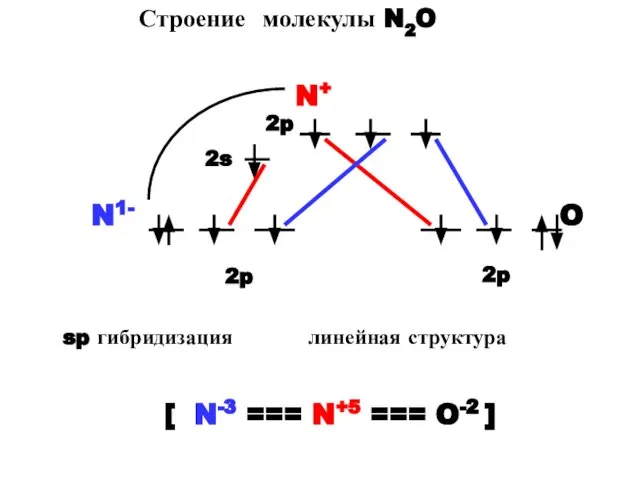
- 46. Строение молекулы N2O N+ N1- O sp гибридизация линейная структура [ N-3 === N+5 === O-2
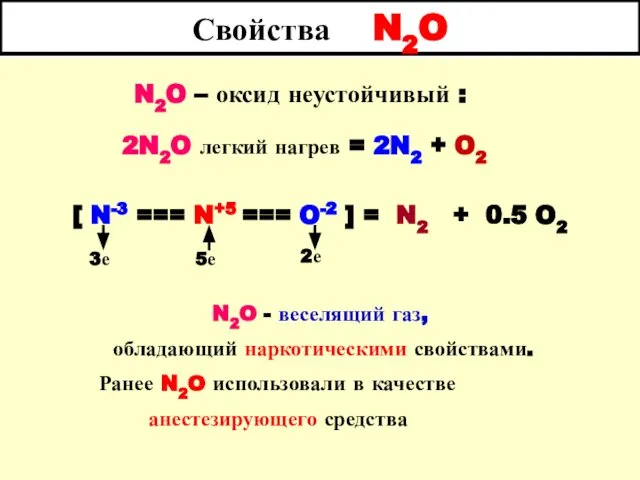
- 47. Свойства N2O N2O – оксид неустойчивый : 2N2O легкий нагрев = 2N2 + O2 [ N-3
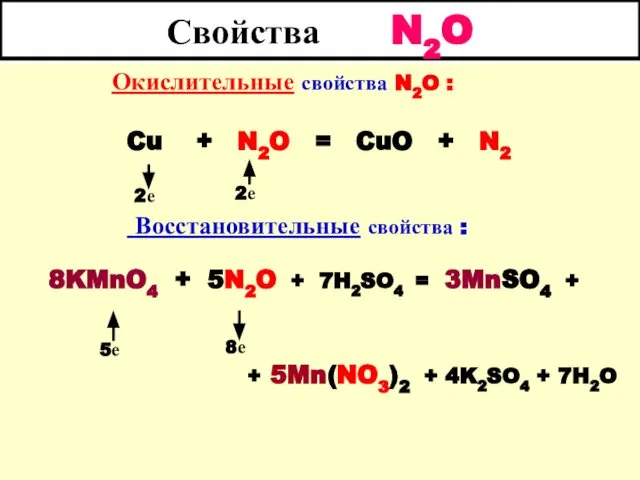
- 48. Свойства N2O Окислительные свойства N2O : Cu + N2O = CuO + N2 Восстановительные свойства :
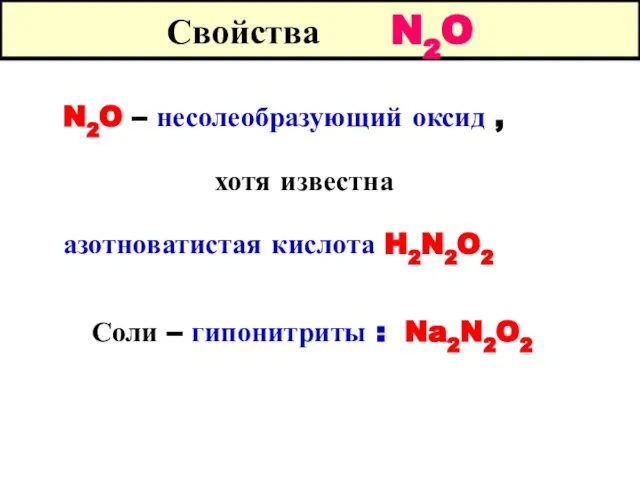
- 49. Свойства N2O N2O – несолеобразующий оксид , хотя известна азотноватистая кислота H2N2O2 Соли – гипонитриты :
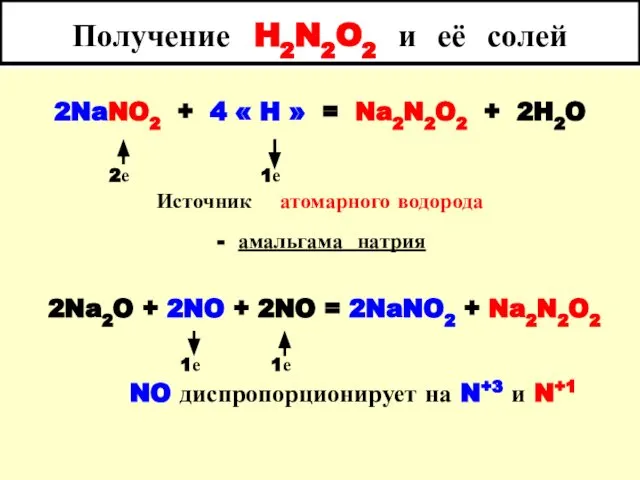
- 50. Получение H2N2O2 и её солей 2NaNO2 + 4 « H » = Na2N2O2 + 2H2O Источник
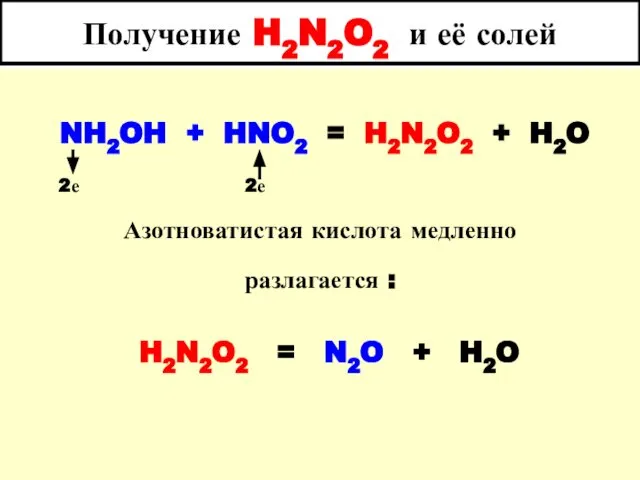
- 51. Получение H2N2O2 и её солей NH2OH + HNO2 = H2N2O2 + H2O Азотноватистая кислота медленно разлагается
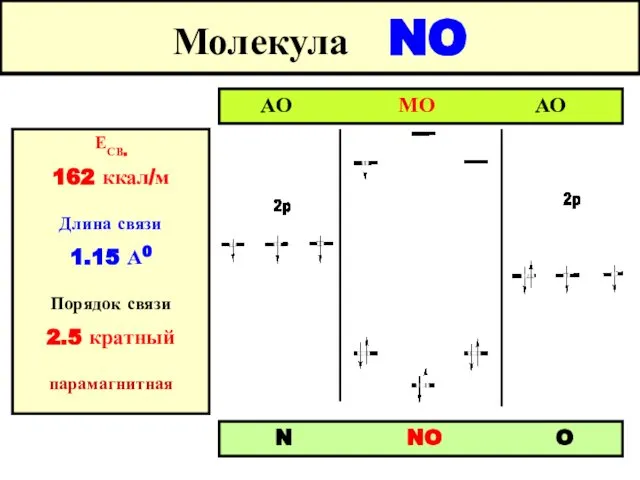
- 52. Молекула NO АО МО АО N NO O ЕСВ. 162 ккал/м Длина связи 1.15 А0 Порядок
- 53. Монооксид азота NO Молекула NO имеет нечетное число электронов, но мало димеризуется, устойчива, реакционноспособна 3Cu +
- 54. Свойства NO NO – несолеобразующий оксид , легко окисляется на воздухе : NO + 0.5O2 =
- 55. Свойства NO 3 - х кратная связь в NO+ прочнее чем 2.5 кратная в NO !
- 56. Реакция бурого кольца Реакция бурого кольца используется для обнаружения ионов NO31- и NO21-. Реакция протекает в
- 57. Реакция бурого кольца Реакция бурого кольца используется для обнаружения ионов NO31- и NO21-. Реакция с NO31-
- 58. NO в качестве лиганда NO- слабый σ - донор за счет неподеленной электронной пары у атома
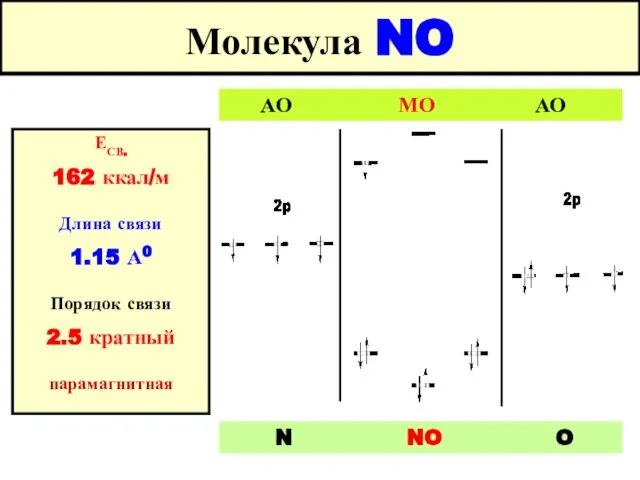
- 59. Молекула NO АО МО АО N NO O ЕСВ. 162 ккал/м Длина связи 1.15 А0 Порядок
- 60. NO в качестве лиганда π - электроны металла поступают на разрыхляющие орбитали молекулы NO , связь
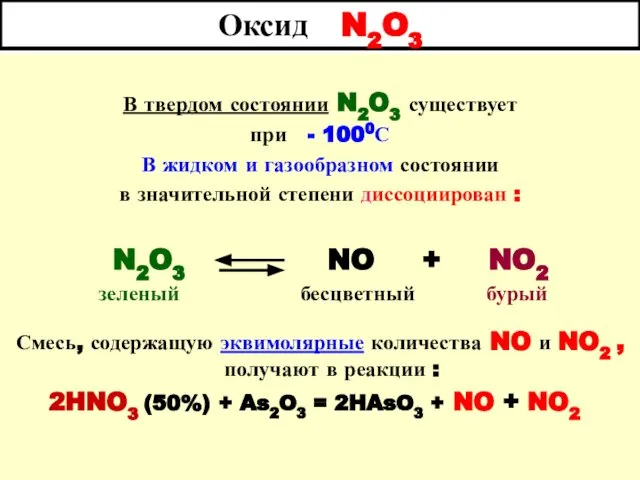
- 61. Оксид N2O3 В твердом состоянии N2O3 существует при - 1000С В жидком и газообразном состоянии в
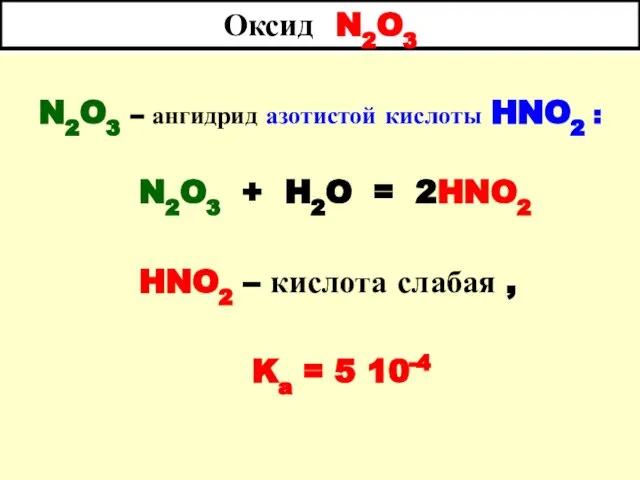
- 62. Оксид N2O3 N2O3 – ангидрид азотистой кислоты HNO2 : N2O3 + H2O = 2HNO2 HNO2 –
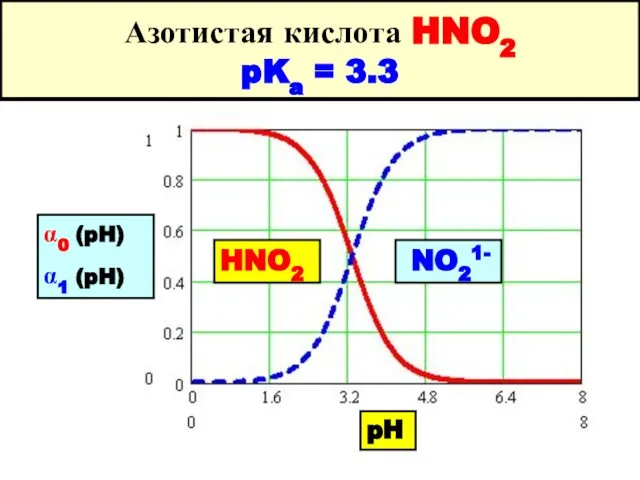
- 63. Азотистая кислота HNO2 pKa = 3.3 HNO2 NO21- pH α0 (pH) α1 (pH)
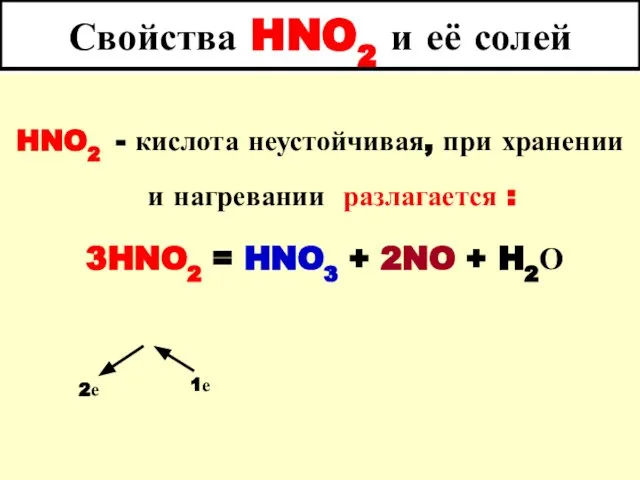
- 64. Свойства HNO2 и её солей HNO2 - кислота неустойчивая, при хранении и нагревании разлагается : 3HNO2
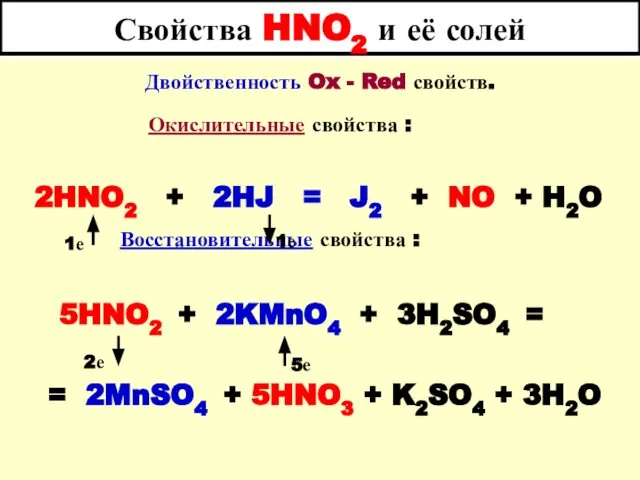
- 65. Свойства HNO2 и её солей Двойственность Ox - Red свойств. Окислительные свойства : 2HNO2 + 2HJ
- 66. Нитрит - ион NO21- в качестве лиганда Нитрит - ион NO21- имеет уголковое строение с неподеленными
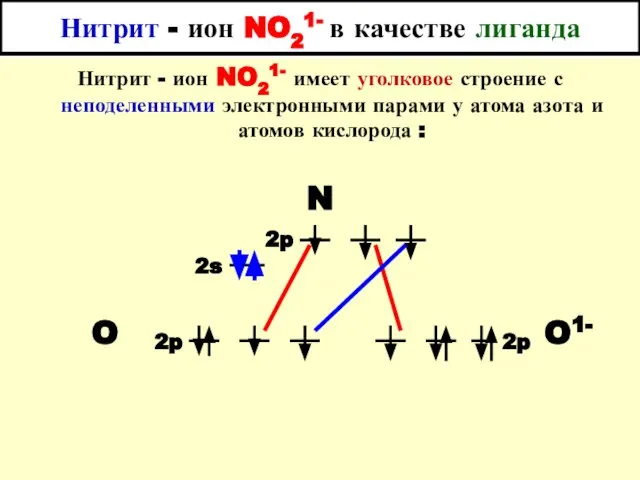
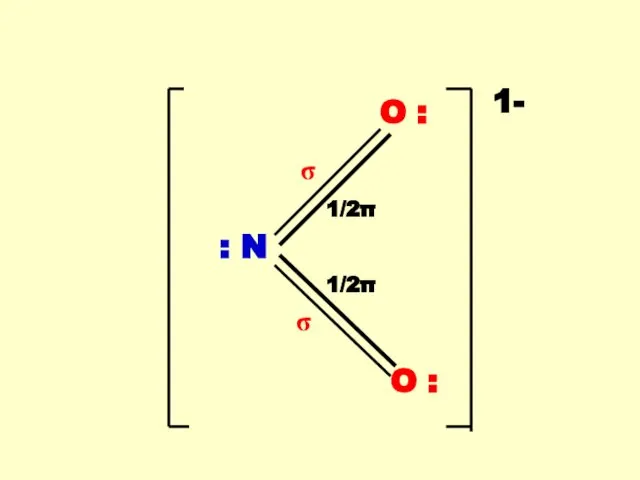
- 67. O : : N O : 1- σ σ 1/2π 1/2π
- 68. Нитрит - ион NO21- в качестве лиганда В комплексах со связью М - NO2 лиганды называются
- 69. Диоксид азота NO2 Экспериментальные факты : молекула уголковая содержит 1 неспаренный электрон N+ O O-- 2p
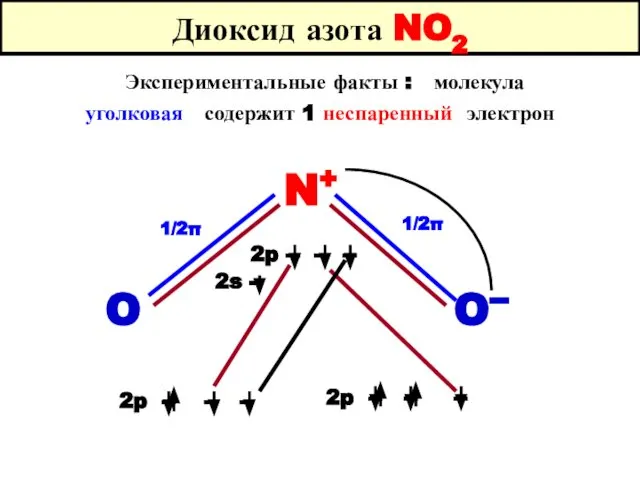
- 70. Диоксид азота NO2 Молекула NO2 - содержит неспаренный электрон, склонна к димеризации : NO2 + NO2
- 71. Получение NO2 Cu + HNO3 конц. = Cu(NO3)2 + 2NO2 + 2H2O Pb(NO3)2 (нагрев.) = PbO
- 72. Свойства димерного оксида N2O4 N2O4 – сильный окислитель ( как Br2 ) : N2O4 + 2H+
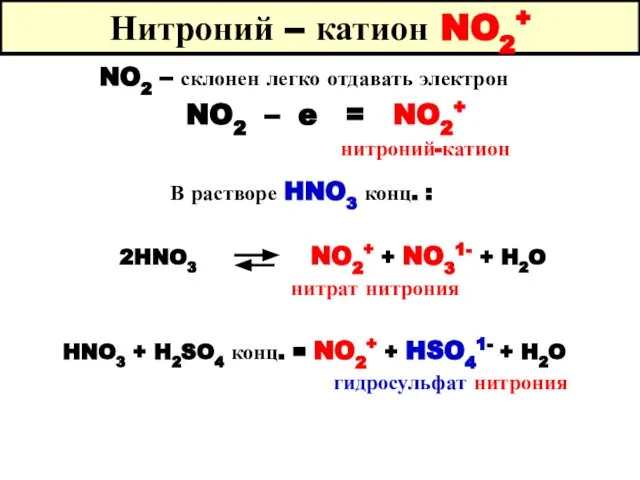
- 73. Нитроний – катион NO2+ NO2 – склонен легко отдавать электрон NO2 – e = NO2+ нитроний-катион
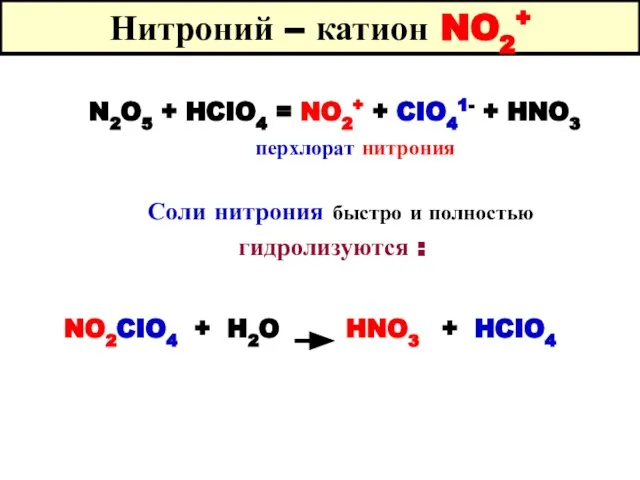
- 74. Нитроний – катион NO2+ N2O5 + HCIO4 = NO2+ + CIO41- + HNO3 перхлорат нитрония Соли
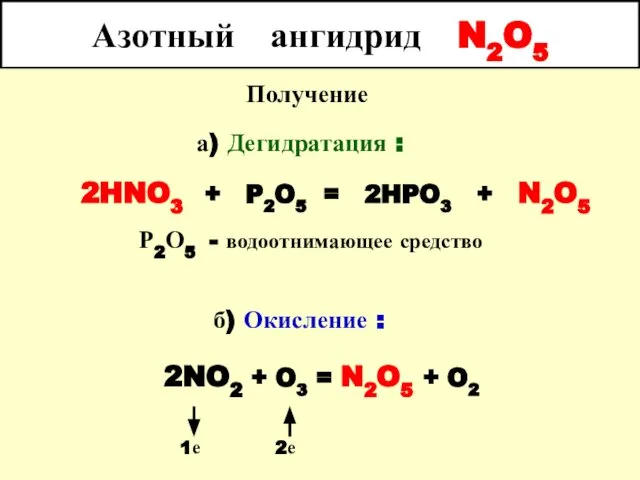
- 75. Азотный ангидрид N2O5 Получение а) Дегидратация : 2HNO3 + P2O5 = 2HPO3 + N2O5 Р2О5 -
- 76. Азотный ангидрид N2O5 В твердом состоянии N2О5 можно представить в виде соли : NO2+NO3- - нитрат
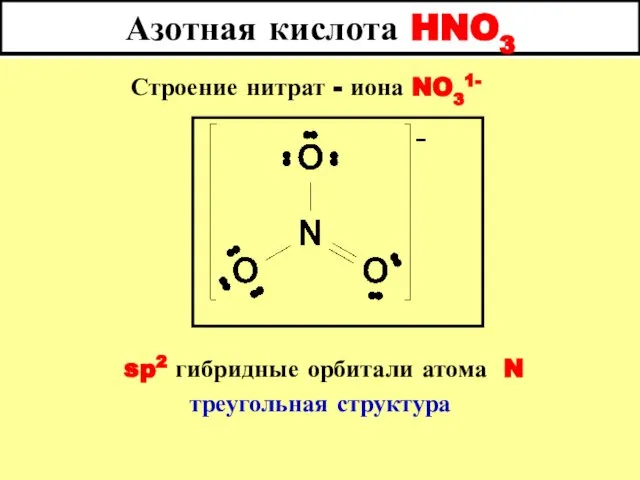
- 77. Азотная кислота HNO3 Строение нитрат - иона NO31- sp2 гибридные орбитали атома N треугольная структура
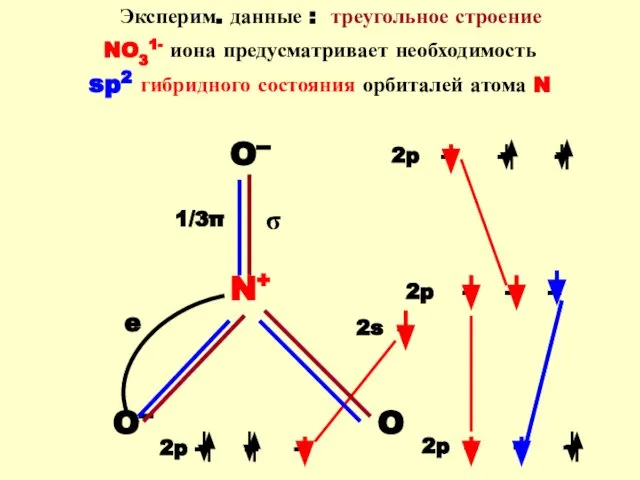
- 78. Эксперим. данные : треугольное строение NO31- иона предусматривает необходимость sp2 гибридного состояния орбиталей атома N O--
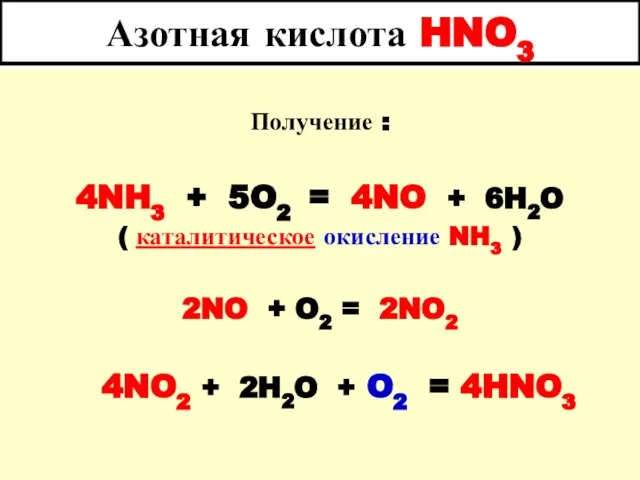
- 79. Азотная кислота HNO3 Получение : 4NH3 + 5O2 = 4NO + 6H2O ( каталитическое окисление NH3
- 80. Окислительные свойства HNO3 Окисление неметаллов : 4HNO3 конц. + C = CO2 + 4NO2 + 2H2O
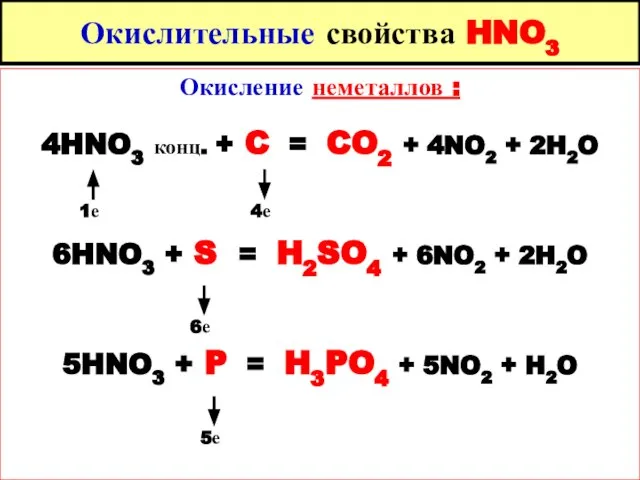
- 81. Окислительные свойства HNO3 Окисление металлов : Продукты восстановления HNO3 при взаимодействии с активными металлами зависят от
- 82. Окислительные свойства HNO3 Окисление металлов, близких в ряду напряжения к Н ( Pb, Sn, Bi, Sb,
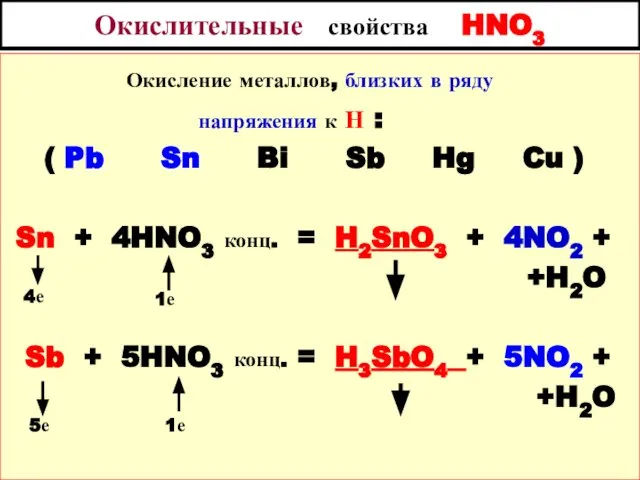
- 83. Окислительные свойства HNO3 Окисление металлов, близких в ряду напряжения к Н ( Pb, Sn, Bi, Sb,
- 84. Окислительные свойства HNO3 Окисление металлов, близких в ряду напряжения к Н : ( Pb Sn Bi
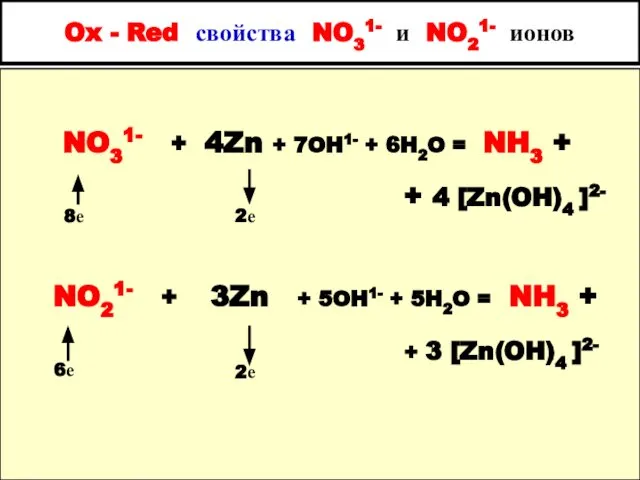
- 85. Ox - Red свойства NO31- и NO21- ионов NO31- + 4Zn + 7OH1- + 6H2O =
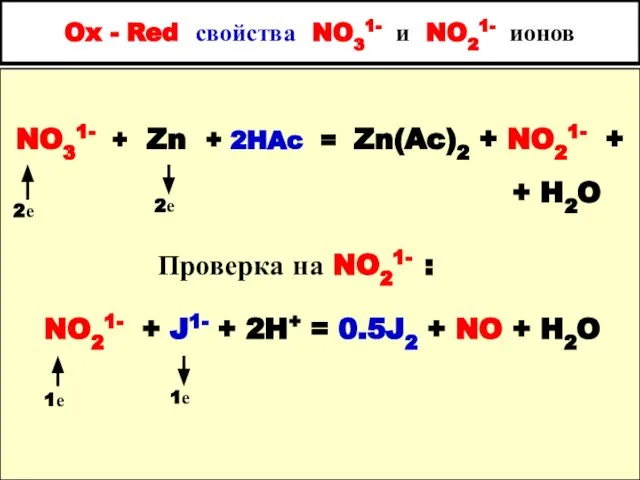
- 86. Ox - Red свойства NO31- и NO21- ионов NO31- + Zn + 2HAc = Zn(Ac)2 +
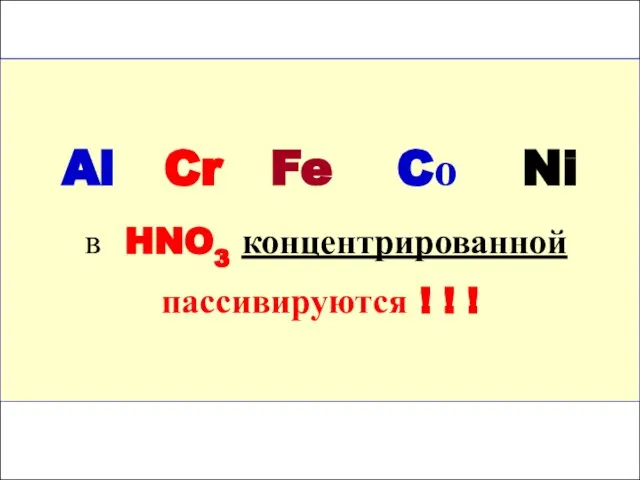
- 87. Al Cr Fe Cо Ni в HNO3 концентрированной пассивируются ! ! !
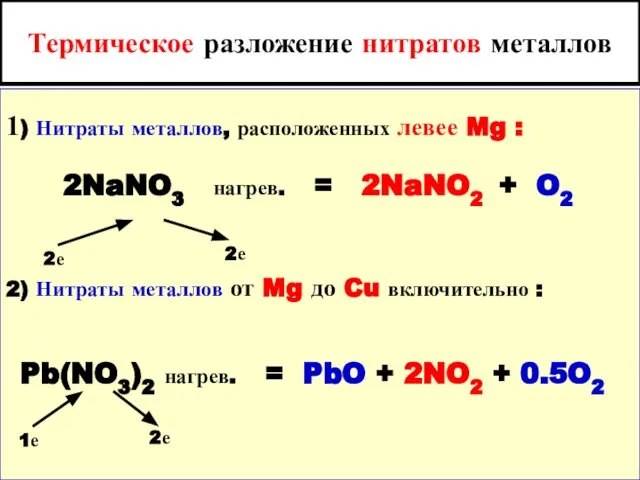
- 88. Термическое разложение нитратов металлов 1) Нитраты металлов, расположенных левее Mg : 2NaNO3 нагрев. = 2NaNO2 +
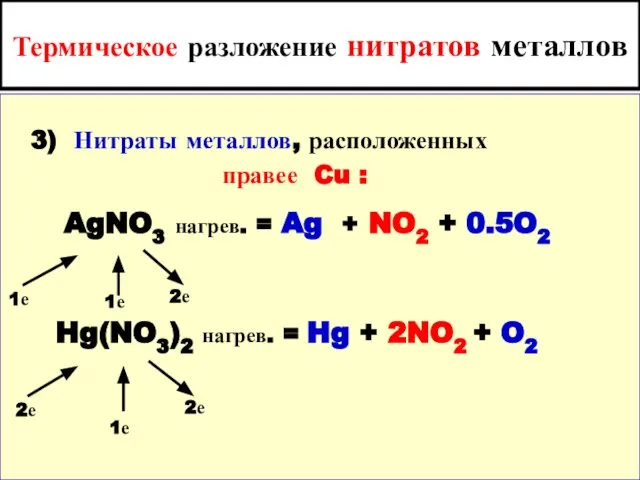
- 89. Термическое разложение нитратов металлов 3) Нитраты металлов, расположенных правее Cu : AgNO3 нагрев. = Ag +
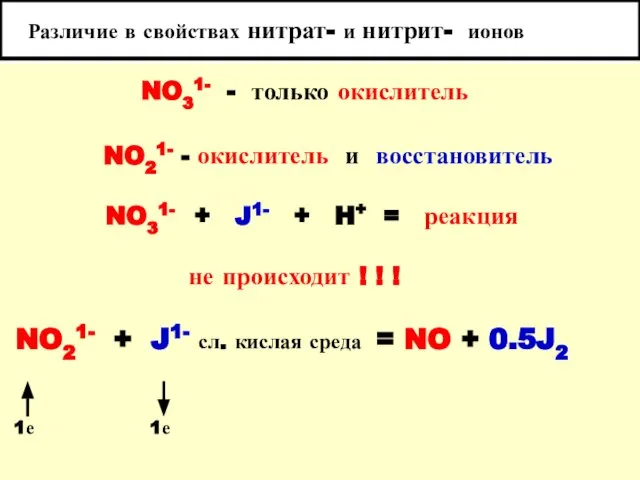
- 90. Различие в свойствах нитрат- и нитрит- ионов NO31- - только окислитель NO21- - окислитель и восстановитель
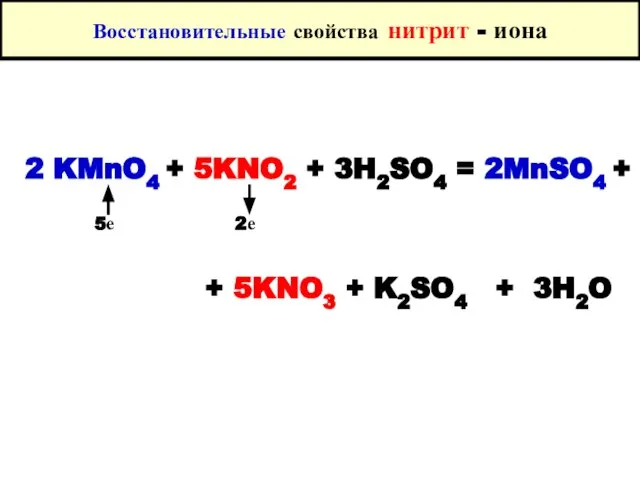
- 91. Восстановительные свойства нитрит - иона 2 KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + + 5KNO3
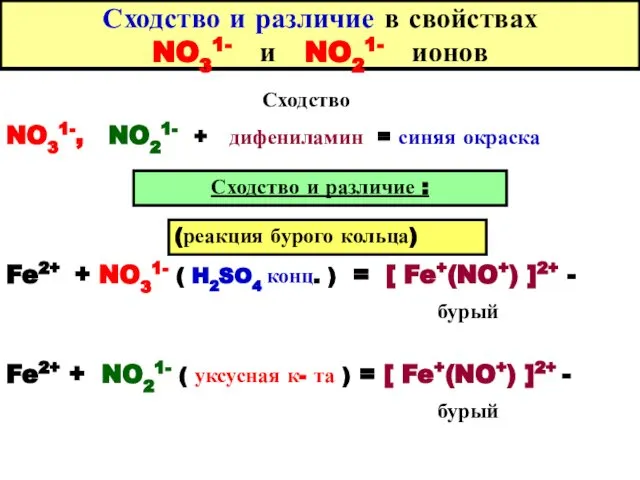
- 92. Сходство и различие в свойствах NO31- и NO21- ионов Сходство NO31-, NO21- + дифениламин = синяя
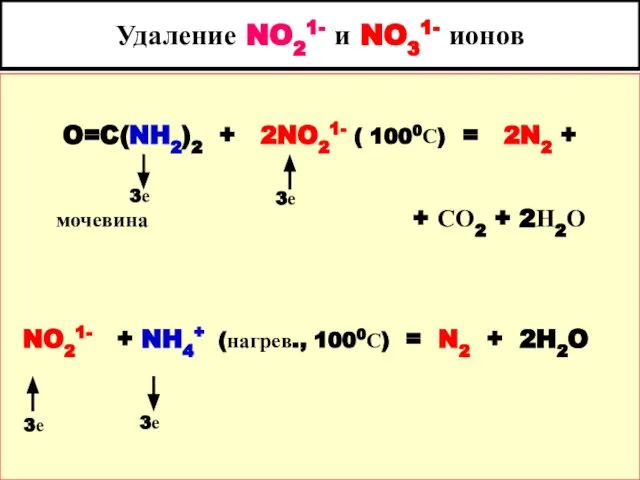
- 93. Удаление NO21- и NO31- ионов O=C(NH2)2 + 2NO21- ( 1000С) = 2N2 + мочевина + СО2
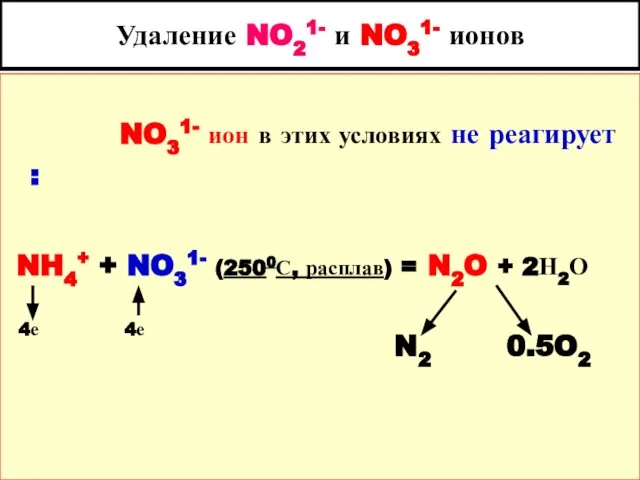
- 94. Удаление NO21- и NO31- ионов NO31- ион в этих условиях не реагирует : NH4+ + NO31-
- 95. NO31- и NO21- в питьевой воде и продуктах NaNO3 и NaNO2 широко используются в качестве консервантов
- 97. Скачать презентацию





![Строение азид – иона N31- [ N-3 N+5 N-3 ]1- sp](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/479629/slide-39.jpg)


















 Реакции ионного обмена
Реакции ионного обмена Презентация по Химии "Глюкоза - альдегідоспирт" - скачать смотреть бесплатно
Презентация по Химии "Глюкоза - альдегідоспирт" - скачать смотреть бесплатно Изготовление натурального мыла в домашних условиях
Изготовление натурального мыла в домашних условиях Configuratia electronica. Sistemul periodic al elementelor. (Curs 3)
Configuratia electronica. Sistemul periodic al elementelor. (Curs 3) Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Алюминий
Алюминий Основания. Физические и химические свойства оснований
Основания. Физические и химические свойства оснований Характеристика дефектов. Растворы влияющие на степень износа тканей
Характеристика дефектов. Растворы влияющие на степень износа тканей Теория электролитической диссоциации
Теория электролитической диссоциации Презентация по Химии "Кристаллические решетки" - скачать смотреть _
Презентация по Химии "Кристаллические решетки" - скачать смотреть _ Карбоновые кислоты
Карбоновые кислоты Газовые смеси
Газовые смеси Кремнекислые породы. Жильные и эффузивные породы
Кремнекислые породы. Жильные и эффузивные породы Изомерия органических соединений. 10 класс
Изомерия органических соединений. 10 класс СЖЭ-ң жалпы сипаттамасы, ашылу тарихы, қолдану аумағы, минералдары
СЖЭ-ң жалпы сипаттамасы, ашылу тарихы, қолдану аумағы, минералдары Кислоты, соли
Кислоты, соли Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Нуклеиновые кислоты
Нуклеиновые кислоты Азот. Нахождение в природе
Азот. Нахождение в природе Обмен простых белков. Дезаминирование и трансаминирование аминокислот. (Лекция 15)
Обмен простых белков. Дезаминирование и трансаминирование аминокислот. (Лекция 15) Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды»
Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды» Биохимия печени
Биохимия печени Менделеев Дмитрий Иванович (1834-1907)
Менделеев Дмитрий Иванович (1834-1907) Вода. Свойства воды
Вода. Свойства воды Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Алюминий и его соединения
Алюминий и его соединения