Configuraţia electronică a elementelor
.
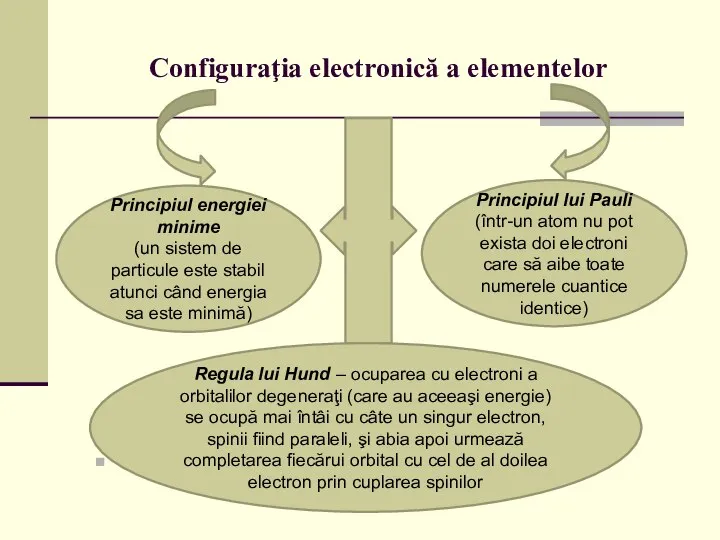
Principiul energiei minime
(un sistem de particule este
stabil atunci când energia sa este minimă)
Principiul lui Pauli (într-un atom nu pot exista doi electroni care să aibe toate numerele cuantice identice)
Regula lui Hund – ocuparea cu electroni a orbitalilor degeneraţi (care au aceeaşi energie) se ocupă mai întâi cu câte un singur electron, spinii fiind paraleli, şi abia apoi urmează completarea fiecărui orbital cu cel de al doilea electron prin cuplarea spinilor



 Ароматические углеводороды
Ароматические углеводороды Основные понятия и определения. Хроматография
Основные понятия и определения. Хроматография Электрохимические производства
Электрохимические производства Лекарственные средства, производные пиридина и пиперазина. (Тема 3)
Лекарственные средства, производные пиридина и пиперазина. (Тема 3) Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Оксид металлов
Оксид металлов Галогены. Способы получения, применение
Галогены. Способы получения, применение Камни и Козерог
Камни и Козерог Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Фосфор Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.
Фосфор Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.  Enantioselective Total Synthesis
Enantioselective Total Synthesis Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Чипсы: Вред или польза?. 9 класс
Чипсы: Вред или польза?. 9 класс Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики
Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности Возбудители колибактериоза
Возбудители колибактериоза Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Предельные углеводороды. Метан как представитель предельных углеводородов
Предельные углеводороды. Метан как представитель предельных углеводородов Качественный анализ (часть 1)
Качественный анализ (часть 1) Соляная кислота (HCI)
Соляная кислота (HCI) Пестицидтердің жіктелуі
Пестицидтердің жіктелуі Органические вещества: липиды
Органические вещества: липиды Соли серной кислоты
Соли серной кислоты Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Химическая связь 11 класс
Химическая связь 11 класс  Неорганические соединения серы
Неорганические соединения серы