Содержание
- 2. 1825 год. Майкл Фарадей выделил бензол из светильного газа.
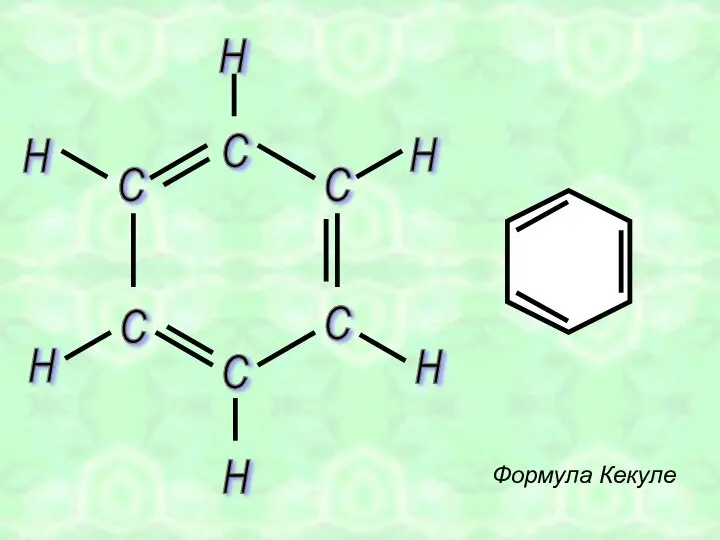
- 3. 1865 год Фридрих-Август Кекуле открыл структуру бензола
- 4. С С С С С С Формула Кекуле
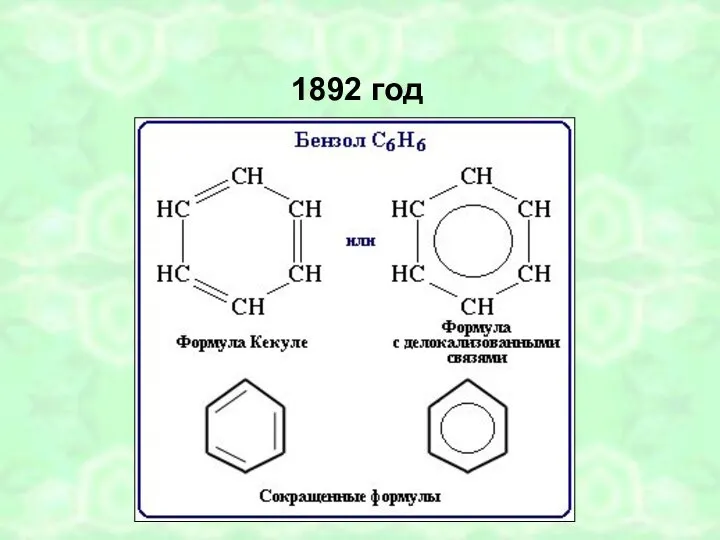
- 5. 1892 год
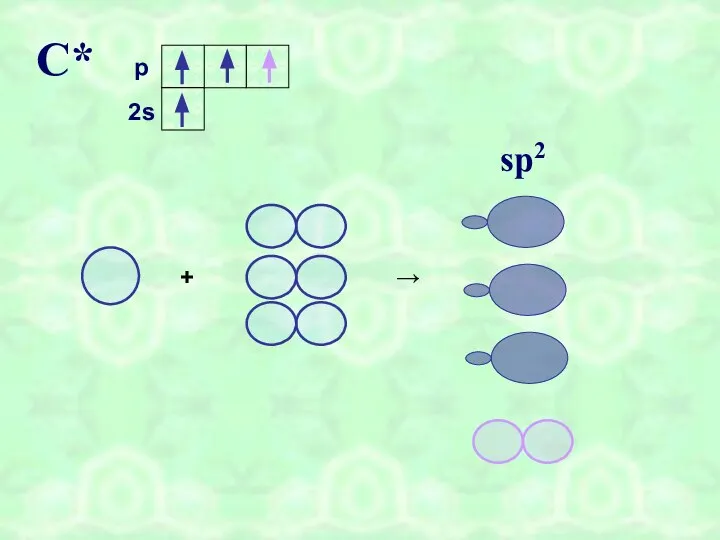
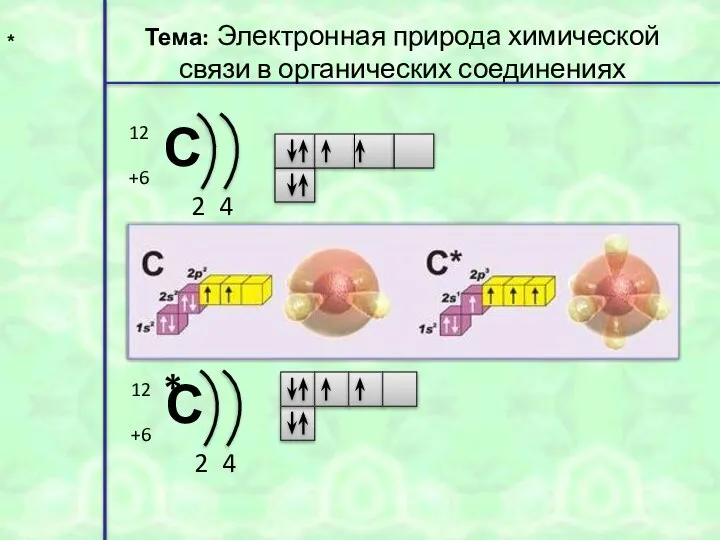
- 6. С* sp2 2s p + →
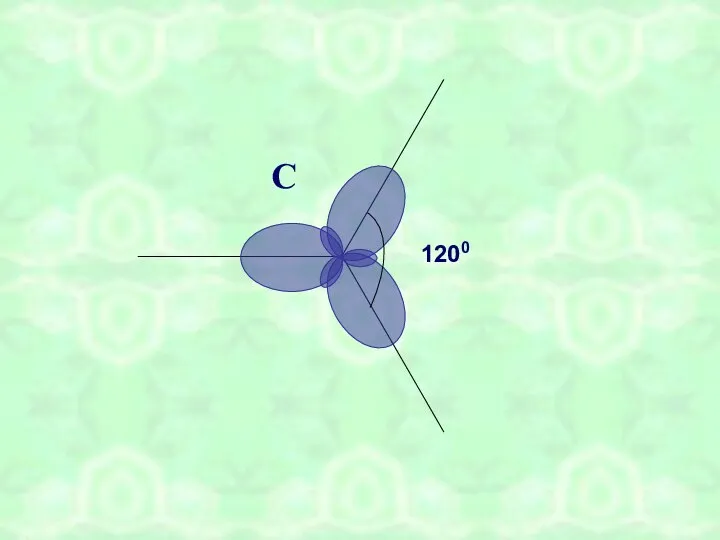
- 7. С 1200
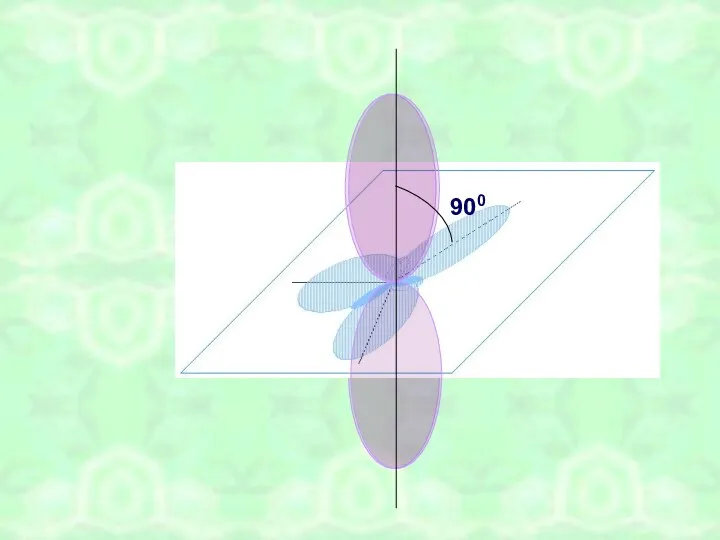
- 8. 900
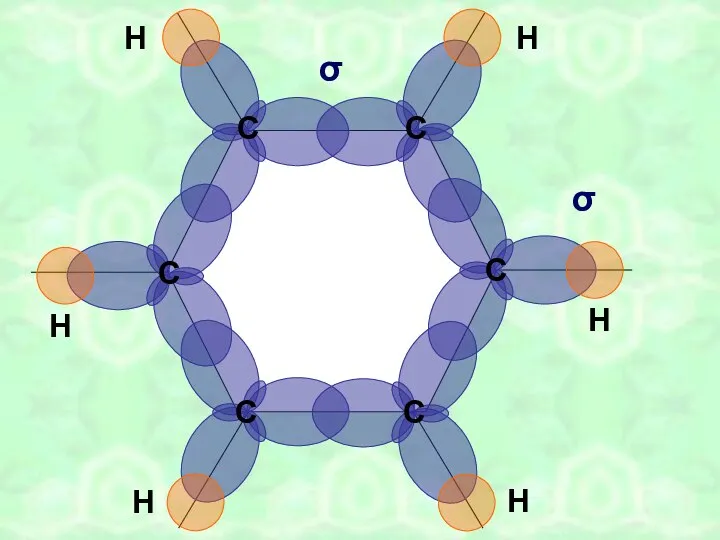
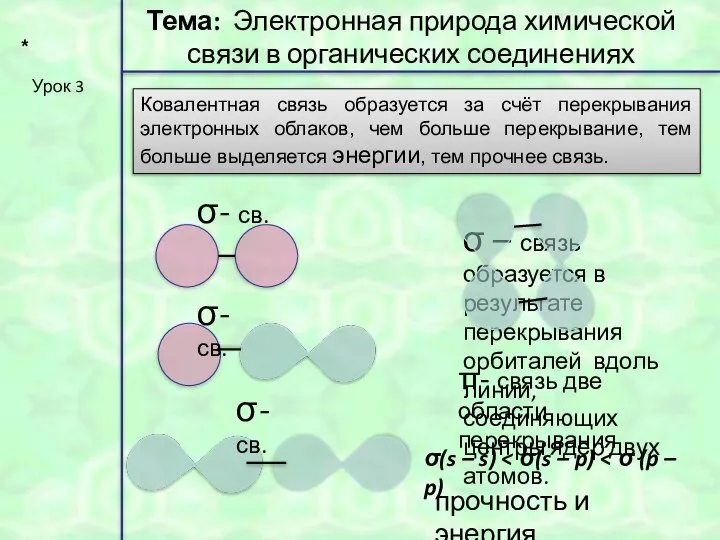
- 9. σ σ
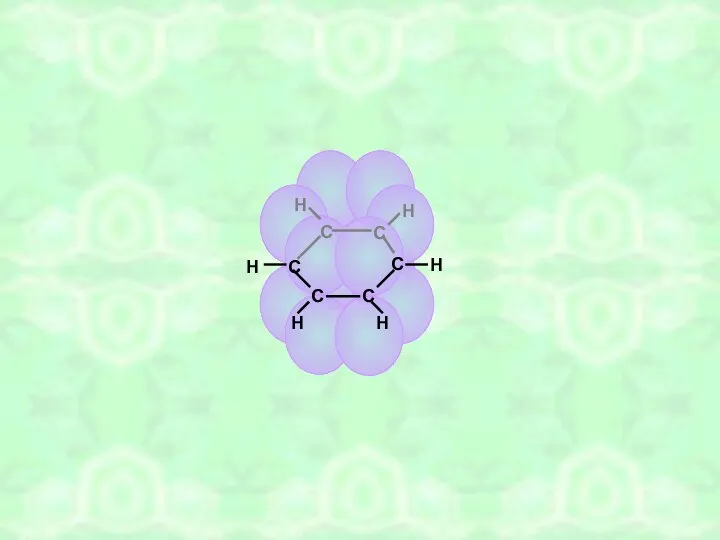
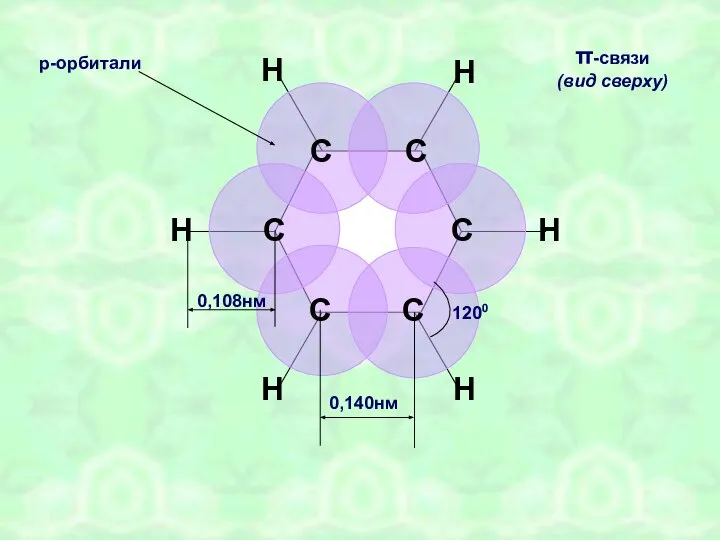
- 12. С С С С С С Н Н Н Н Н Н 0,140нм π-связи (вид сверху)
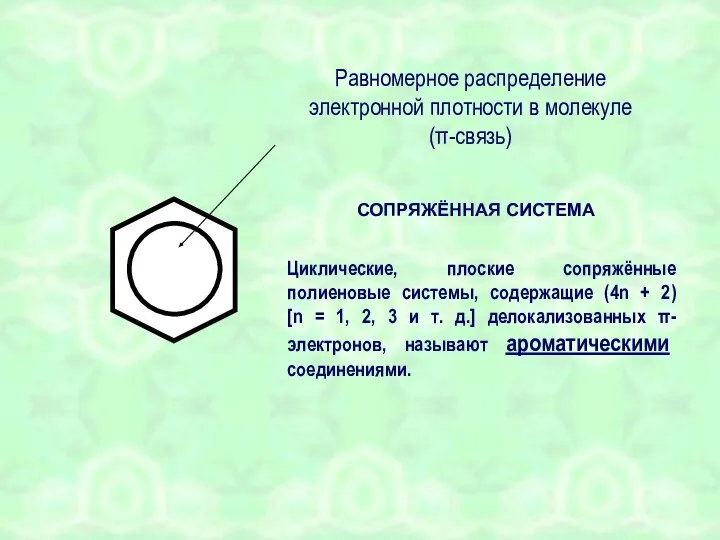
- 13. СОПРЯЖЁННАЯ СИСТЕМА Равномерное распределение электронной плотности в молекуле (π-связь) Циклические, плоские сопряжённые полиеновые системы, содержащие (4n
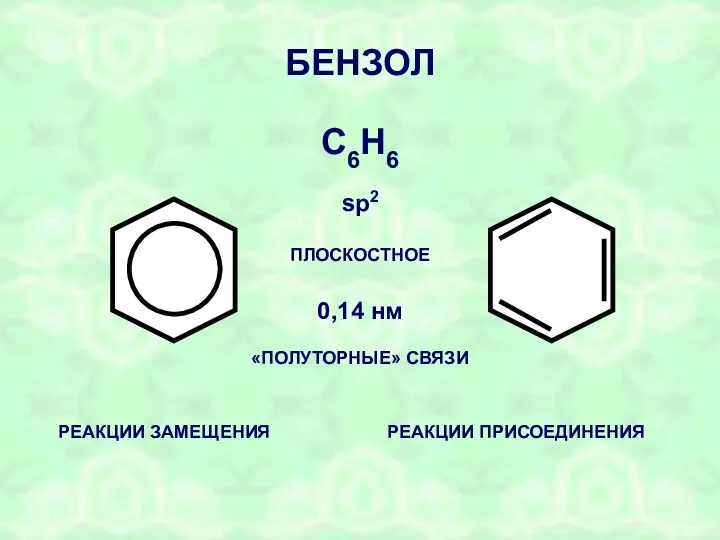
- 14. БЕНЗОЛ С6Н6 ПЛОСКОСТНОЕ sp2 0,14 нм «ПОЛУТОРНЫЕ» СВЯЗИ РЕАКЦИИ ЗАМЕЩЕНИЯ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
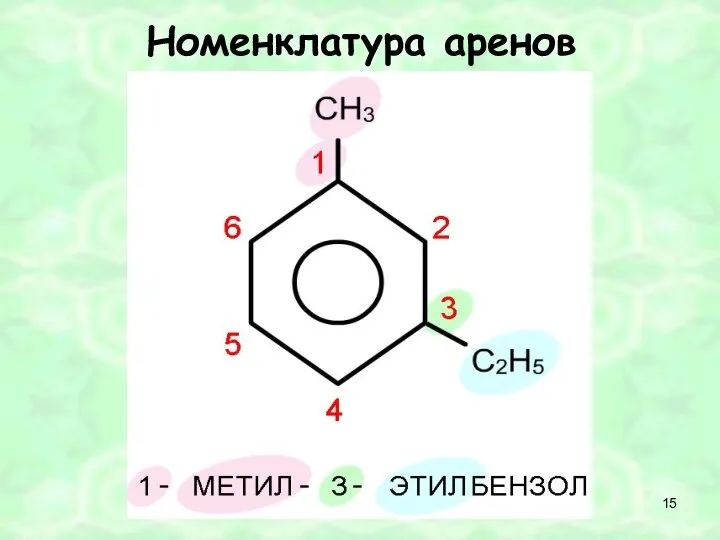
- 15. Номенклатура аренов
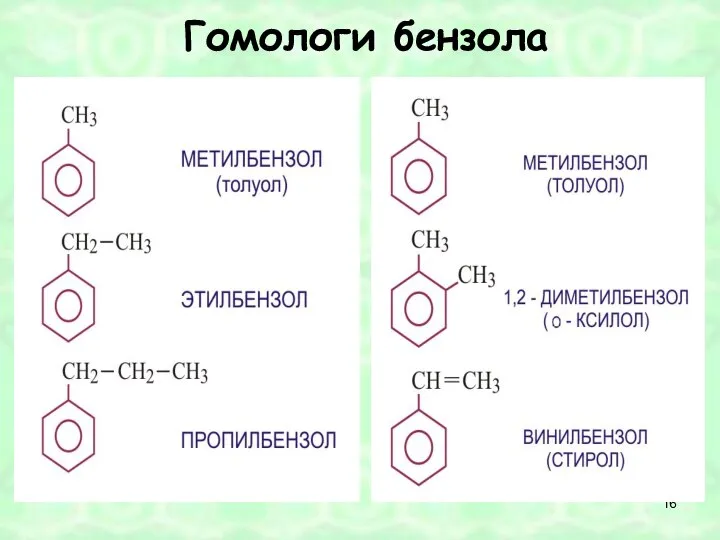
- 16. Гомологи бензола
- 17. БЕНЗОЛ – бесцветная жидкость со своеобразным запахом, не растворяется в воде, хорошо смешивается с неполярными органическими
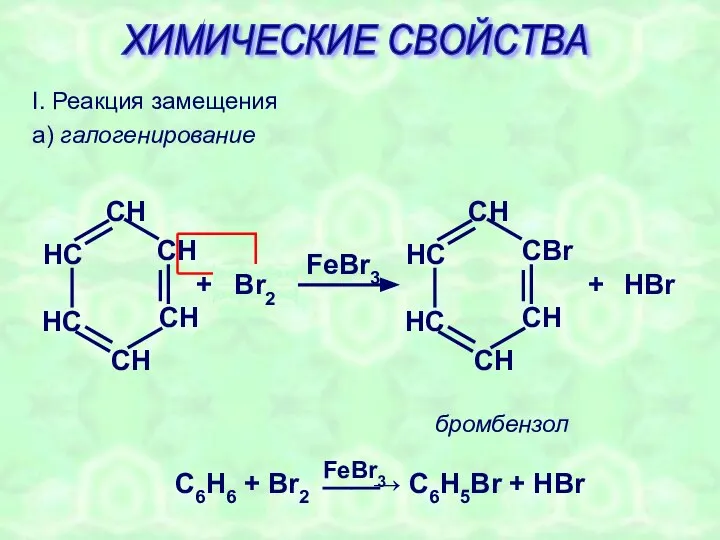
- 18. I. Реакция замещения а) галогенирование + BrBr FeBr3 + HBr бромбензол Br2 ХИМИЧЕСКИЕ СВОЙСТВА
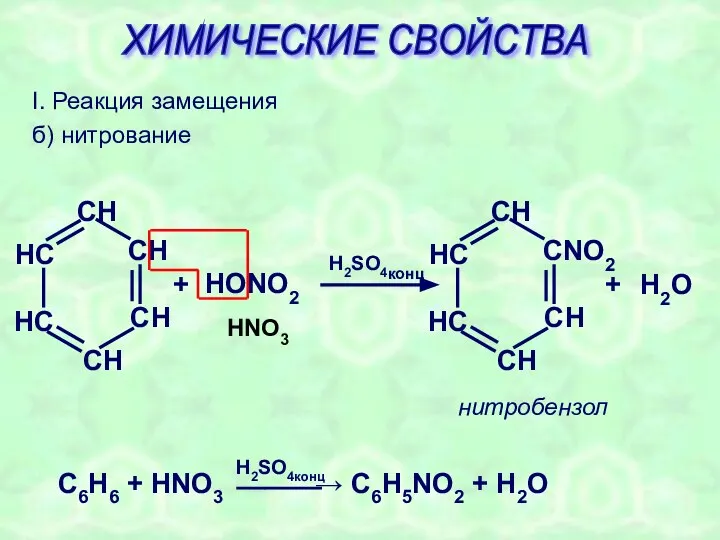
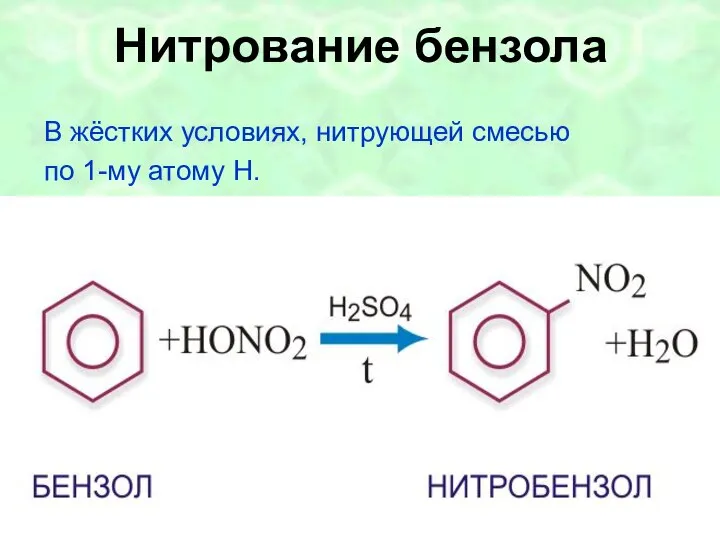
- 19. I. Реакция замещения б) нитрование + HONO2 H2SO4конц + H2O HNO3 нитробензол ХИМИЧЕСКИЕ СВОЙСТВА
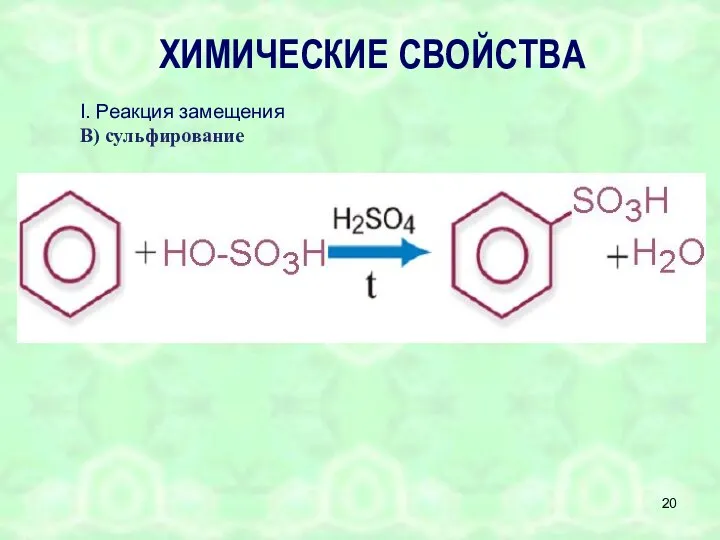
- 20. ХИМИЧЕСКИЕ СВОЙСТВА I. Реакция замещения В) сульфирование
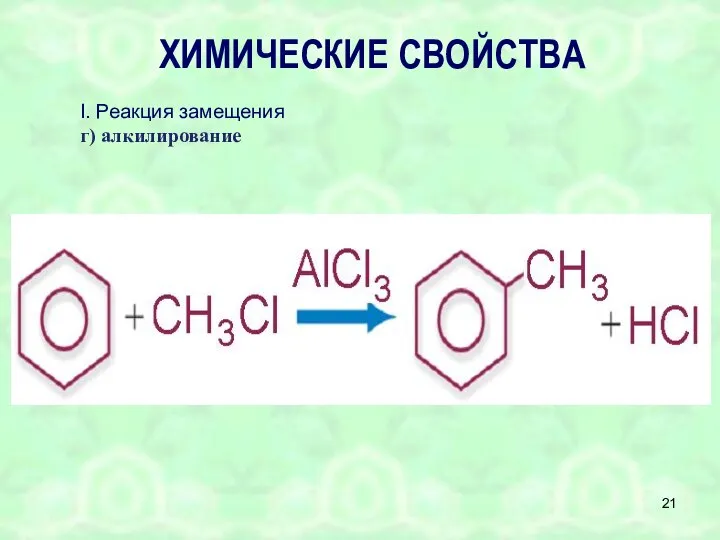
- 21. ХИМИЧЕСКИЕ СВОЙСТВА I. Реакция замещения г) алкилирование
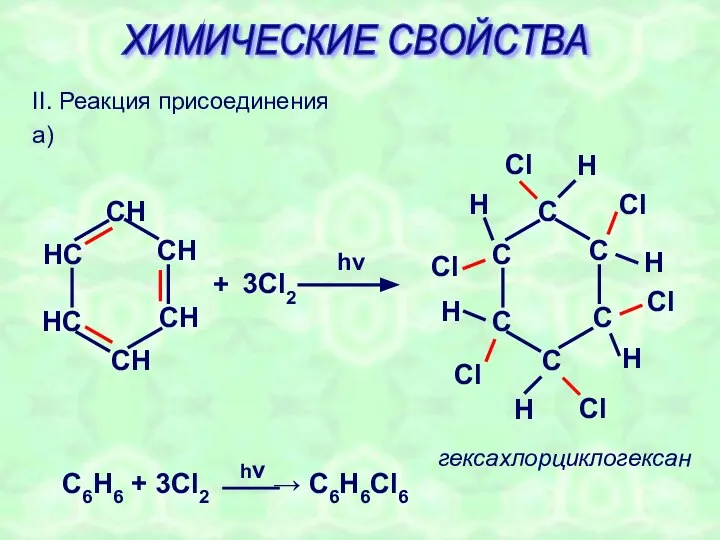
- 22. II. Реакция присоединения а) + 3Cl2 hν гексахлорциклогексан H ХИМИЧЕСКИЕ СВОЙСТВА
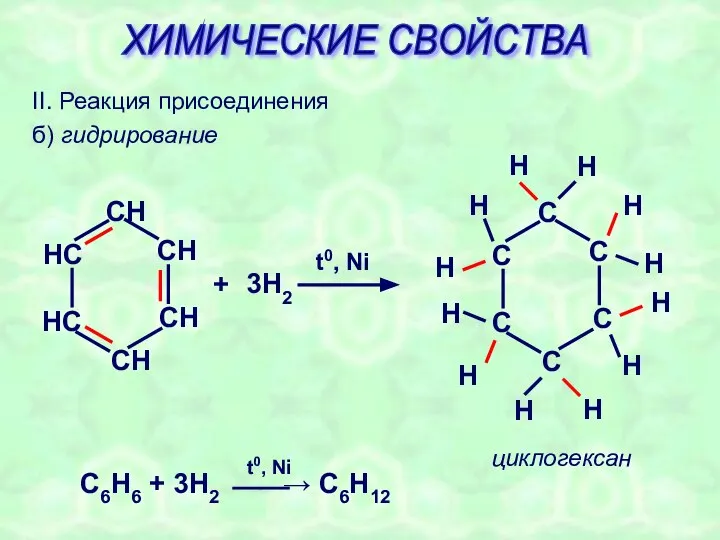
- 23. II. Реакция присоединения б) гидрирование + 3H2 t0, Ni циклогексан ХИМИЧЕСКИЕ СВОЙСТВА
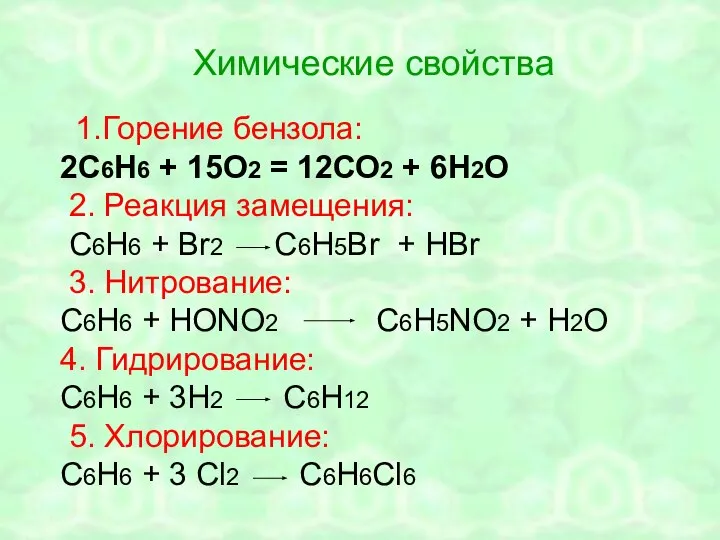
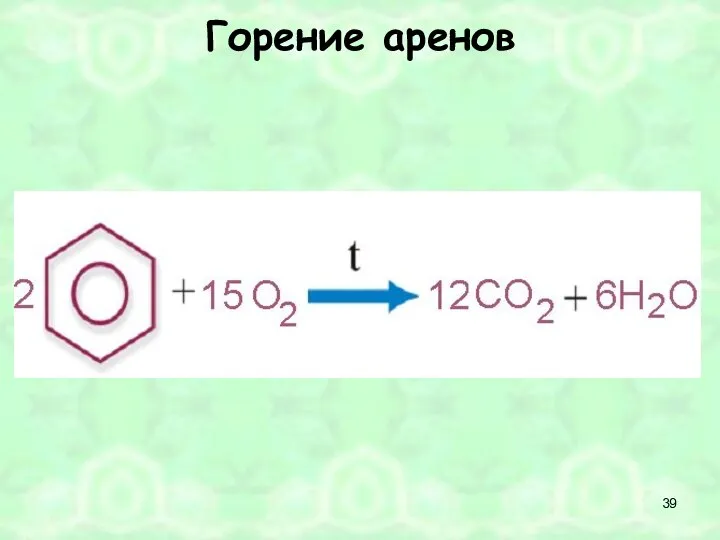
- 24. Химические свойства 1.Горение бензола: 2С6Н6 + 15О2 = 12СО2 + 6Н2О 2. Реакция замещения: С6Н6 +
- 25. ПОЛУЧЕНИЕ БЕНЗОЛА Бензол получают из каменноугольной смолы, образующейся при коксовании угля. В настоящее время бензол получают
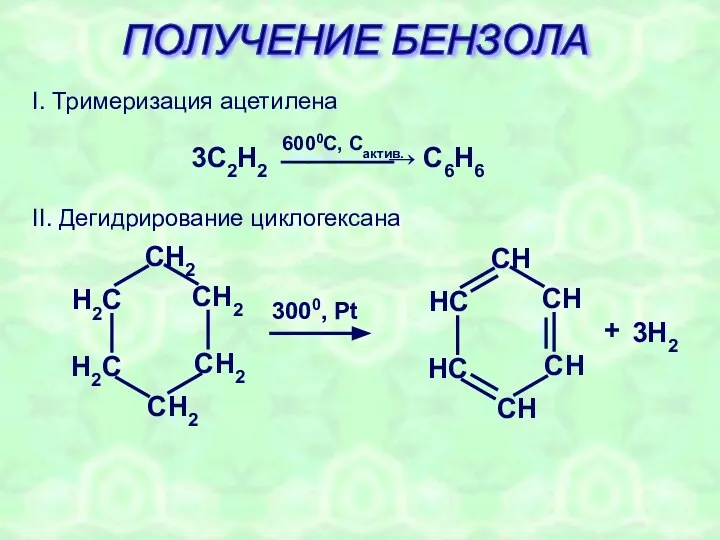
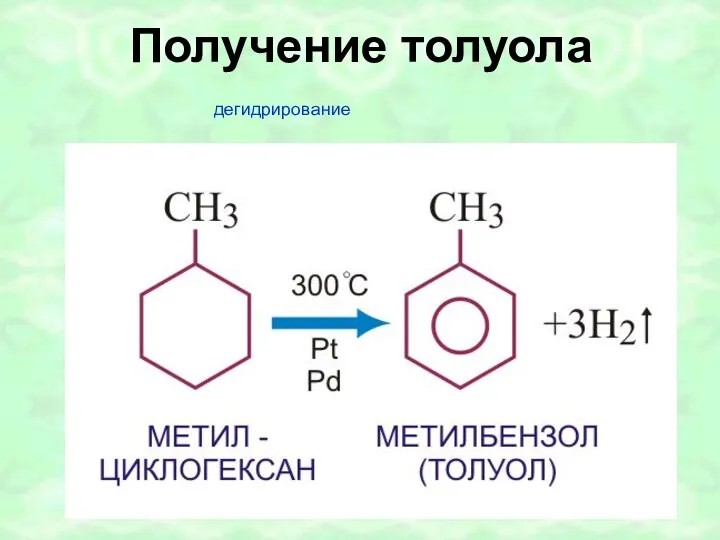
- 26. ПОЛУЧЕНИЕ БЕНЗОЛА I. Тримеризация ацетилена II. Дегидрирование циклогексана + 3H2 3000, Pt
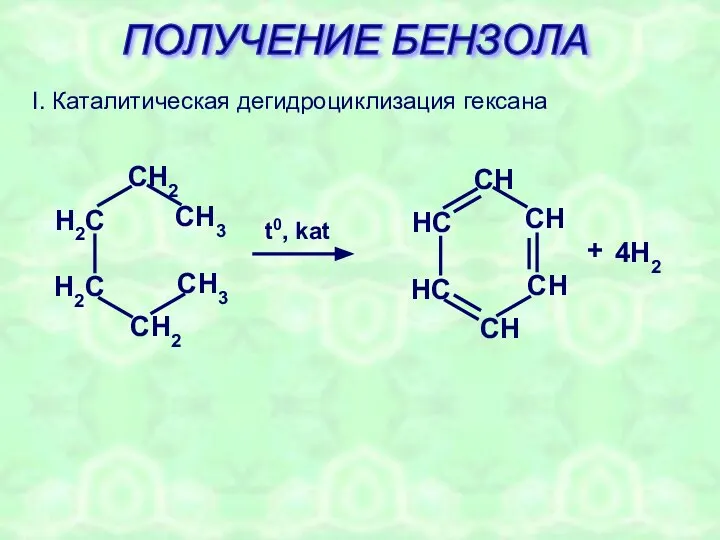
- 27. ПОЛУЧЕНИЕ БЕНЗОЛА I. Каталитическая дегидроциклизация гексана + 4H2 t0, kat
- 28. Сырьё для синтеза: Стирола (для производства полистирола) Кумола (для производства фенола и ацетона) Циклогексана (для производства
- 29. * Тема: Электронная природа химической связи в органических соединениях *
- 30. * Урок 3 Тема: Электронная природа химической связи в органических соединениях Органические вещества обладают молекулярным строением.
- 31. * Урок 3 Тема: Электронная природа химической связи в органических соединениях Ковалентная связь образуется за счёт
- 32. * Урок 3 Тема: Электронная природа химической связи в органических соединениях Определения: радикалы, ионы, свободнорадикальные реакции,
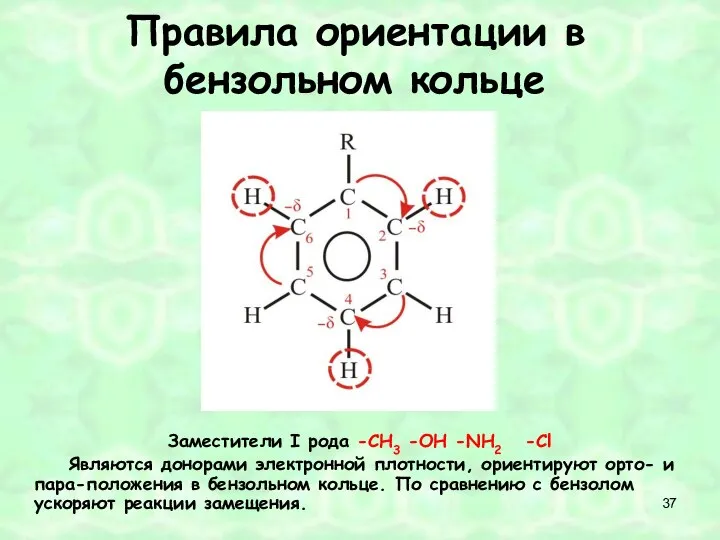
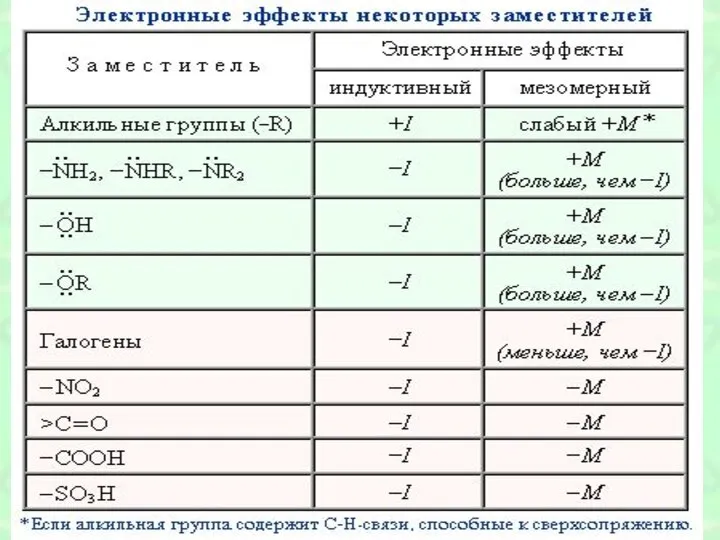
- 33. Правила ориентации в бензольном кольце Правило № 1 Заместители, обладающие положительными мезомерным или индуктивным эффектом, отталкивают
- 34. Заместители первого рода Предельные радикалы -ОН -SН NH2 -Hal
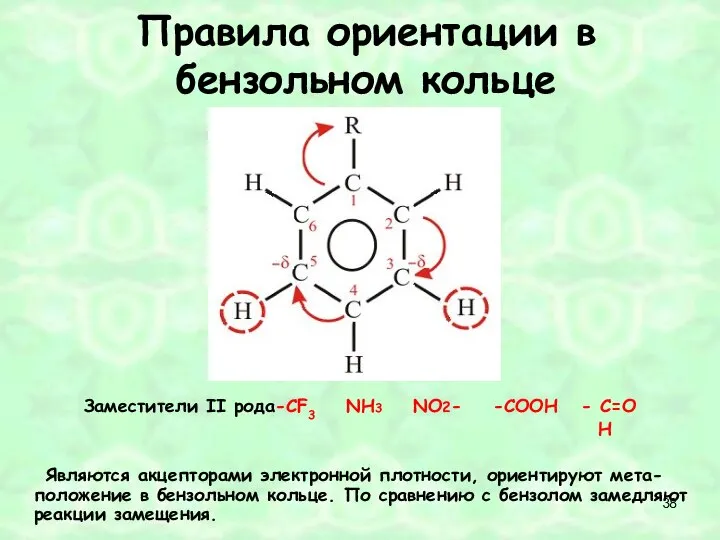
- 35. Правило 2 Заместители, обладающие отрицательными мезомерным эффектом, притягивают электронную плотность к себе, поэтому на бензольном радикале
- 36. Заместители второго рода -CN -CO -COOH -NO2 -CF3
- 37. Правила ориентации в бензольном кольце Заместители I рода -СН3 -ОН -NН2 -Сl Являются донорами электронной плотности,
- 38. Правила ориентации в бензольном кольце Заместители II рода-СF3 NH3 NO2- -СOOН - С=O H Являются акцепторами
- 39. Горение аренов
- 40. Гомологи бензола
- 41. Получение толуола дегидрирование
- 42. Нитрование бензола В жёстких условиях, нитрующей смесью по 1-му атому H.
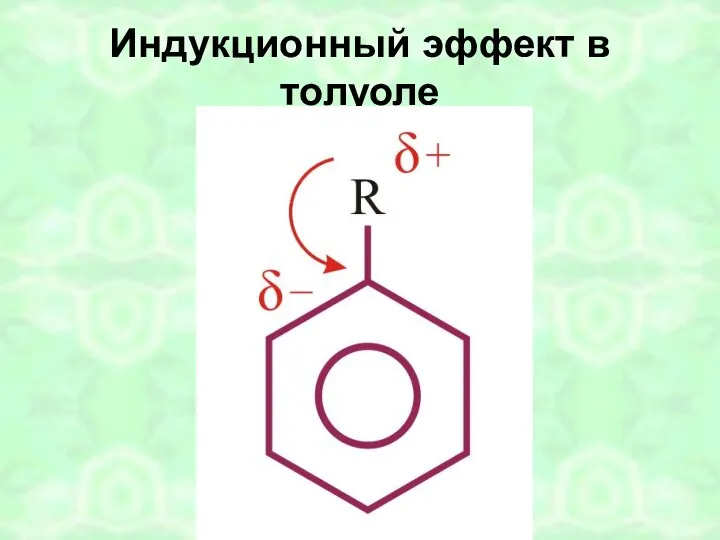
- 43. Индукционный эффект в толуоле
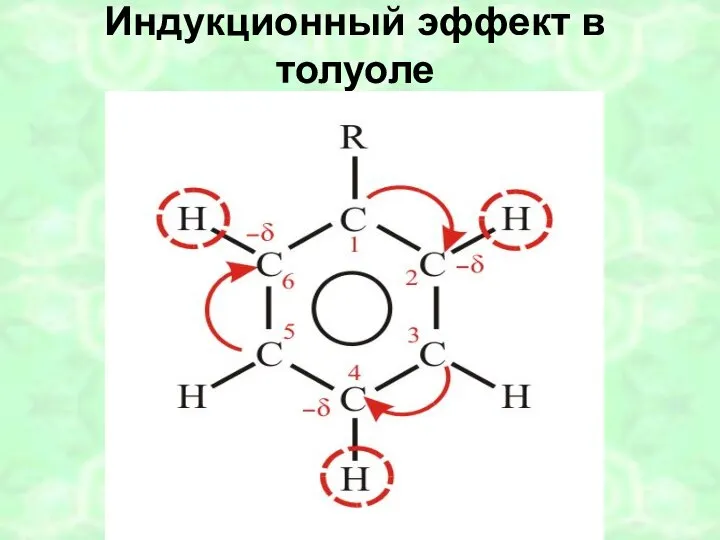
- 44. Индукционный эффект в толуоле
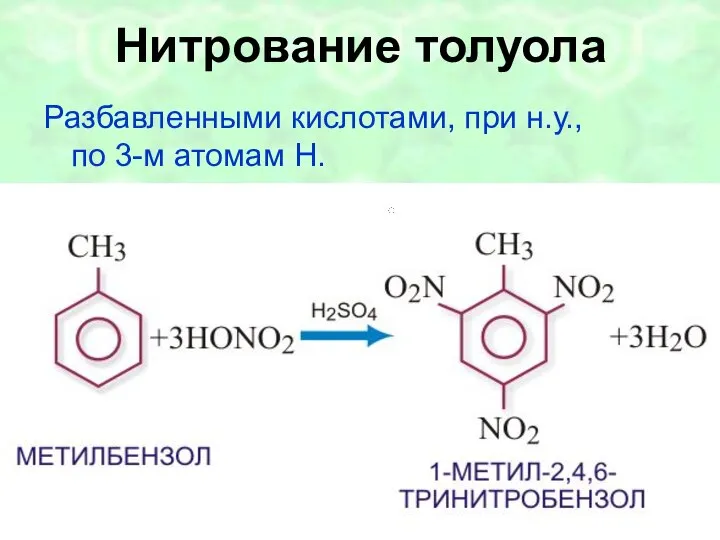
- 45. Нитрование толуола Разбавленными кислотами, при н.у., по 3-м атомам H.
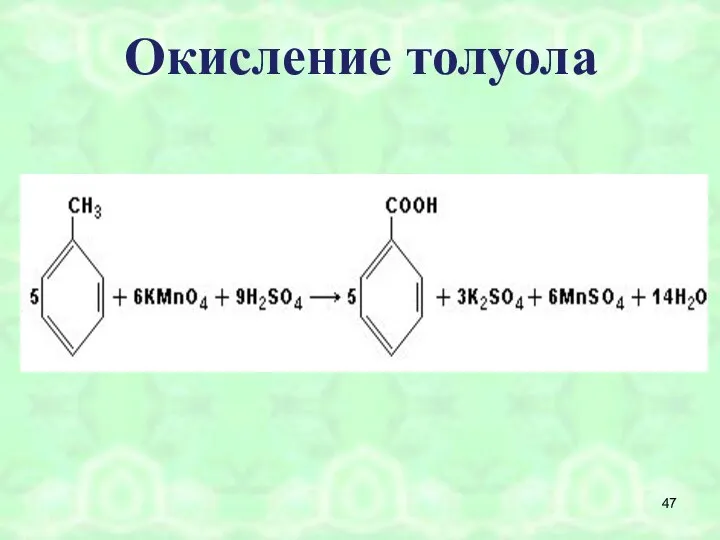
- 46. Окисление толуола (схема реакции) C6H5 –CH3 +[O] C6H5 –COOH бензойная кислота t° C KMnO4
- 47. Окисление толуола
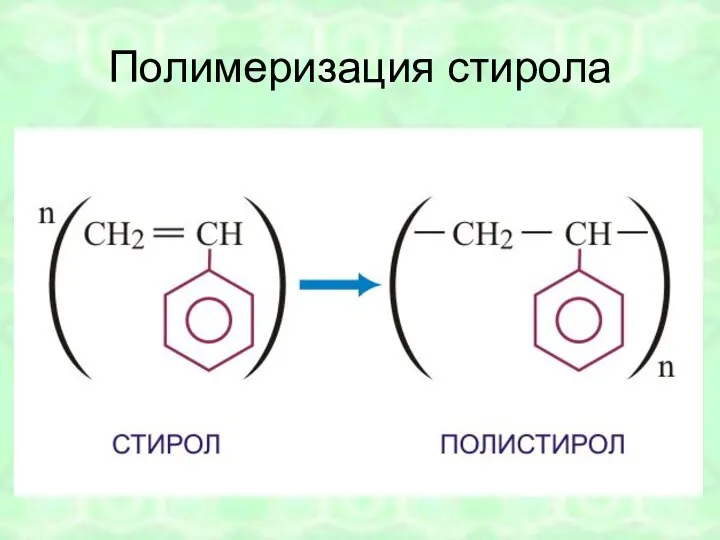
- 48. Полимеризация стирола
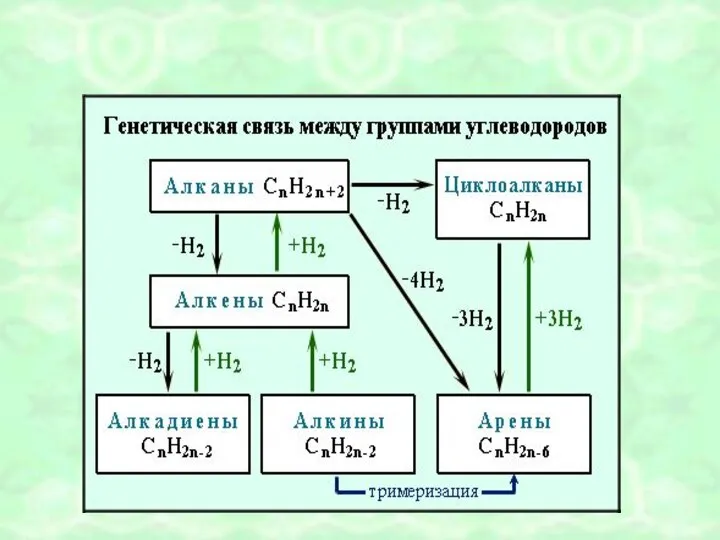
- 49. ОБОБЩЕНИЕ
- 53. О ЗАЩИТЕ ОТ ОПАСНОСТИ ОТРАВЛЕНИЯ БЕНЗОЛОМ КОНВЕНЦИЯ МЕЖДУНАРОДНАЯ ОРГАНИЗАЦИЯ ТРУДА 2 июня 1971 г. Генеральная Конференция
- 55. Скачать презентацию













![Окисление толуола (схема реакции) C6H5 –CH3 +[O] C6H5 –COOH бензойная кислота t° C KMnO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1398164/slide-45.jpg)



 zakon_postoyanstva_sostava8kh
zakon_postoyanstva_sostava8kh Жидкий аммиак
Жидкий аммиак МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М.
МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М. Химическая связь
Химическая связь Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева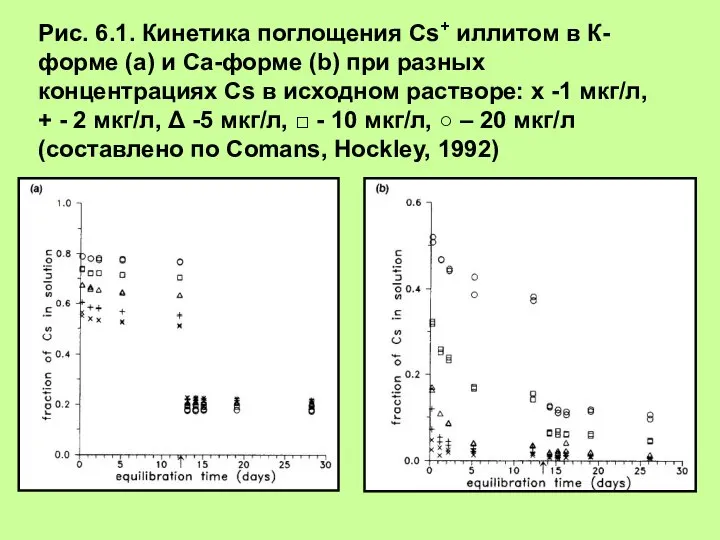 Определение коэффициента селективности при бинарном обмене
Определение коэффициента селективности при бинарном обмене Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер
Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер Камни и Скорпион
Камни и Скорпион Современная система контроля и обеспечения качества лекарственных средств в Украине
Современная система контроля и обеспечения качества лекарственных средств в Украине Атомный уровень. Химия простых веществ. Молекулярный уровень. Химия соединений. Живое субклеточный уровень
Атомный уровень. Химия простых веществ. Молекулярный уровень. Химия соединений. Живое субклеточный уровень Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Полиморфизм. Аллотропия
Полиморфизм. Аллотропия Нуклеиновые кислоты (строение, свойства и синтез). Тема 14
Нуклеиновые кислоты (строение, свойства и синтез). Тема 14 Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества
Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества Якісні реакції органічних речовин
Якісні реакції органічних речовин Дисперсные системы
Дисперсные системы Полимеры с включением атомов бора и карборановой группировки - полиборорганосилоксаны и поликарборанорганосилосксаны
Полимеры с включением атомов бора и карборановой группировки - полиборорганосилоксаны и поликарборанорганосилосксаны D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Мембранные механизмы патологии клетки. Моделирование гипоксического повреждения
Мембранные механизмы патологии клетки. Моделирование гипоксического повреждения Водородный показатель - рН
Водородный показатель - рН Использование углеводородов в медицине
Использование углеводородов в медицине Аттестационная работа. «Образовательная программа внеурочной деятельности по химии «Занимательная химия»
Аттестационная работа. «Образовательная программа внеурочной деятельности по химии «Занимательная химия» 1. История и актуальность темы. 2. Получение стекломассы 3. Стеклянные изделия 4. Применение и виды стекла: Энергосберегающ
1. История и актуальность темы. 2. Получение стекломассы 3. Стеклянные изделия 4. Применение и виды стекла: Энергосберегающ АЛКАНЫ Строение молекулы метана. Свойства метана и его гомологов.
АЛКАНЫ Строение молекулы метана. Свойства метана и его гомологов.  Торий
Торий