Содержание
- 3. Элементы VIIВ группы
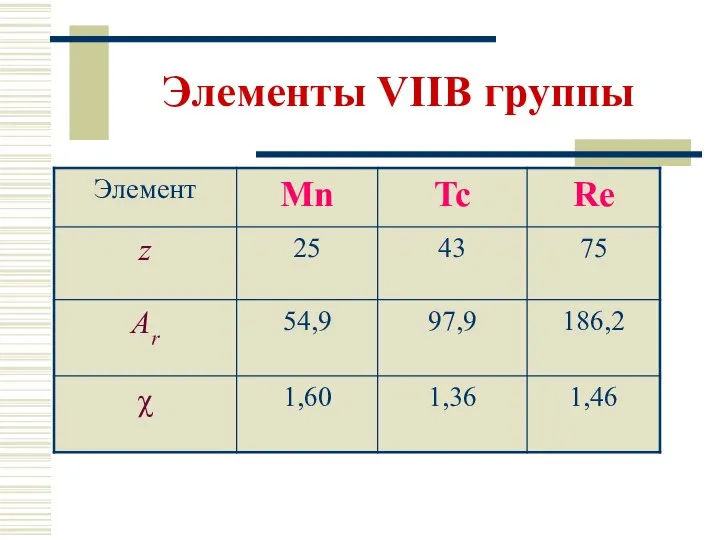
- 4. Элементы VIIВ группы Общая электронная формула: […] ns2 (n–1)d5 Степени окисления: +II ÷ +VII КЧ 4,
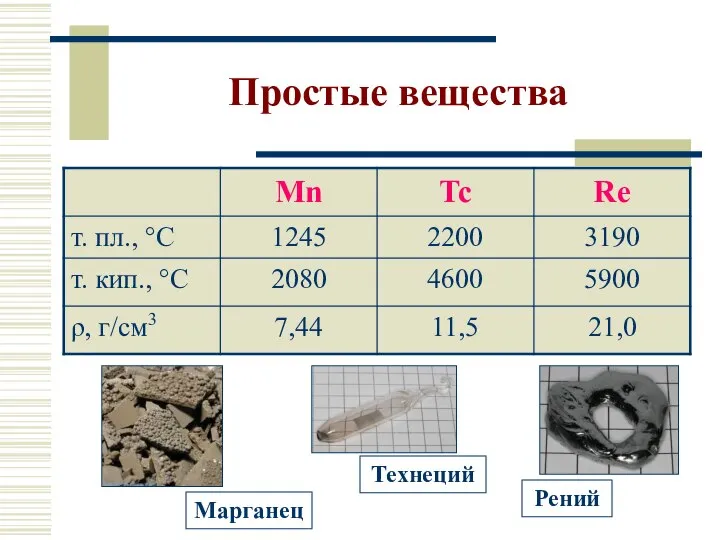
- 5. Простые вещества
- 6. В ЭХРН: … Mn …H ... Re …Tc Mn2+/Mn ReO4–/Re TcO4–/Tc ϕ°, В: –1,19 +0,37 +0,47
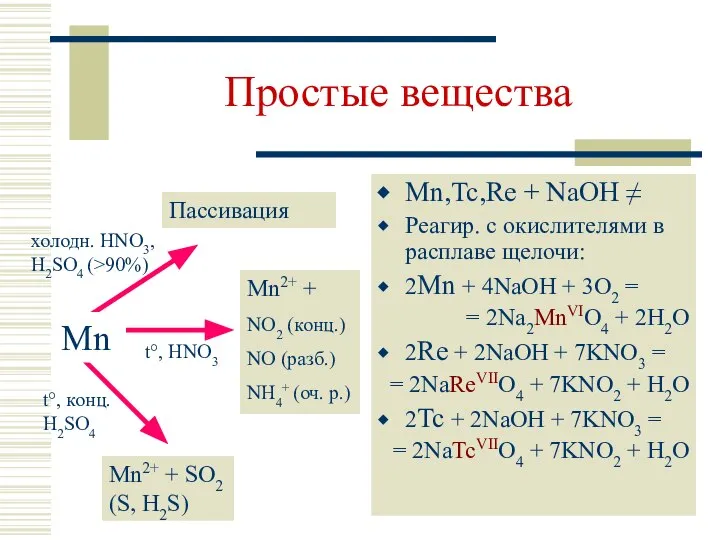
- 7. Простые вещества Mn,Tc,Re + NaOH ≠ Реагир. с окислителями в расплаве щелочи: 2Mn + 4NaOH +
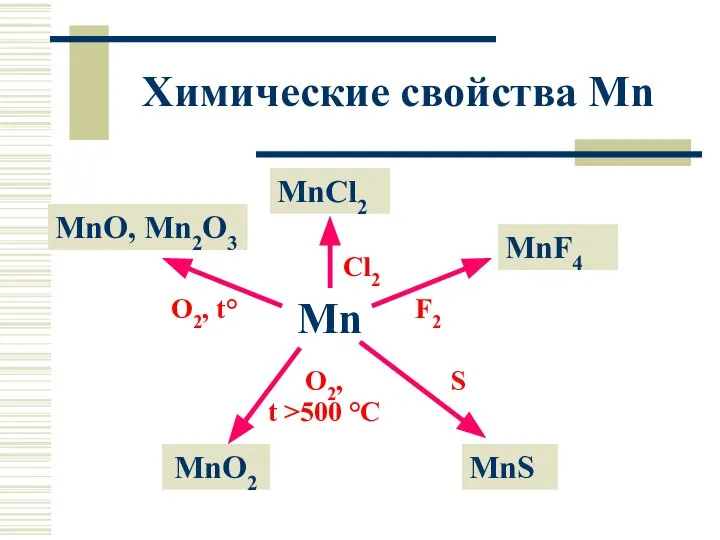
- 8. Химические свойства Mn Mn MnCl2 MnO, Mn2O3 MnF4 MnO2 MnS
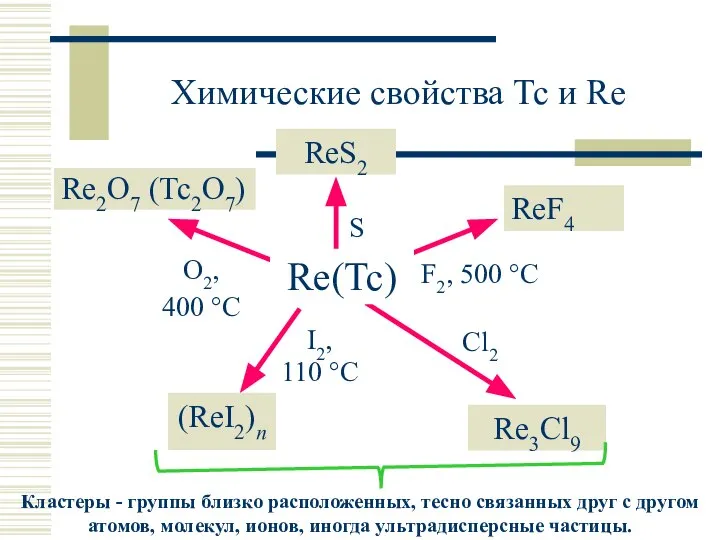
- 9. Химические свойства Tc и Re ReS2 Re2O7 (Tc2O7) ReF4 (ReI2)n Re3Cl9 Re(Tc)
- 10. Строение [Re3Cl9]
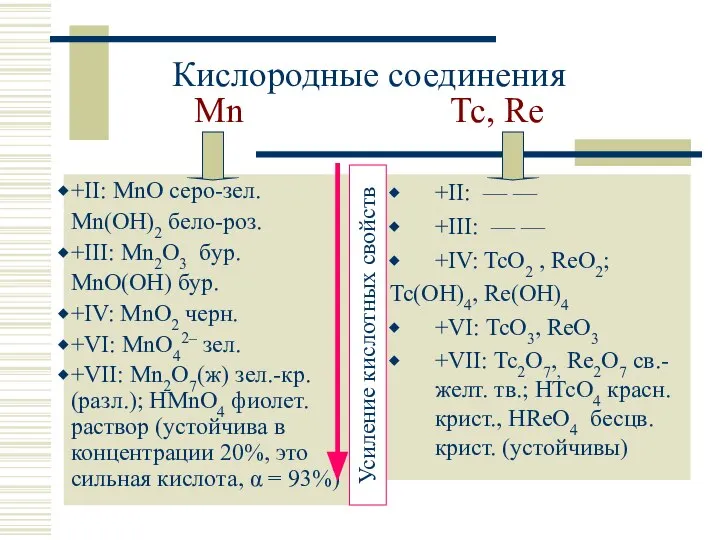
- 11. Кислородные соединения Mn Tc, Re +II: MnO серо-зел. Mn(OH)2 бело-роз. +III: Mn2O3 бур. MnO(OH) бур. +IV:
- 12. Распространение в природе и важнейшие минералы 14. Mn 0,085 % масс. 81. Re – редкий рассеянный
- 13. Минералы марганца Пиролюзит MnO2 Гаусманит (MnIIMn2III)O4 Манганит MnO(OH) Родохрозит MnCO3 Гюбнерит MnWO4 Вольфрамит (Mn, Fe)WO4 Псиломелан
- 14. Получение металлов Mn: а) электролиз раствора MnSO4 б) MnO2 + Si = Mn + SiO2 3MnO2
- 15. Марганец Активный металл. Устойч. ст.ок. +II (в кисл. среде) и +IV. В ст.ок. +II похож на
- 16. Марганец(II) MnO1÷1,13 – нестехиом. (изб. O–II, до 6,5% ат. Mn в крист. реш. имеют ст.ок.+III); полупроводник.
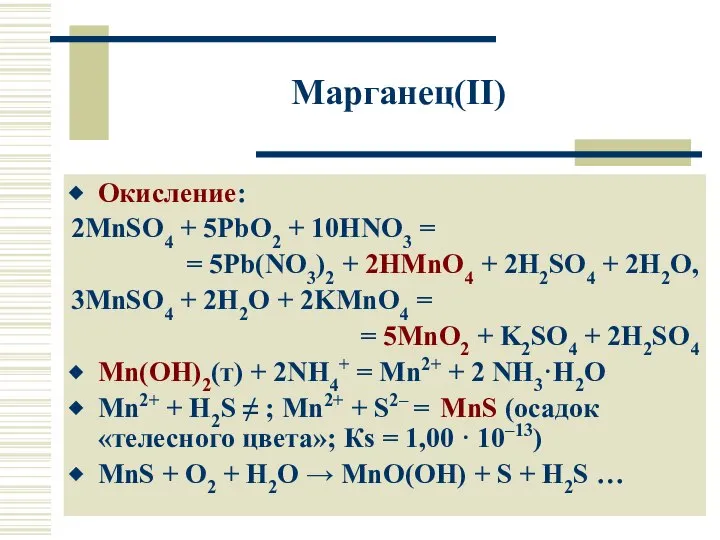
- 17. Марганец(II) Окисление: 2MnSO4 + 5PbO2 + 10HNO3 = = 5Pb(NO3)2 + 2HMnO4 + 2H2SO4 + 2H2O,
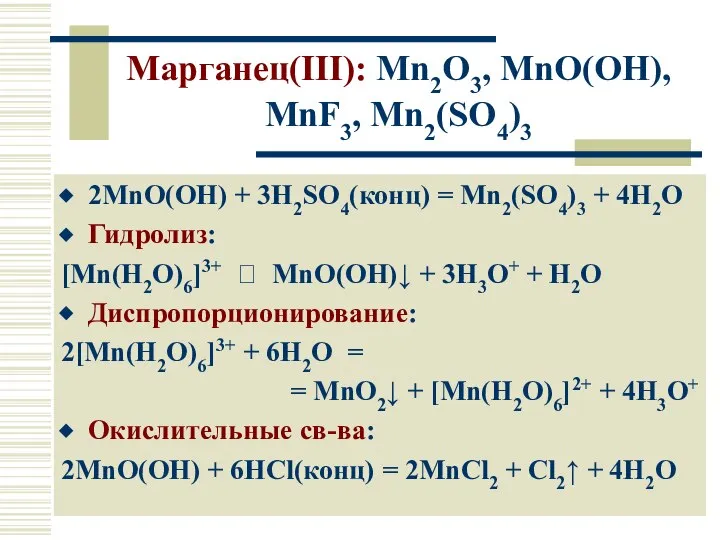
- 18. Марганец(III): Mn2O3, MnO(OH), MnF3, Mn2(SO4)3 2MnO(OH) + 3H2SO4(конц) = Mn2(SO4)3 + 4H2O Гидролиз: [Mn(H2O)6]3+ ⮀ MnO(OH)↓
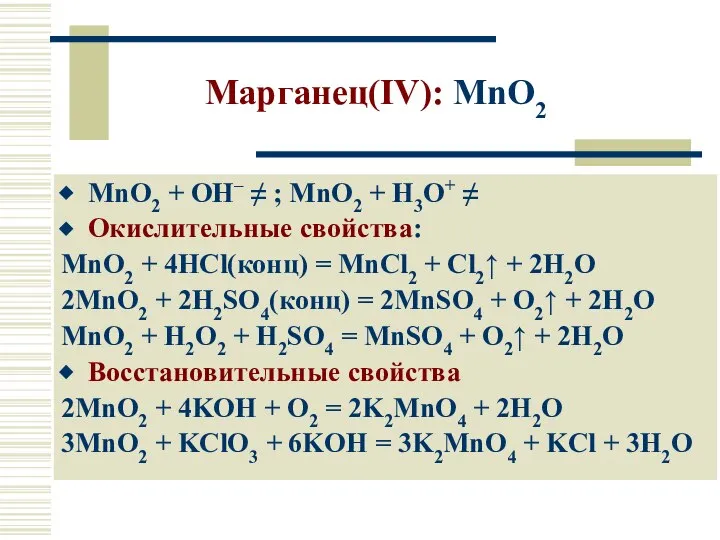
- 19. Марганец(IV): MnO2 MnO2 + OH– ≠ ; MnO2 + H3O+ ≠ Окислительные свойства: MnO2 + 4HCl(конц)
- 20. Марганец(IV): MnO2 Получение MnO2 : 3MnCO3 + KClO3 = 3MnO2 + KCl + 3CO2↑ MnO2 –
- 21. Марганец(VI) В сильнощел. среде уст. соли, напр. K2MnO4. В растворе – диспропорционирует: 3MnO42− + 2H2O =
- 22. Марганец(VII) Mn2O7 – маслянистая жидк. Получение (видео): 2KMnO4 + 2H2SO4 = = Mn2O7 + 2KHSO4 +
- 23. Окислительные свойства рН MnO4– + 8H+ + 5e– = Mn2+ + 4H2O; Е° = +1,53 B
- 25. Скачать презентацию
![Элементы VIIВ группы Общая электронная формула: […] ns2 (n–1)d5 Степени окисления:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397698/slide-3.jpg)

![Строение [Re3Cl9]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397698/slide-9.jpg)









 Классификация витаминов. Витаминоподобные соединения
Классификация витаминов. Витаминоподобные соединения Жири і вітаміни як компоненти їжі і їх роль в організмі
Жири і вітаміни як компоненти їжі і їх роль в організмі  Спирты. Классификация спиртов
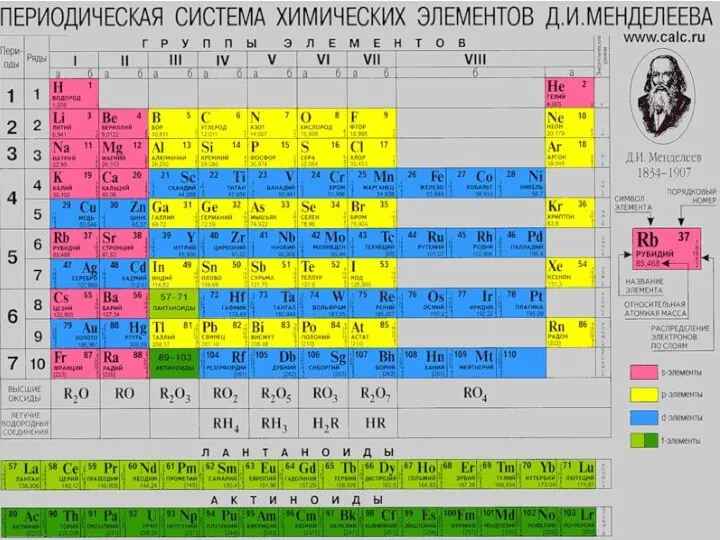
Спирты. Классификация спиртов Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Электрохимические методы анализа, часть 2. Кулонометрия. Вольтамперометрия
Электрохимические методы анализа, часть 2. Кулонометрия. Вольтамперометрия Медицинская химия, введение. (Лекция 1)
Медицинская химия, введение. (Лекция 1) Гели (Студни)
Гели (Студни) Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углеводный обмен. Глюкоза крови
Углеводный обмен. Глюкоза крови Презентация Состав газированной воды
Презентация Состав газированной воды Нефелиновые сиениты. Щелочные породы
Нефелиновые сиениты. Щелочные породы Углеводороды
Углеводороды Оксид металлов
Оксид металлов Тотығу дәрежесі. Тотығу-тотықсыздану реакциялары
Тотығу дәрежесі. Тотығу-тотықсыздану реакциялары Обмен липидов. Переваривание и всасывание липидов. (Тема 2-3)
Обмен липидов. Переваривание и всасывание липидов. (Тема 2-3) Ионные уравнения Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., 2014
Ионные уравнения Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., 2014 Скандий
Скандий Вcтуп до курсу «Класифікації отрут і отруєнь. Токсикометрія»
Вcтуп до курсу «Класифікації отрут і отруєнь. Токсикометрія» Презентация по Химии "Алканы, алкены, алкины: строение, изомерия и номенклатура" - скачать смотреть
Презентация по Химии "Алканы, алкены, алкины: строение, изомерия и номенклатура" - скачать смотреть  Алкины. Этин (Ацетилен)
Алкины. Этин (Ацетилен) Галогены в природе. Хлор, бром, иод
Галогены в природе. Хлор, бром, иод Полімери. Поліетилен.
Полімери. Поліетилен.  Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Расчет температуры вспышки. Классификация горючести жидкости
Расчет температуры вспышки. Классификация горючести жидкости Введение в органическую химию
Введение в органическую химию Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов