Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Содержание
- 2. Бериллий Строение элемента Физические свойства Химические свойства Способы получения Применение Интересные факты Опыты
- 3. Строение элемента
- 4. Распределение по уровням
- 5. Кристаллическая решётка Вид связи и кристаллическая решетка. Связь - металлическая Металлическая связь - химическая связь, которая
- 6. Физические свойства Легкий светло-серый металл. Высокая теплоемкость и теплопроводность. Низкое электросопротивление Хрупкий металл, плотность 1847,7 кг/м3
- 7. Химические свойства Химические свойства: Амфотерный гидроксид, оксид и гидрооксид бериллия реагируют со щелочами с образованием солей:
- 8. Основные реакции Взаимодействует с серной кислотой: Ве + 2Н2SO4(к) = BeSO4 + 2H2O + SO2 Ве
- 9. Основные реакции 2Ве + ЗН2O = ВеО↓ + Ве(ОН)2↓ + 2Н2↑ (кипение) Ве + 2НСl (разбавленный)
- 10. Основные реакции Ве + S = ВеS (1150 °С) ЗВе + N2 = Ве3N2 (700-900 °С)
- 11. Нахождение в природе Бериллий относится к редким элементам, его содержание в земной коре 2,6·10–4 % по
- 12. Способы получения В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид
- 13. Применение В рентгенотехнике. В ядерной энергетике, как замедлитель нейтронов. В лазерной технике для изготовления излучателей. В
- 14. Интересные факты Бериллий ядовит: Летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения
- 15. Опыты
- 16. Реакции из опытов Реакция бериллия со щёлочью (гидрооксидом натрия): Be + 2 NaOH+ 2H2O => Na2[Be(OH)4]
- 18. Скачать презентацию















 Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов
Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов «РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА
«РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА Белки, протеины, полипептиды
Белки, протеины, полипептиды Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочко
Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочко Углеводы. Сукралоза
Углеводы. Сукралоза Кремний
Кремний Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21) Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Кремний и его соединения
Кремний и его соединения Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Химия и физика полимеров. Курс лекций
Химия и физика полимеров. Курс лекций Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа
Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа Состояние и свойства воды
Состояние и свойства воды Лекция №4. Строение металлических сплавов
Лекция №4. Строение металлических сплавов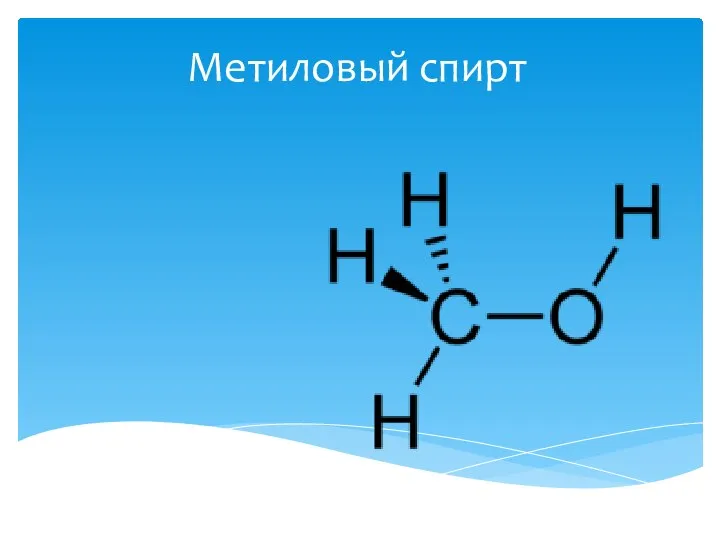 Метиловый спирт
Метиловый спирт Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно
Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно Пневматолито-гидротермальный процесс
Пневматолито-гидротермальный процесс Строение и свойства материалов
Строение и свойства материалов Азот в природе
Азот в природе Обменный и донорно-акцепторный механизм образования связи
Обменный и донорно-акцепторный механизм образования связи Кислоты: классификация, реакции, применение
Кислоты: классификация, реакции, применение Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Нуклеиновые кислоты
Нуклеиновые кислоты Эксперимент. Выращивание солевых кристаллов
Эксперимент. Выращивание солевых кристаллов Оксид серы IV. Сернистая кислота
Оксид серы IV. Сернистая кислота Липиды. Составные части липидов
Липиды. Составные части липидов Радиофармацевтическая химия
Радиофармацевтическая химия