Содержание
- 2. Неорганическая биохимия (в 2 томах) Ред. Эйхгорн Гюнтер, 1978 Основы химии живого Слесарев В.И., 2000 Биометаллоорганическая
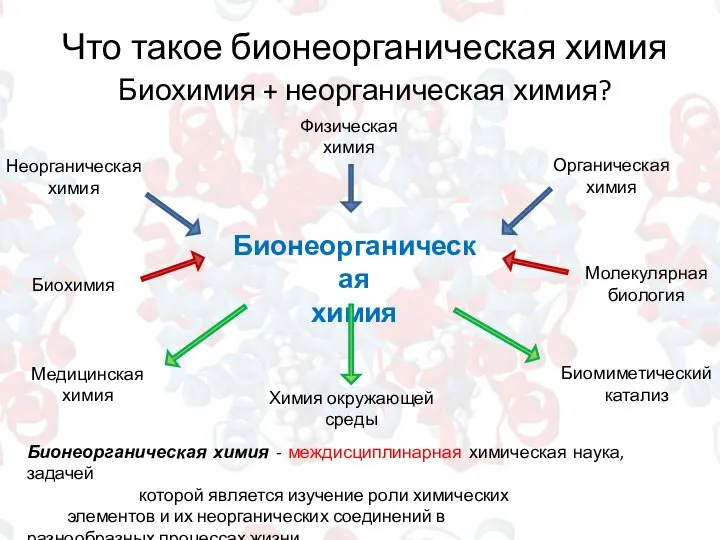
- 3. Что такое бионеорганическая химия Биохимия + неорганическая химия? Бионеорганическая химия Неорганическая химия Физическая химия Биохимия Органическая
- 4. Что такое бионеорганическая химия Задачи бионеорганической химии Изучение роли металлов и их соединений в живых организмах
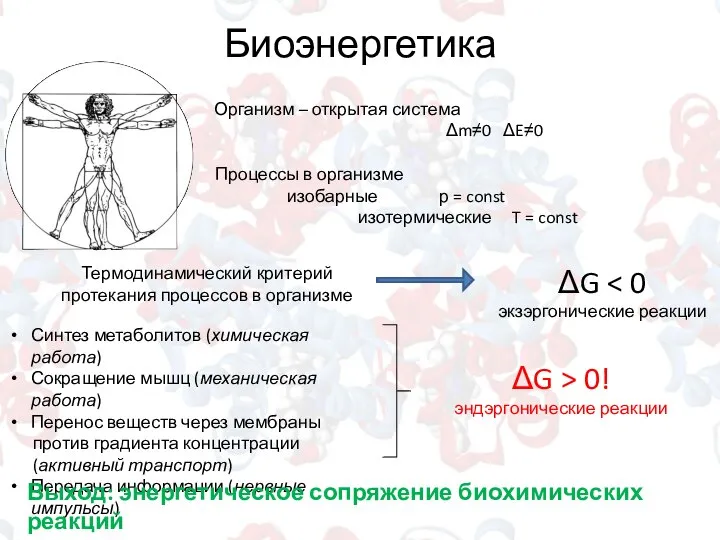
- 5. Биоэнергетика Организм – открытая система Δm≠0 ΔE≠0 Процессы в организме изобарные р = const изотермические T
- 6. Биоэнергетика Принцип энергетического сопряжения «Источники» энергии АТФ креатинфосфат фосфоенолпируват
- 7. Биоэнергетика Химическое равновесие и стационарное состояние ΔG = 0 Химическое равновесие Процессы не протекают Джозайя Гиббс
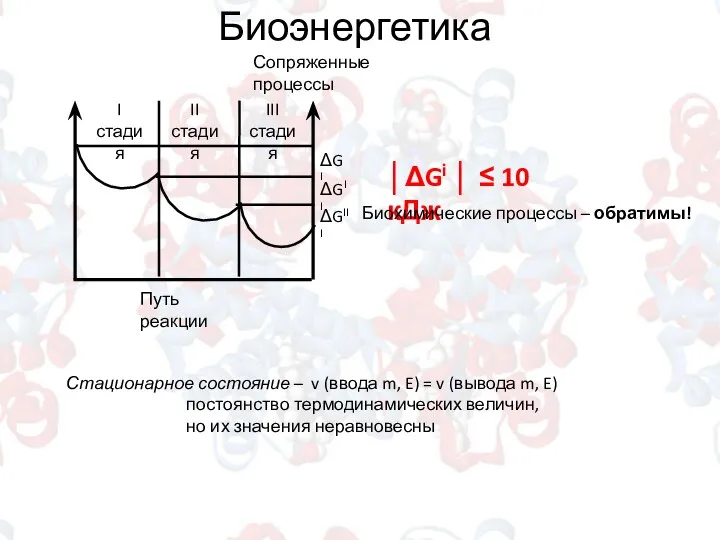
- 8. Биоэнергетика │ΔGi │ ≤ 10 кДж Биохимические процессы – обратимы! Стационарное состояние – v (ввода m,
- 9. Биоэнергетика Теорема Пригожина (1947) – стационарному состоянию системы в условиях, препятствующих достижению равновесия, соответствует минимальное значение
- 10. Ферментативный катализ Активный центр Аллостерический центр Кофактор Простетическая группа Кофермент Строение фермента (энзима) Белковая молекула Изоферменты
- 11. Ферментативный катализ Особенности ферментативного катализа Размер. М(фермента) = 105÷107 г/моль → коллоидные системы, микрогетерогенность Высокая каталитическая
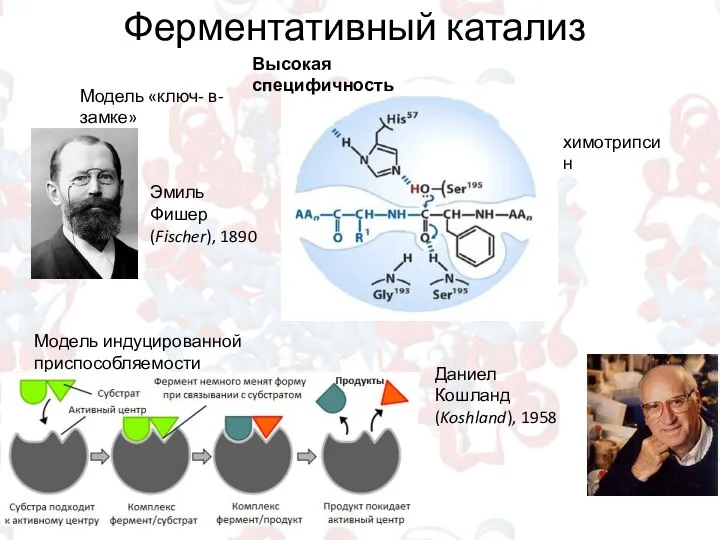
- 12. Ферментативный катализ Высокая специфичность Модель индуцированной приспособляемости Эмиль Фишер (Fischer), 1890 Даниел Кошланд (Koshland), 1958 химотрипсин
- 13. Ферментативный катализ Уравнение Михаэлиса-Ментен Леонор Михаэлис (Michaelis) Мод Ментен (Menten)
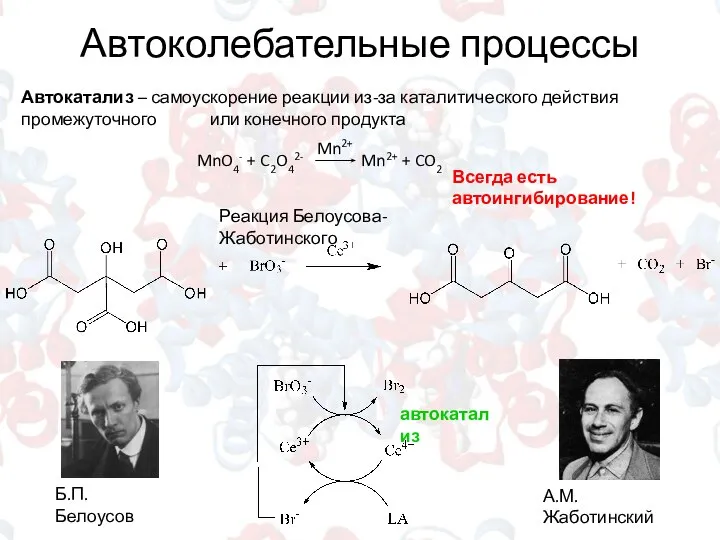
- 14. Автоколебательные процессы Автокатализ – самоускорение реакции из-за каталитического действия промежуточного или конечного продукта Всегда есть автоингибирование!
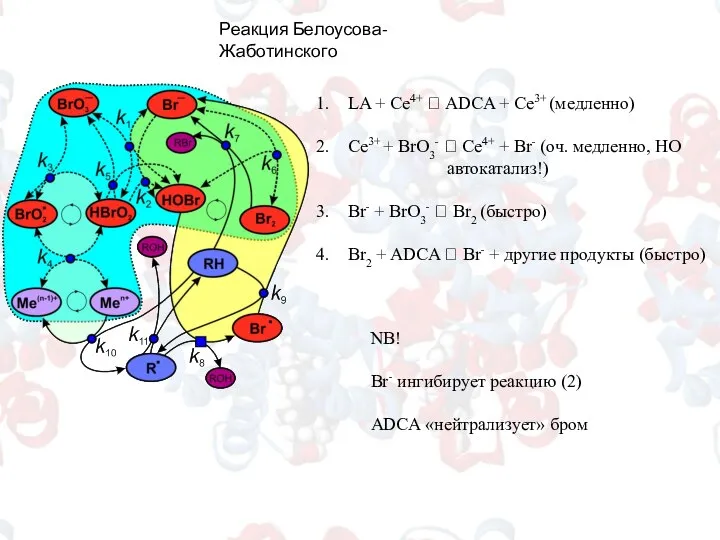
- 15. Реакция Белоусова-Жаботинского LA + Ce4+ ? ADCA + Ce3+ (медленно) Сe3+ + BrO3- ? Ce4+ +
- 17. Скачать презентацию








 Полимерные материалы и изделия
Полимерные материалы и изделия 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Отруєння ртуттю,кадмієм і арсеном Підготовила: Учениця 7Акласу НВК «Гімназія №14» м.Луцьк Горковчук Анна Перевірила : Василю
Отруєння ртуттю,кадмієм і арсеном Підготовила: Учениця 7Акласу НВК «Гімназія №14» м.Луцьк Горковчук Анна Перевірила : Василю Калий. Общая информация
Калий. Общая информация Презентация по Химии "Вода в моем доме" - скачать смотреть
Презентация по Химии "Вода в моем доме" - скачать смотреть  Ферменты. Часть II
Ферменты. Часть II ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Кислоты. Классификация кислот
Кислоты. Классификация кислот Производные ненасыщенных полиокси-γ-лактонов
Производные ненасыщенных полиокси-γ-лактонов Железо. Электронное строение железа
Железо. Электронное строение железа Огнеупорные материалы
Огнеупорные материалы Углеводороды. Значение углерода
Углеводороды. Значение углерода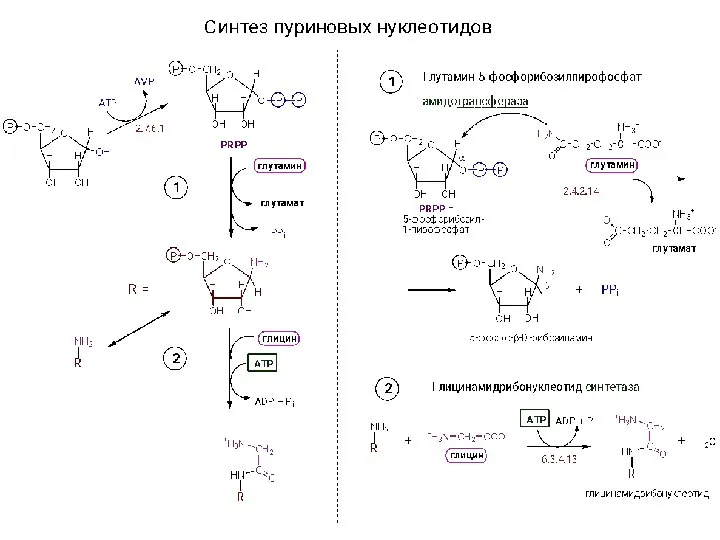 Синтез нуклеотидов
Синтез нуклеотидов Насыпная плотность, методы определения, примеры
Насыпная плотность, методы определения, примеры Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Углеводороды
Углеводороды Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Диагенез и катагенез горных пород
Диагенез и катагенез горных пород Химический состав клетки
Химический состав клетки Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс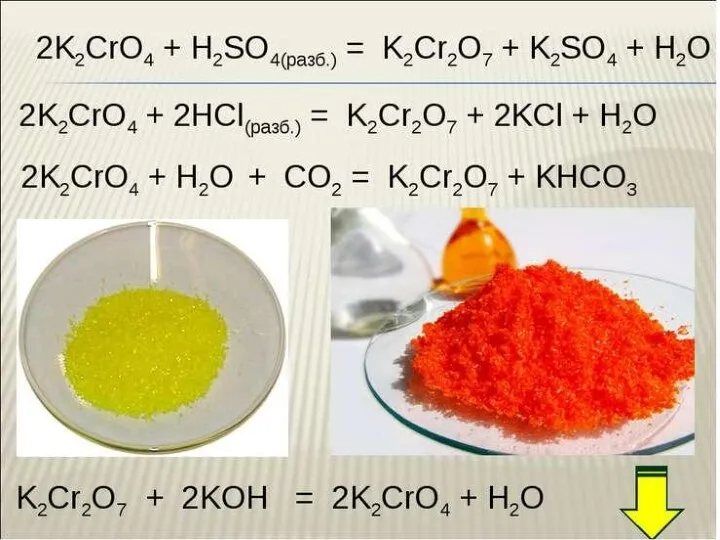 Хром. Соединения хрома
Хром. Соединения хрома Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть
Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть  Силикатная промышленность
Силикатная промышленность МЫШЬЯК Презентацию подготовила Юдайханова Юлия Ученица 11 класса В
МЫШЬЯК Презентацию подготовила Юдайханова Юлия Ученица 11 класса В  Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы Биоэнергетика. Современное представление о биологическом окислении
Биоэнергетика. Современное представление о биологическом окислении Формы природных выделений минералов. Занятие 2
Формы природных выделений минералов. Занятие 2