Содержание
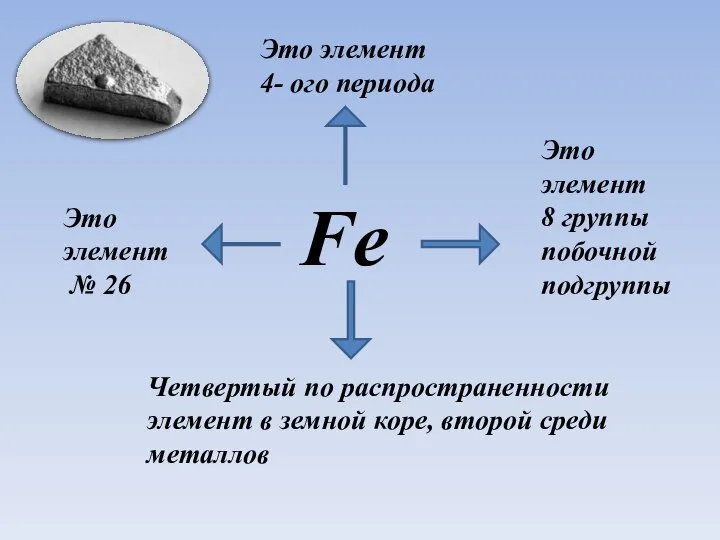
- 2. Fe Это элемент № 26 Это элемент 4- ого периода Четвертый по распространенности элемент в земной
- 3. Электронное строение железа
- 4. Нахождение в природе В земной коре железо распространено достаточно широко — на его долю приходится около
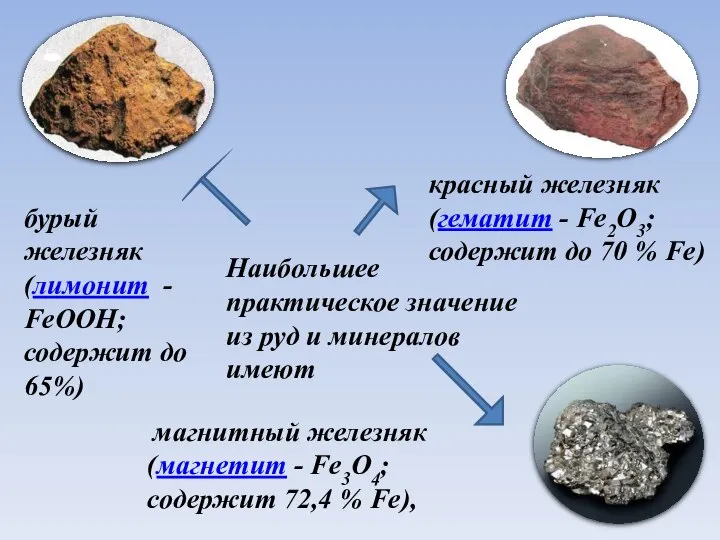
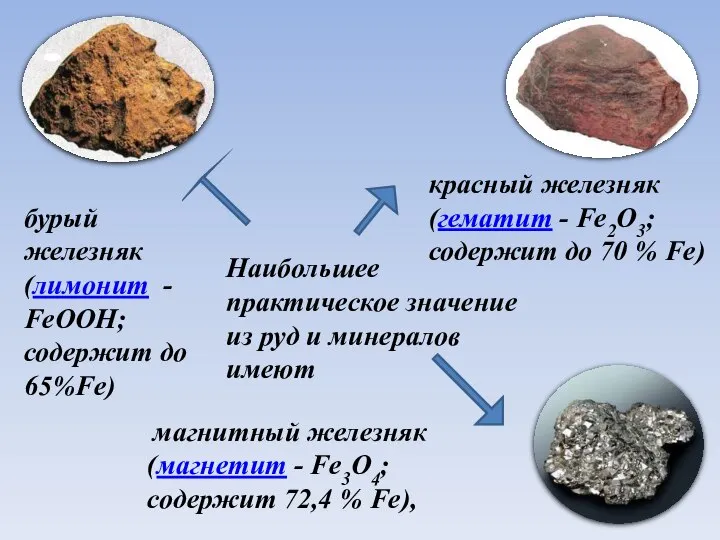
- 5. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 6. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 7. Физические свойства железа Железо- сравнительно мягкий , ковкий серебристо-серый металл Температура плавления 15350C Температура кипения 28000C
- 8. Химические свойства 1. Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4Fe +3O2=2Fe2O3 Реагирует
- 9. Химические свойства 2. Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe
- 10. Железо в организме Железо присутствует в организмах всех растений и животных, но в малых количествах (в
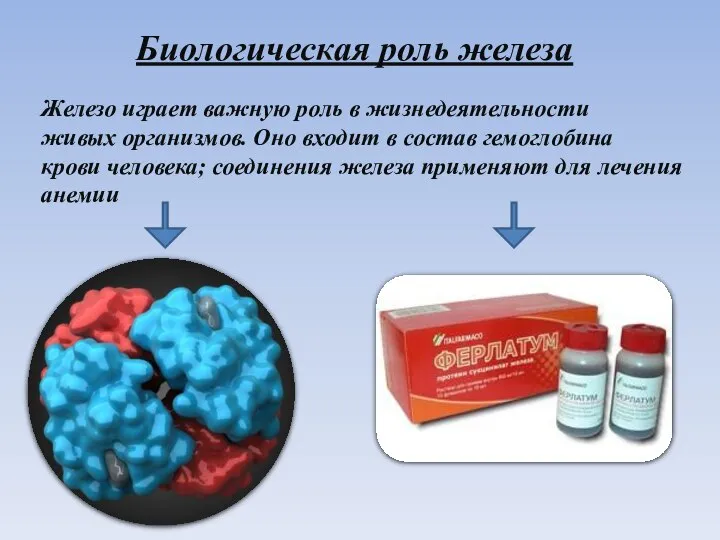
- 11. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 12. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и
- 13. Люди впервые овладели железом в четвертом-третьем тысячелетиях до н. э., подбирая упавшие с неба камни —
- 14. Применение железа, его сплавов и соединений Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении
- 15. «Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления сердечников, трансфо-, мембраноматоров, электромагнитов
- 17. Скачать презентацию










 Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов Химия – наука о веществах, их свойствах и превращениях Урок №1
Химия – наука о веществах, их свойствах и превращениях Урок №1 Химическая связь
Химическая связь Углерод и кремний
Углерод и кремний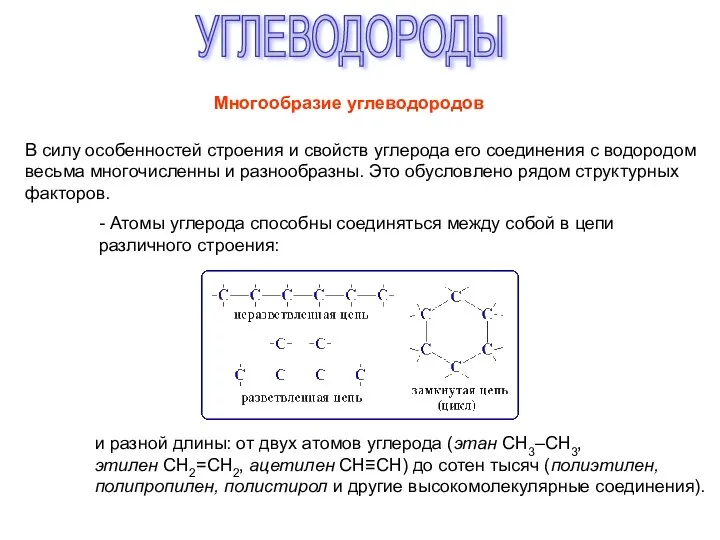 Углеводороды. Многообразие углеводородов
Углеводороды. Многообразие углеводородов Гетерофункциональные соединения
Гетерофункциональные соединения Магматические формации
Магматические формации Полисахариды. Крахмал
Полисахариды. Крахмал Нефть Михеева Анастасия 11-П
Нефть Михеева Анастасия 11-П  Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Презентация по Химии "Химическая посуда и оборудование" - скачать смотреть
Презентация по Химии "Химическая посуда и оборудование" - скачать смотреть  Липиды
Липиды Кинетика сложных реакций
Кинетика сложных реакций Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Chemistry
Chemistry Строение кристаллов
Строение кристаллов Углерод, аллотропные модификации
Углерод, аллотропные модификации Регуляция активности ферментов. Множественные формы ферментов. Введение в клиническую энзимологию. (Лекция 7)
Регуляция активности ферментов. Множественные формы ферментов. Введение в клиническую энзимологию. (Лекция 7) Көміртекті материалдар
Көміртекті материалдар Атомы. Нахождение в природе
Атомы. Нахождение в природе Количества вещества
Количества вещества Презентация Электрохимический ряд напряжений металлов
Презентация Электрохимический ряд напряжений металлов Биосинтез триацилглицеролов и глицерофосфолипидов. Обмен холестерола
Биосинтез триацилглицеролов и глицерофосфолипидов. Обмен холестерола Раздел: «Гетероциклические соединения» Раздел: «Гетероциклические соединения» Лекция №32-33 Тема: «6-ти членные ГЦС» План: 1. О
Раздел: «Гетероциклические соединения» Раздел: «Гетероциклические соединения» Лекция №32-33 Тема: «6-ти членные ГЦС» План: 1. О Оружие массового поражения. Биологическое оружие
Оружие массового поражения. Биологическое оружие  Консистентные смазки для легковых автомобилей
Консистентные смазки для легковых автомобилей Нуклеиновые кислоты
Нуклеиновые кислоты Классификация химических реакций
Классификация химических реакций