Содержание
- 2. Написать 5 примеров солей кислот имеющих в своим составе серу и назвать их. Проверка ДЗ
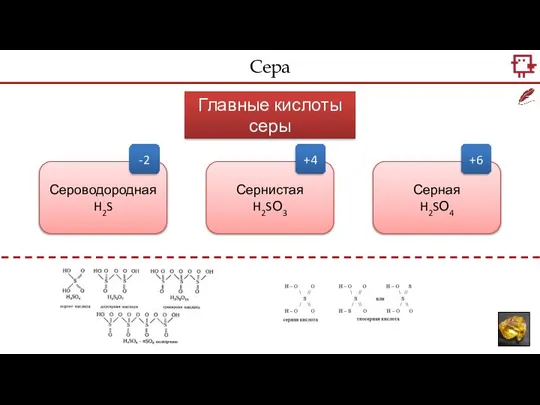
- 3. Сера Главные кислоты серы Сероводородная H2S Сернистая H2SО3 Серная H2SО4 -2 +4 +6
- 4. Сероводород – бесцветный и очень токсичный газ с запахом тухлых яиц. Получение в лаборатории: FeS +
- 5. SO2 + H2O H2SO3 Сернистый газ можно получить при взаимодействии: Me + 2H2SO4 (конц) -> CuSO4
- 6. Получение ангидрида серной кислоты (SO3) при катализаторе Pt или V2O5 2SO2 + O2 -> 2SO3 +
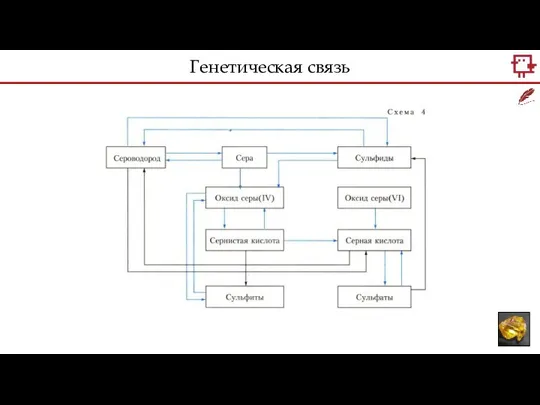
- 7. Генетическая связь
- 8. Применение Сера применяется в : Получении SO2, H2SO4, H2S, CS2 Вулканизация резины Производство пороха Производство инсектицидов
- 9. Задачки 1. Напишите уравнения реакций, характеризующих следующие превращения: SO2 -> Na2SO3 -> NaHSO3 -> Na2SO3 ->
- 11. Скачать презентацию






 Періодична система хімічних елементів
Періодична система хімічних елементів Галогены
Галогены Эфирные масла
Эфирные масла Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Катализдің организмнің тіршілігіндегі рөлі
Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Катализдің организмнің тіршілігіндегі рөлі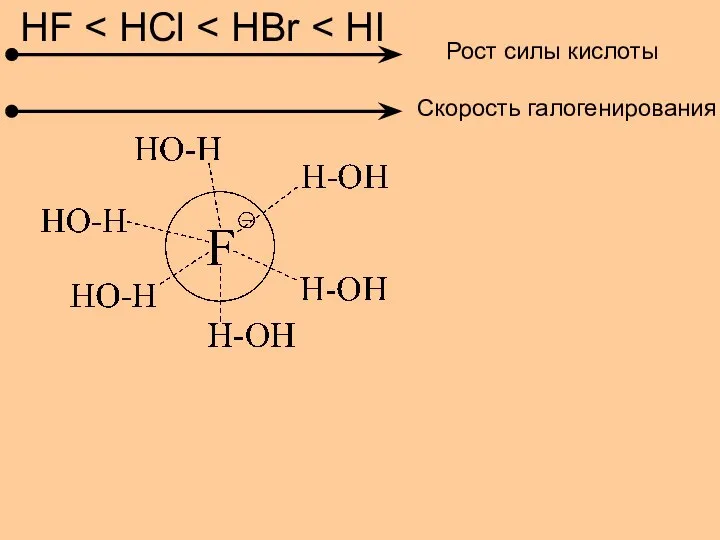 Алкены
Алкены Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман
Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман  Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД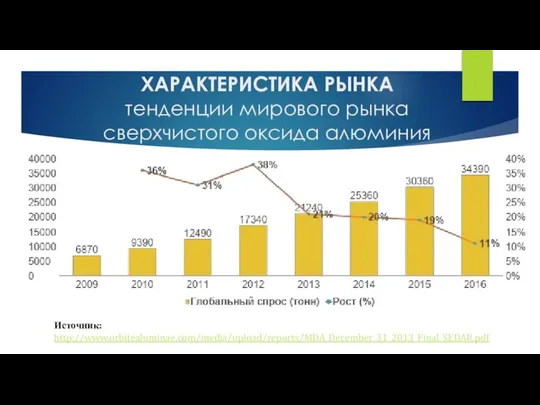 Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия
Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Отчетная работа по элективному курсу «Истории открытий удивительных веществ» Выполнили ученики 9А класса ГОУ СОШ № 466 Бердников
Отчетная работа по элективному курсу «Истории открытий удивительных веществ» Выполнили ученики 9А класса ГОУ СОШ № 466 Бердников Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Твердое состояни вещества
Твердое состояни вещества Электролитическая диссоциация_
Электролитическая диссоциация_ Хімічні явища в природі
Хімічні явища в природі Диспергаторы. Добавки для печатных красок
Диспергаторы. Добавки для печатных красок Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Гетероорганические углеводороды нефти и асфальто-смолистые вещества
Гетероорганические углеводороды нефти и асфальто-смолистые вещества Введение. Виды стекол. Применение конструкций из стекла
Введение. Виды стекол. Применение конструкций из стекла Гидролиз солей.
Гидролиз солей.  Electrochemical processes
Electrochemical processes Изомерия. (11 класс)
Изомерия. (11 класс) КОЛЕКЦІЯ ВОЛОКОН
КОЛЕКЦІЯ ВОЛОКОН  Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы
Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы Аминирование диазо
Аминирование диазо Метасоматический процесс
Метасоматический процесс Эфиры. 10 класс
Эфиры. 10 класс Выдающиеся ученые - химики и их заслуги
Выдающиеся ученые - химики и их заслуги