Содержание
- 2. Задание 5. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Примерное время выполнения задания –
- 3. Перед выполнением предложенных заданий повторите: Простые и сложные вещества Молекулы простых веществ состоят из атомов одного
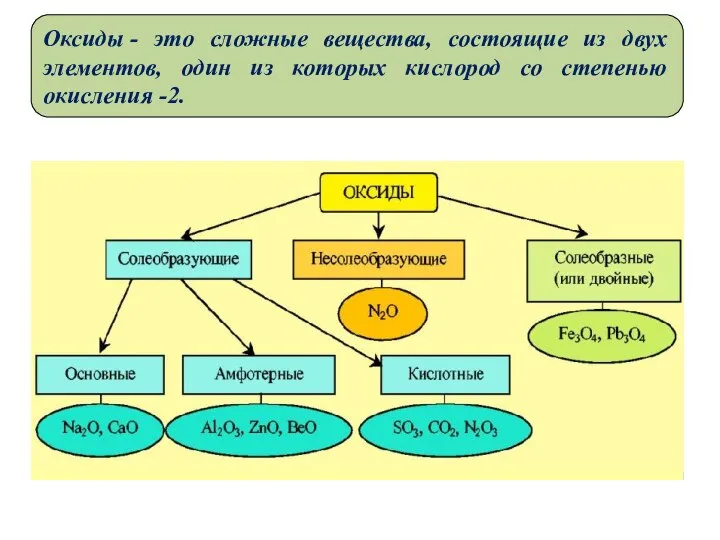
- 4. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления
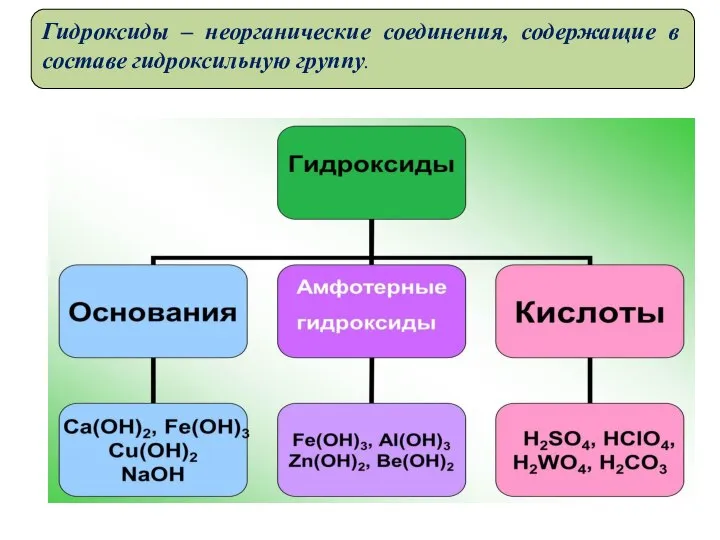
- 5. Гидроксиды – неорганические соединения, содержащие в составе гидроксильную группу.
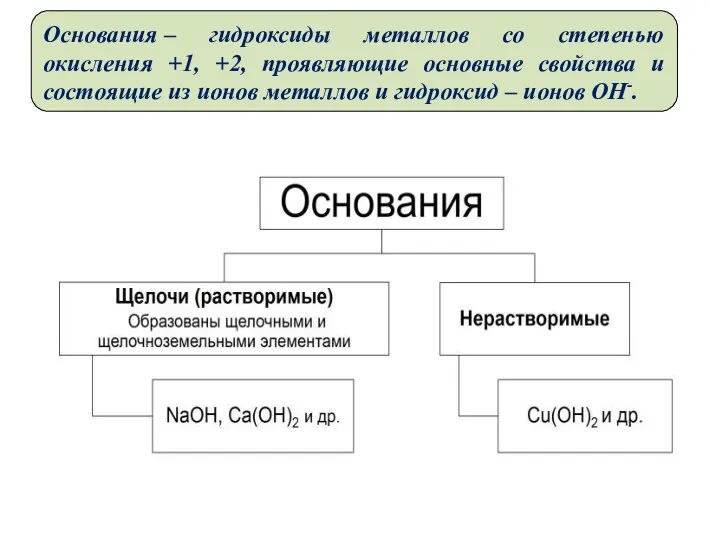
- 6. Основания – гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства и состоящие из ионов
- 7. Кислотные гидроксиды (кислородсодержащие кислоты) – гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные
- 8. Соли - сложные химические вещества, образованные атомами металлов, связанных с кислотными остатками. Средние соли Катионы металла
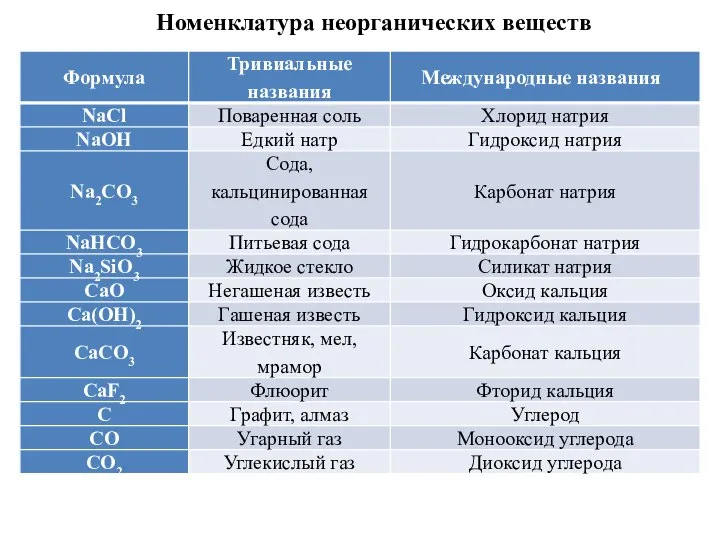
- 9. Номенклатура неорганических веществ
- 10. Номенклатура неорганических веществ
- 11. Тренировочные задания
- 12. Тренировочные задания
- 14. Скачать презентацию







 Хроматографические методы анализа
Хроматографические методы анализа Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Электронные конфигурации атомов
Электронные конфигурации атомов Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Термодинамика полимеризации
Термодинамика полимеризации Необычные минералы
Необычные минералы Химиялық реакцияның жылдамдығы. Катализ
Химиялық реакцияның жылдамдығы. Катализ Понятие о спиртах
Понятие о спиртах Характеристика ПМ общетехнического, инженерного и констркуционного назначения
Характеристика ПМ общетехнического, инженерного и констркуционного назначения Открытие водорода
Открытие водорода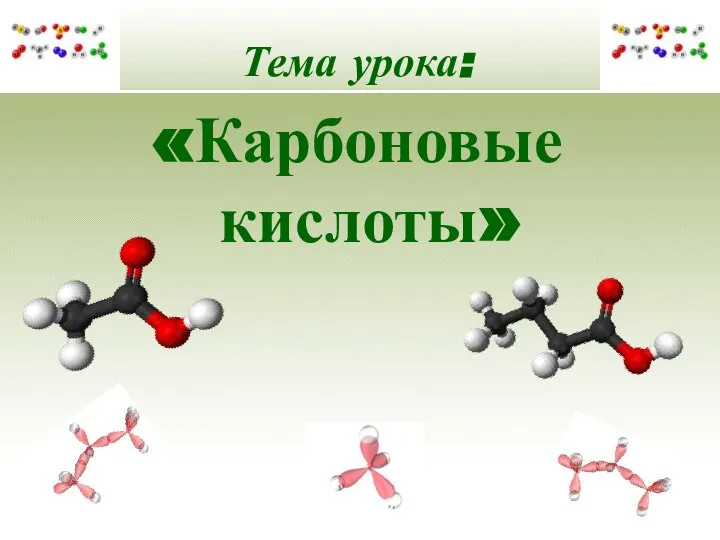 Карбоновые кислоты
Карбоновые кислоты Основы коррозии и защиты металлов
Основы коррозии и защиты металлов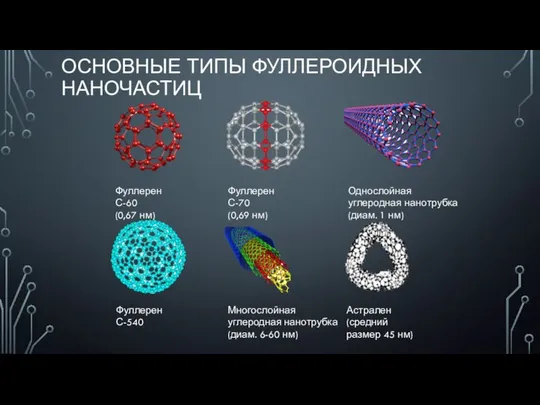 Основные типы фуллероидных наночастиц
Основные типы фуллероидных наночастиц Оже спектроскопия
Оже спектроскопия Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Презентация Природные синтетические красители и ароматизаторы
Презентация Природные синтетические красители и ароматизаторы Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения Коррозия в жидких средах
Коррозия в жидких средах Получение железных порошков
Получение железных порошков Знание химии в строительном деле на бытовом уровне
Знание химии в строительном деле на бытовом уровне Обмен простых белков. Пути обмена аминокислот. (Тема 5)
Обмен простых белков. Пути обмена аминокислот. (Тема 5) Биохимия белковых гормонов
Биохимия белковых гормонов Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Химический турнир «Химия –наука чудес и превращений»
Химический турнир «Химия –наука чудес и превращений»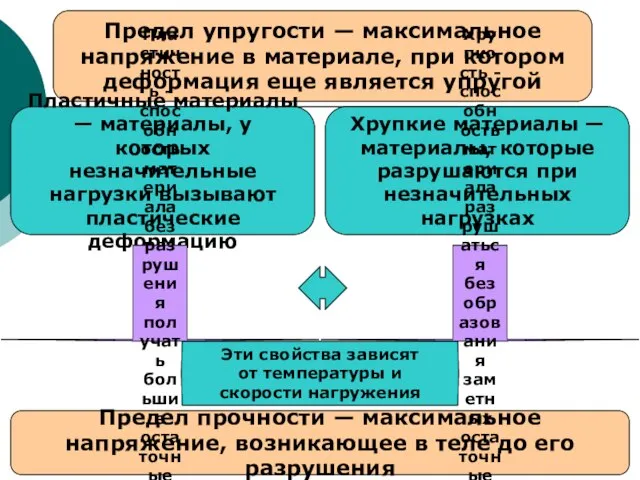 Предел упругости
Предел упругости Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Вода - растворитель
Вода - растворитель Минеральные вещества
Минеральные вещества