Содержание
- 2. К о р р о з и я в н е э л е к т
- 3. - химическая реакция с металлом, - десорбция продуктов и их диффузия в объем неэлектролита. В зависимости
- 4. К о р р о з и я в ж и д к и х м
- 5. определяются предельной Р, V жидкого М и скоростью его циркуляции. Возможна также коррозия при образовании растворимых
- 6. Опасен и часто встречается термический перенос массы - в горячей зоне жидкометаллического контура твердый М растворяется,
- 7. перенос М от более к менее напряженным участкам конструкции; самосваривание находящихся в контакте твердых М. Возможна
- 8. Электролитная коррозия Основа - теория коррозионного полиэлектрода, а также термодинамика, кинетика и механизмы частных электродных реакций:
- 9. Устанавливаются равновесия (1) – (6): Mn+ + ne ⇆ M (1) МmOn + 2n H3O+ +
- 10. УСЛОВИЯ ПРОТЕКАНИЯ ПАРАЛЛЕЛЬНЫХ РЕАКЦИЙ Принцип независимости: на электроде одновременно и независимо друг от друга протекают все
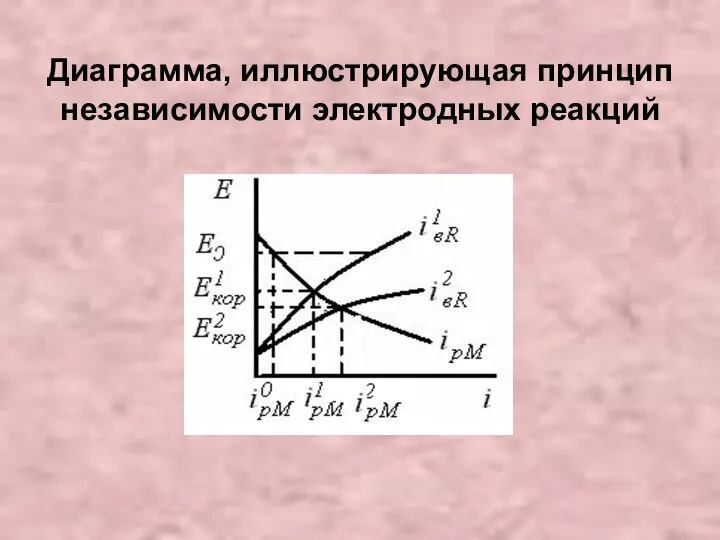
- 11. Диаграмма, иллюстрирующая принцип независимости электродных реакций
- 12. Следствия из принципа По первому следствию при заданном Е (Е=Е0) (рис.) скорость каждой электрохимической реакции однозначно
- 13. Выражение скорости и потенциала коррозии Если Екор удален от рЕ Мn+/М и от рЕОх/R, то и
- 14. Подставив Екор в выражения для скорости получим:
- 15. Если катодная реакция лимитируется диффузией Ох или при Екор протекает с предельным током плотностью
- 16. Условие протекания коррозии: рЕМn+/M рЕМn+/M По уравнению Нернста при τ=0 рЕМn+/M = ∞, т.к. [Mn+]=0 pEOx/R
- 17. Теория локальных гальванических элементов При коррозии в короткозамкнутом элементе основной металл - растворяющийся анод, а ЭП
- 18. Теорию подтверждали: - обнаруженные катодные и анодные участки на неэквипотенциальной поверхности - снижение j по мере
- 19. Предложены графический и аналитический расчеты скорости коррозии. 1. Графический расчет проводился без учета омического фактора и
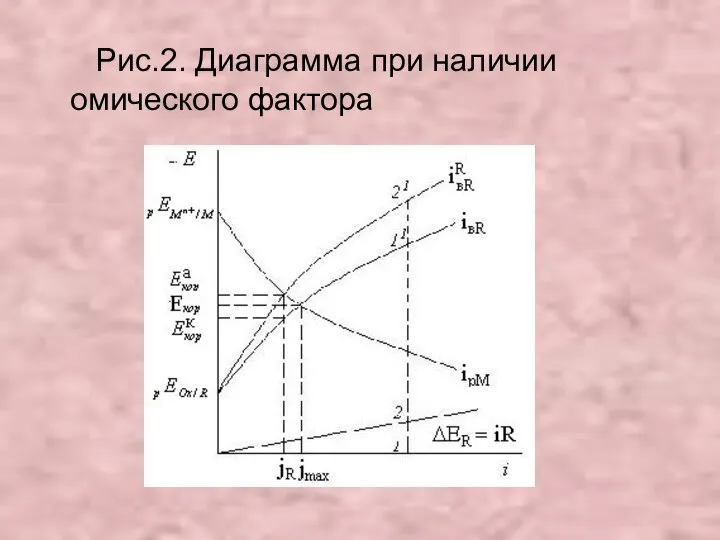
- 20. Рис.2. Диаграмма при наличии омического фактора
- 21. Точка пересечения исправленной катодной кривой Е – c анодной Е –iрМ дает потенциал коррозии анодных участков
- 22. 2. Аналитический расчет Уравнения, вытекающие из (10) и (11), представляющие разность потенциалов между МиК и МиА
- 23. jR= (рЕОх/R - рЕМn+/М)/( ωк + ωа + R) (12) где ω - удельная поляризуемость при
- 24. Недостатки ТЛГЭ Не объясняла коррозию чистых металлов с однородной эквипотенциальной поверхностью ( Hg в HNO3), электроположительных
- 25. Модификационная теория Использует верную модель ЛГЭ ,но отличается от положениями: 1. Катодная реакция выделения R может
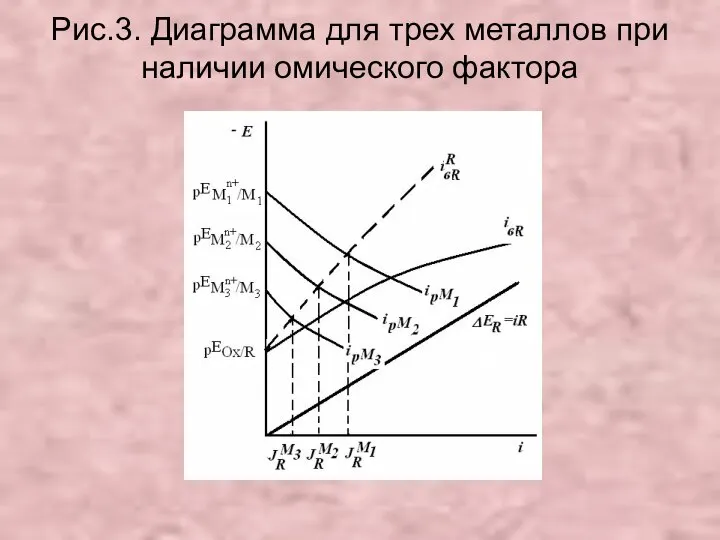
- 26. 2. Разность Е между катодными и анодными участками - следствие омического падения напряжения преимущественно в растворе
- 27. Рис.3. Диаграмма для трех металлов при наличии омического фактора .
- 28. Механизмы коррозии Го м о г е н н о- э л е к т р
- 29. Условие стационарности Екор имеет вид: JpM = ipM Sа = JвR = iвR Sк (13) Т.к.
- 30. 2. Г е т е р о г е н н о – э л е
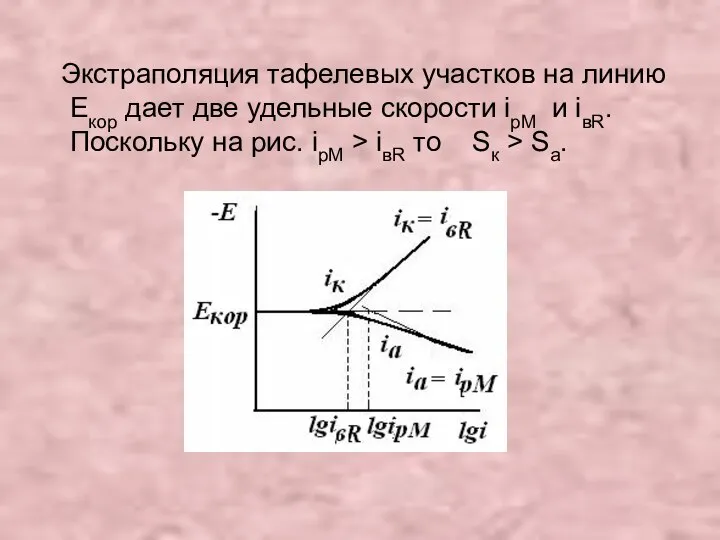
- 31. Экстраполяция тафелевых участков на линию Екор дает две удельные скорости ipM и iвR. Поскольку на рис.
- 33. Скачать презентацию


























 Предельные углеводороды. Химические свойства. 10 класс
Предельные углеводороды. Химические свойства. 10 класс Аминокислоты Модели молекул
Аминокислоты Модели молекул Презентация по Химии "Галогены и их соединения" - скачать смотреть
Презентация по Химии "Галогены и их соединения" - скачать смотреть  Поливинилхлорид. ПВХ в массе и суспензии
Поливинилхлорид. ПВХ в массе и суспензии Коррозия (лат. corrosio — «жегіде»)- қоршаған ортаның әсерінен метал бетінің бүлінуі
Коррозия (лат. corrosio — «жегіде»)- қоршаған ортаның әсерінен метал бетінің бүлінуі Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов
Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Химия. Проверочная
Химия. Проверочная Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Імунопатологія. Імунопрофілактика і імунотерапія інфекційних захворювань. Засоби імунокорекції
Імунопатологія. Імунопрофілактика і імунотерапія інфекційних захворювань. Засоби імунокорекції Алкины. Строение,номенклатура, изомерия
Алкины. Строение,номенклатура, изомерия Физиологические эффекты активных форм кислорода
Физиологические эффекты активных форм кислорода Химические реакции
Химические реакции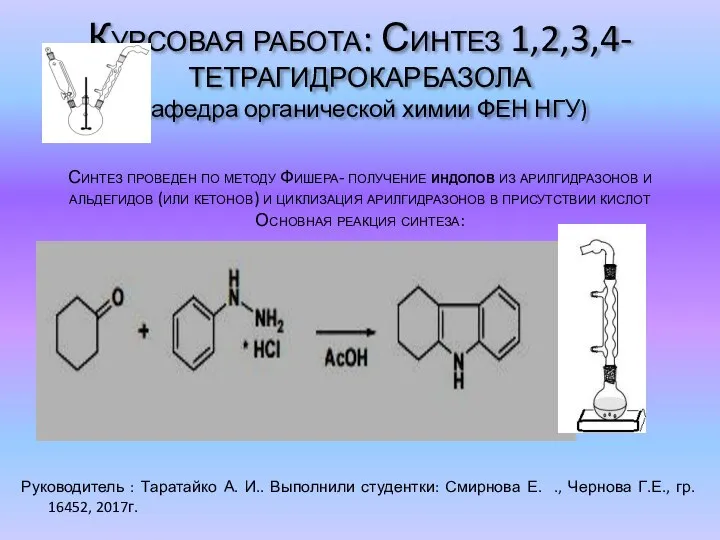 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Электронное строение атома
Электронное строение атома Получение металлов. Металлы в природе
Получение металлов. Металлы в природе Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Презентация по Химии "Стекло. Производство стекла" - скачать смотреть
Презентация по Химии "Стекло. Производство стекла" - скачать смотреть  Презентация по Химии "Атом" - скачать смотреть
Презентация по Химии "Атом" - скачать смотреть  Машиностроительные материалы
Машиностроительные материалы Використання кислот в будівництві і побуті. 8 клас
Використання кислот в будівництві і побуті. 8 клас Презентация по Химии "Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс" - скачать смотреть
Презентация по Химии "Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс" - скачать смотреть  Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс История нефтедобычи в России Материал для урока химии в 10 классе УМК О.С. Габриеляна Составила Яковлева Л.А.
История нефтедобычи в России Материал для урока химии в 10 классе УМК О.С. Габриеляна Составила Яковлева Л.А.  Органические высокомолекулярные реагенты
Органические высокомолекулярные реагенты Тему «Соли». Нитрат серебра(I) AgNO3
Тему «Соли». Нитрат серебра(I) AgNO3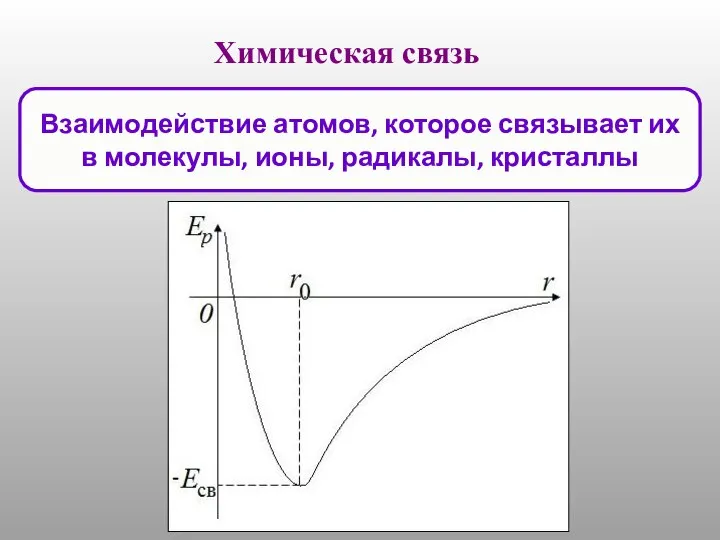 Химическая связь
Химическая связь Виды химической связи (8 класс)
Виды химической связи (8 класс)