Содержание
- 2. Chemie in technischen Studiengängen Maschinenbau: Chemie wird behandelt in Thermodynamik und Werkstoffkunde – Multiple Choice Klausur
- 3. Das Fach „Chemie“ im Studienkolleg Hannover 4-5 Stunden pro Woche 2 schriftliche Arbeiten = Klausuren von
- 4. Prüfungsarten an der Leibniz Universität Vorlesung: ? Klausur = schriftliche Prüfung dazu oft Übungen mit Klausuraufgaben
- 5. Wo finde ich seriöse Informationen? www.chemgapedia.de www.chemie de www. wikipedia.de 19.04.2022 Dr.Katrin Schöffski
- 6. Was ist „Chemie“ ? Im Gegensatz zu Physik und Biologie ……… Chemie ist die Lehre von
- 7. Das Teilchenmodell In unserer Vorstellung bestehen alle Stoffe aus unsichtbaren, sehr kleinen, so genannten „Teilchen“ aufgebaut.
- 8. Stoffe und Stoffeigenschaften Stoff: besteht aus Teilchen mit identischen Eigenschaften Gemisch: verschiedenen Teilchen mit unterschiedlichen Eigenschaften
- 9. Gemische Homogenes Gemisch: besteht aus einer Phase (mit dem Auge nicht als Gemisch erkennbar (Salzwasser, Alkohol
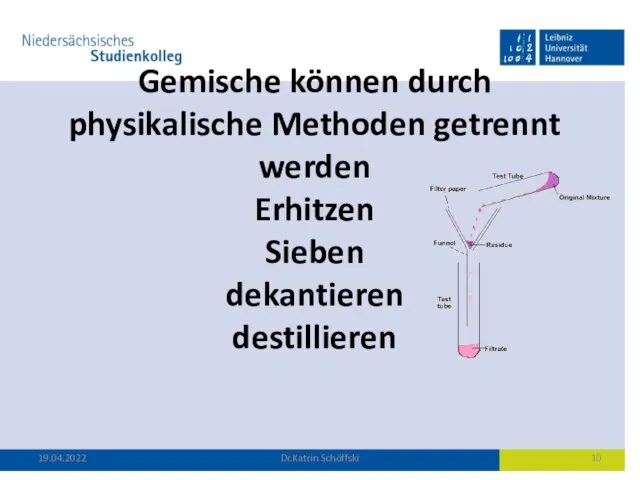
- 10. Gemische können durch physikalische Methoden getrennt werden Erhitzen Sieben dekantieren destillieren 19.04.2022 Dr.Katrin Schöffski
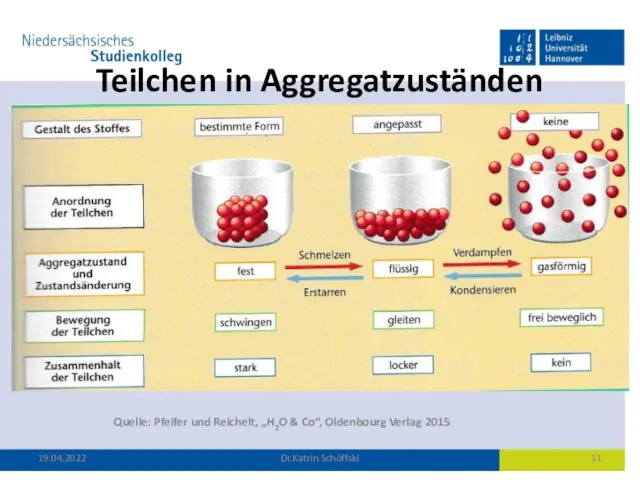
- 11. Teilchen in Aggregatzuständen Quelle: Pfeifer und Reichelt, „H2O & Co“, Oldenbourg Verlag 2015 19.04.2022 Dr.Katrin Schöffski
- 12. Aggregatzustände fest – flüssig – gasförmig Übergänge fest – flüssig = schmelzen flüssig – fest =
- 13. Elementarteilchen Atome bestehen aus Elementarteilchen. Protonen, Neutronen und Elektronen 19.04.2022 Dr.Katrin Schöffski
- 14. Zeichnen Sie ein Natriumatom! Natrium hat die Ordnungszahl 11. Nr. des Elektrons 19.04.2022 Dr.Katrin Schöffski
- 15. 1.2. Atombau 19.04.2022 Dr.Katrin Schöffski
- 16. Der Streuversuch von E. Rutherford 19.04.2022 Dr.Katrin Schöffski
- 17. Das Versuchsprotokoll am Beispiel des Rutherfordschen Streuversuchs 1. Überschrift: Was will ich mit dem Versuch zeigen?
- 18. Beobachtung: Der größte Teil (die meisten) Strahlen (Teilchen) gehen direkt durch die Goldfolie hindurch und treffen
- 19. Das Kern-Hülle-Modell Im Atomkern sind Protonen und Neutronen enthalten. Protonen tragen eine positive Ladung. Neutronen tragen
- 20. Elemente und Isotope Die Anzahl der Protonen bestimmt das Element, die Anzahl der Neutronen das Isotop.
- 21. Wie sieht die Atomhülle aus? Einfachster Fall: Wasserstoffatom : 1 Elektron umkreist den Kern kugelförmig Heliumatom:
- 22. Die Ionisierungsenergie Energie, die benötigt wird, um ein Elektron vom Kern abzuspalten Einheit MJ / mol
- 23. Atommodelle Thomsen: Atome sind Kugeln, in denen positive und negative Ladung gleichmäßig verteilt ist. Rutherford: Die
- 24. Das Orbitalmodell des Atoms Wichtige Begriffe: der Kern, die Hülle, die Schale, das Orbital, die Elektronenkonfiguration,
- 25. Das Orbitalmodell des Atoms Die Protonen und Neutronen befinden sich im Atomkern. Sie tragen die Masse
- 26. 19.04.2022 Dr.Katrin Schöffski
- 27. Orbitale Was sind „Orbitale“? Orbitale sind die Aufenthaltsräume der Elektronen um den Atomkern herum. Jedes Orbital
- 28. Atommodell – die Orbitaltheorie Ein Beispiel für eine Elektronenkonfiguration: 1s2 2s2 2p6 3s2 3p6 4s2 3d7
- 29. Elektronenkonfiguration Jedes Atom hat eine festgelegte Anzahl von Elektronen, nämlich genau so viele, wie es Protonen
- 30. Reihenfolge des Auffüllens der Orbitale 19.04.2022 Dr.Katrin Schöffski
- 31. Beschreibung der Elektronen durch „Quantenzahlen“ Die einzelne Elektronen eines Atome könne auch durch die so genannten
- 32. Die Quantenzahlen Hauptquantenzahl-Werte: n = 1 bis 7 Nebenquantenzahl-Werte: l = 0 bis n -
- 33. Kriterien für die Besetzung der Orbitale Das Energie-Prinzip Die Orbitale werden in der energetischen Reihenfolge
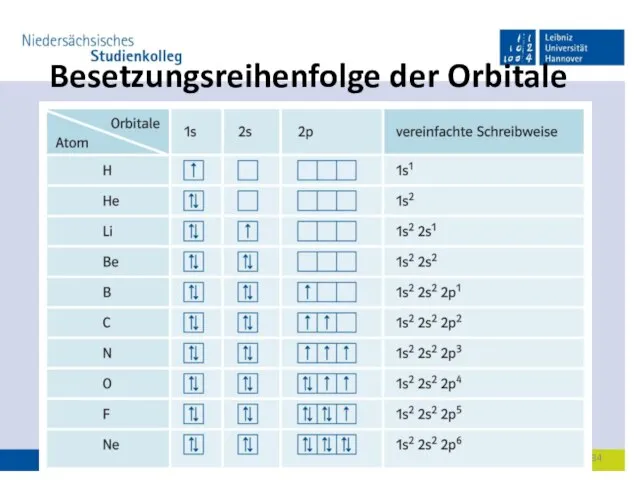
- 34. Besetzungsreihenfolge der Orbitale 19.04.2022 Dr.Katrin Schöffski
- 35. Beschreibung der Elemente durch die Elektronenkonfiguration Um welche Elemente handelt es sich? 1s2 2s2 2p4 =
- 36. Die Edelgaskonfiguration ist eine sehr stabile Elektronenkonfiguration mit 8 Elektronen in der Außenschale. Stabile Konfiguration heißt,
- 37. Das Periodensystem (das periodische System der Elemente PSE) Dmitri Iwanowitsch Mendelejew 1834 – 1907 „Die Abhängigkeit
- 38. Vorhersage von Eigenschaften bisher unbekannter Elemente eka-Silicium Atommasse: ~ 72 u dunkelgraues Metall mit hohem Schmelzpunkt
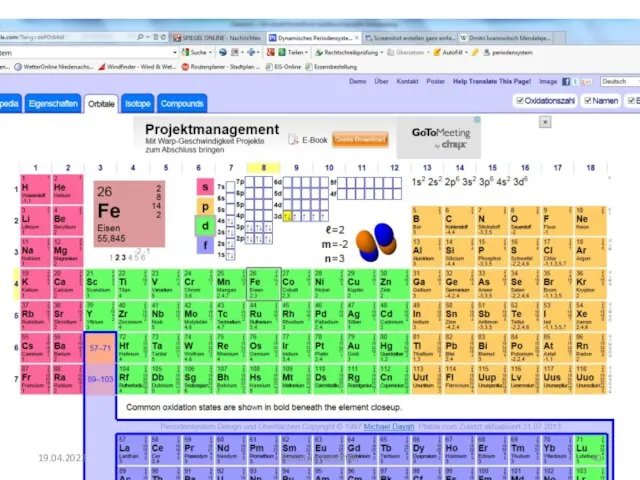
- 39. Aufbau des Periodensystems Die Elemente sind fortlaufend nach der Ordnungszahl = Anzahl der Protonen angeordnet. Senkrecht:
- 40. 19.04.2022 Dr.Katrin Schöffski
- 41. Periodensystem Pocketcard (2,99€) ISBN 978-3-89862-153-3 www.media4u.com ҉ 19.04.2022 Dr.Katrin Schöffski
- 42. Die Namen der Hauptgruppen im Periodensystem Alkalimetalle: leichte, weiche, reaktionsfreudige Metalle, Ion 1+ Erdalkalimetalle: Metalle, etwas
- 43. Die Elektronegativität beschreibt die Fähigkeit eines Atoms, Elektronen (die eigenen und die benachbarter Atome) anzuziehen. Sie
- 44. Die Nebengruppen im Periodensystem Die Übergangsmetalle: Hier werden die d-Orbitale aufgefüllt, Übergangsmetalle haben häufig mehrere Oxidationsstufen.
- 46. Скачать презентацию







































 Stereochemistry.Isomers are different compounds
Stereochemistry.Isomers are different compounds ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ ОБОБЩАЮЩИЙ УРОК
ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ ОБОБЩАЮЩИЙ УРОК  Сера
Сера Металлы. Кроссворд
Металлы. Кроссворд Урок - лекция с контролем в 10 классе
Урок - лекция с контролем в 10 классе  Определение массовой концентрации общего железа с сульфосалициловой кислотой. (Лабораторная работа 2)
Определение массовой концентрации общего железа с сульфосалициловой кислотой. (Лабораторная работа 2) Особенности КИМ ЕГЭ 2015 года по химии Составитель: Снастина М. Г. Москва 2014 г.
Особенности КИМ ЕГЭ 2015 года по химии Составитель: Снастина М. Г. Москва 2014 г.  Презентация Соли
Презентация Соли Вуглеводи
Вуглеводи Понятие о качественных реакциях. 9 класс
Понятие о качественных реакциях. 9 класс Адам мен жануар организміне бордың әсері
Адам мен жануар организміне бордың әсері Жиры. Классификация жиров
Жиры. Классификация жиров Азокрасители. Цвет, классификация
Азокрасители. Цвет, классификация Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Реакции замещения
Реакции замещения Химическая термодинамика. Лекция 2
Химическая термодинамика. Лекция 2 Химический источник электрического тока
Химический источник электрического тока Выполнила ученица 9б класса Коробатова Алена Учитель: Дьяченко Людмила Александровна
Выполнила ученица 9б класса Коробатова Алена Учитель: Дьяченко Людмила Александровна Фосфор красный, белый и черный
Фосфор красный, белый и черный Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий Индиго-краситель
Индиго-краситель Сера, ее физические и химические свойства
Сера, ее физические и химические свойства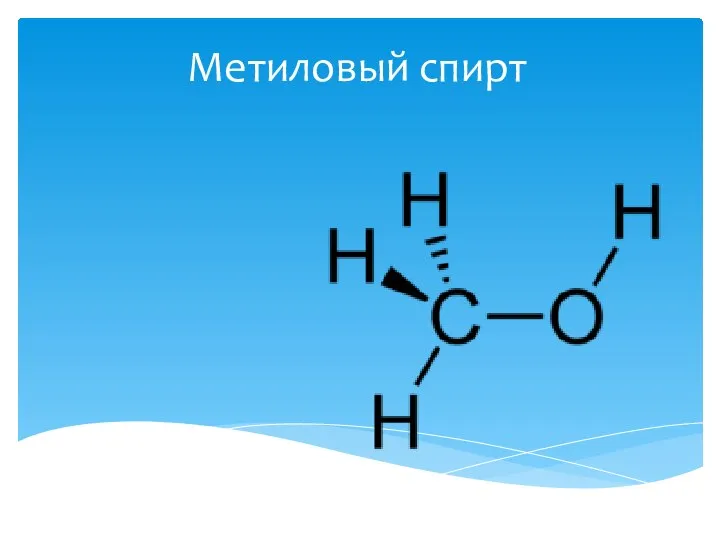 Метиловый спирт
Метиловый спирт Требование к оформлению отчета лабораторной работы
Требование к оформлению отчета лабораторной работы Значение окислительно-восстановительных реакций в жизни человека
Значение окислительно-восстановительных реакций в жизни человека Координационные соединения и их применение в медицине, фармакологии
Координационные соединения и их применение в медицине, фармакологии Нефть Общие сведения
Нефть Общие сведения Сульфаттар және эфирсульфаттар
Сульфаттар және эфирсульфаттар