Содержание
- 2. Химическая Термодинамика раздел химии, изучающий взаимные превращения энергии, теплоты и работы в термодинамических системах разных типов,
- 3. Состояние системы определяется термодинамическими параметрами состояния – температурой, давлением, концентрацией, объемом и т. д. Система характеризуется,
- 4. В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае
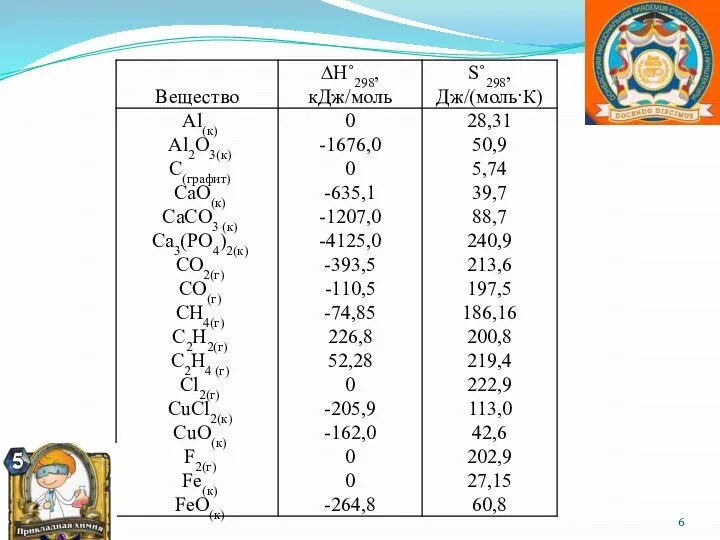
- 5. Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется
- 7. Закон Гесса: «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит
- 8. Следствия закона Гесса 1) Тепловой эффект реакции равняется разности сумм теплот образования конечных продуктов реакции и
- 9. Энтропия (мольная) - S′ - это количественная мера беспорядка (неупорядоченности) системы. Она измеряется в Дж/мольК; чем
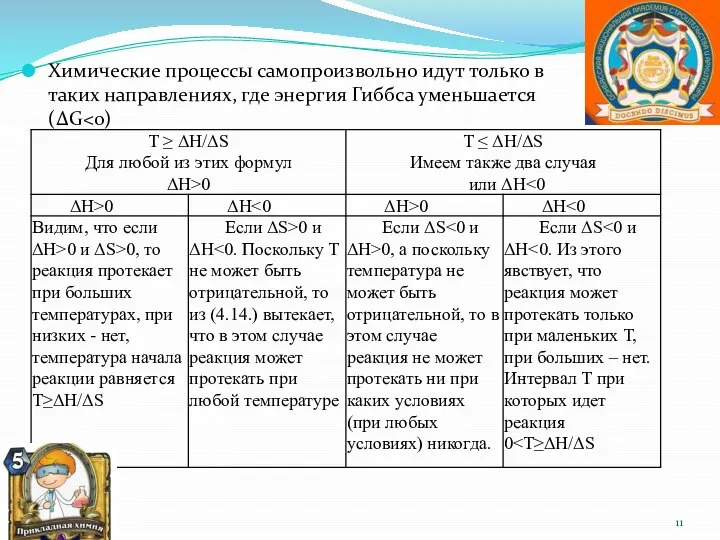
- 11. Химические процессы самопроизвольно идут только в таких направлениях, где энергия Гиббса уменьшается (ΔG
- 12. Пример
- 15. Скачать презентацию










 Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія
Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія  Общая фармакология
Общая фармакология Углерод и его соединения
Углерод и его соединения Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени
Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени Урок розв’язування задач
Урок розв’язування задач Ароматичні аміни
Ароматичні аміни Фосфор
Фосфор Углеводы
Углеводы Химическая связь
Химическая связь Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  11 хб
11 хб  Нефелиновые сиениты. Щелочные породы
Нефелиновые сиениты. Щелочные породы Презентация по Химии "Фосфорные удобрения" - скачать смотреть
Презентация по Химии "Фосфорные удобрения" - скачать смотреть  Алкины
Алкины Метаболизм источников энергии
Метаболизм источников энергии Химические волокна
Химические волокна Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Аммиак
Аммиак Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі
Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі Мило. Мийні засоби
Мило. Мийні засоби Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Обобщение и систематизация знаний по теме Химическая связь и строение атома
Обобщение и систематизация знаний по теме Химическая связь и строение атома Химическая промышленность
Химическая промышленность Регуляция обмена веществ
Регуляция обмена веществ Протеины: плюсы и минусы
Протеины: плюсы и минусы Биохимия печени
Биохимия печени