Содержание
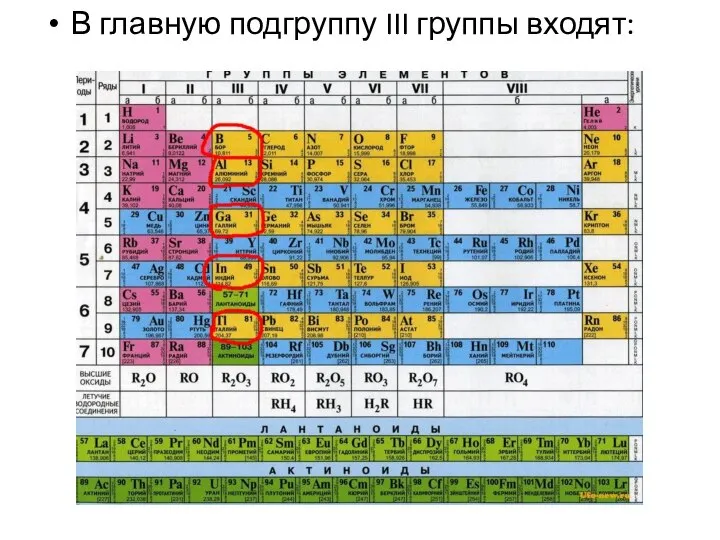
- 2. В главную подгруппу III группы входят:
- 3. III группа Периодической системы К р-элементам III группы относятся бор, алюминий, галлий, индий и таллий: р-
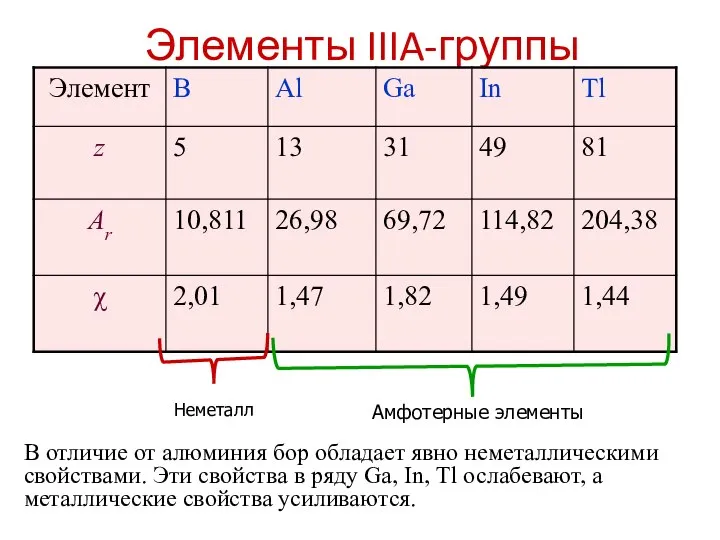
- 4. Элементы IIIА-группы Общая электронная формула: […] ns 2 (n –1)d 10 np 1 Степени окисления: 0,
- 5. Элементы IIIA-группы В отличие от алюминия бор обладает явно неметаллическими свойствами. Эти свойства в ряду Gа,
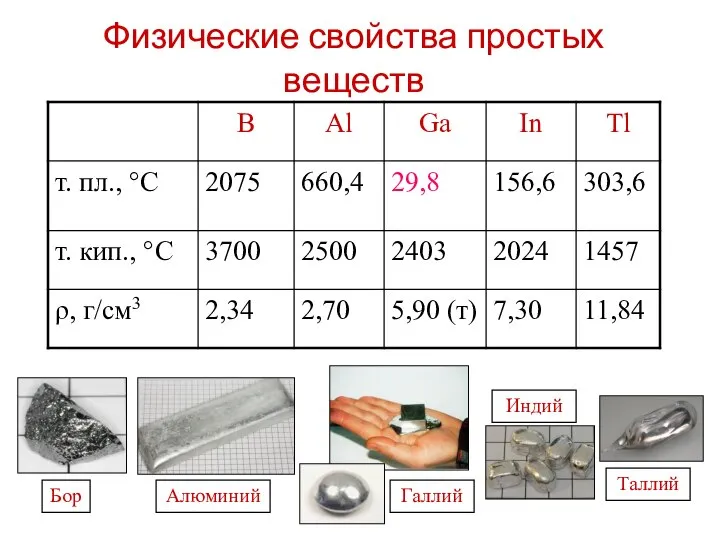
- 6. Физические свойства простых веществ
- 7. Галлий. Га́ллий мягкий пластичный металл серебристо-белого цвета с синеватым оттенком. Лёгкий металл.
- 8. И́ндий ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Индий.
- 9. Таллий. Та́ллий мягкий металл белого цвета с голубоватым оттенком. Относится к группе тяжёлых металлов. Сверхпроводник. На
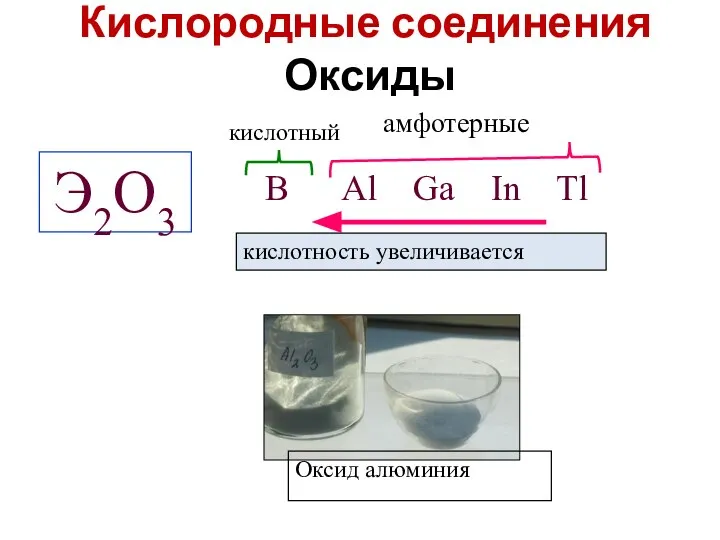
- 10. Кислородные соединения Оксиды Э2О3 B Al Ga In Tl
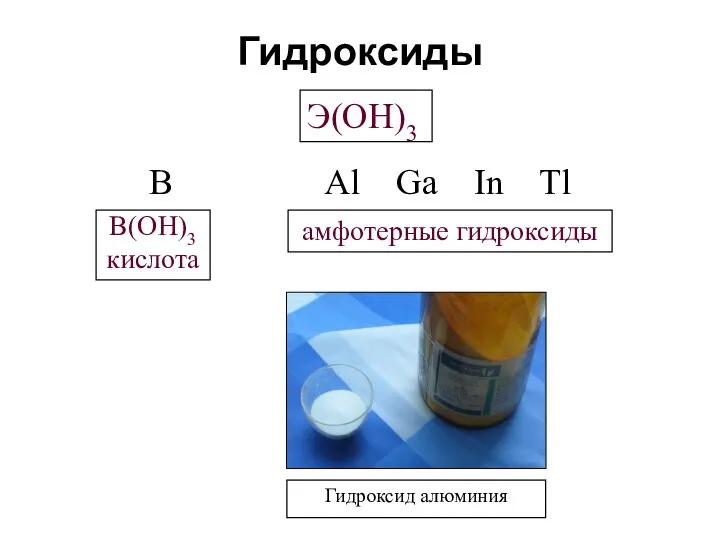
- 11. Гидроксиды Э(OH)3 B Al Ga In Tl B(OH)3 кислота амфотерные гидроксиды
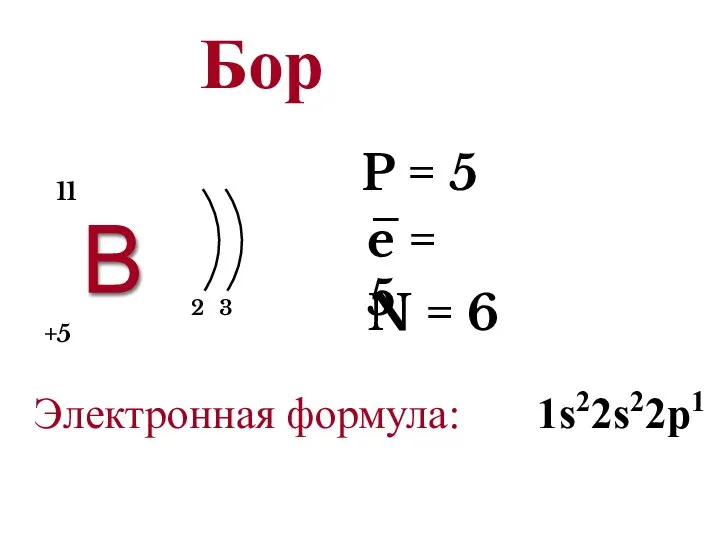
- 12. В 2 3 +5 11 P = 5 e = 5 N = 6 − Электронная
- 13. Бор Кристаллы бора черного цвета, тугоплавкие, диамагнитны. В свободном состоянии бор — серое кристаллическое, либо тёмное
- 14. Бор Кристаллический бор построен из двадцатигранника, химически инертен. B12
- 15. Особенности химии бора Получение: B2O3 + 6К = 2B(т) + 3К2O B2H6 = 2B(т) + 3H2(г)
- 16. В обычных условиях кристаллический бор весьма инертен и непосредственно взаимодействует только со фтором. 2B + 3F2
- 17. Взаимодействие со сложными веществами B + 3HNO3 = B(OH)3 + 3NO2↑ 4B + 4NaOH(т) + 3
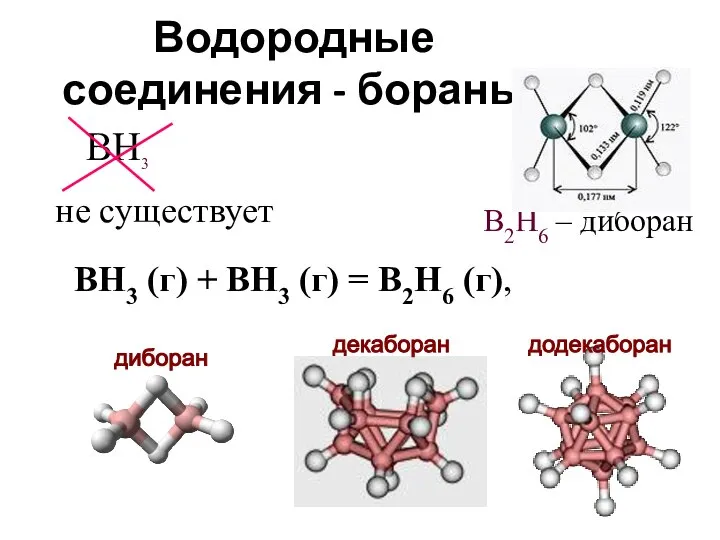
- 18. Водородные соединения - бораны BH3 B2H6 – диборан ВH3 (г) + ВН3 (г) = В2Н6 (г),
- 19. Бороводороды - химически весьма активны. Так, большинство боранов на воздухе самовоспламеняются и сгорают с выделением очень
- 20. Оксид бора (III) В2O3 Оксид бора (III) В2O3 легко переходит в стеклообразное состояние и очень трудно
- 22. Ортоборная кислота Ортоборат водорода (в растворе ортоборная кислота). В твердом состоянии Н3ВО3 — чешуйки, жирные на
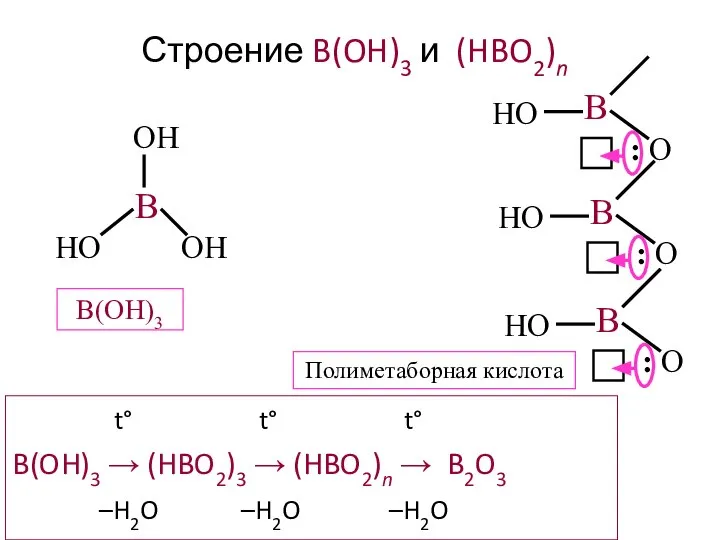
- 23. Строение B(OH)3 и (HBO2)n t° t° t° B(OH)3 → (HBO2)3 → (HBO2)n → B2O3 –H2O –H2O
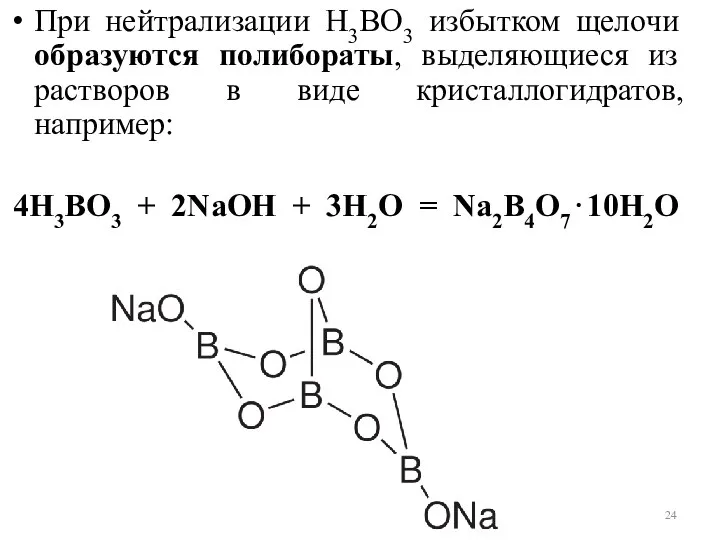
- 24. При нейтрализации Н3ВO3 избытком щелочи образуются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например: 4Н3ВО3 +
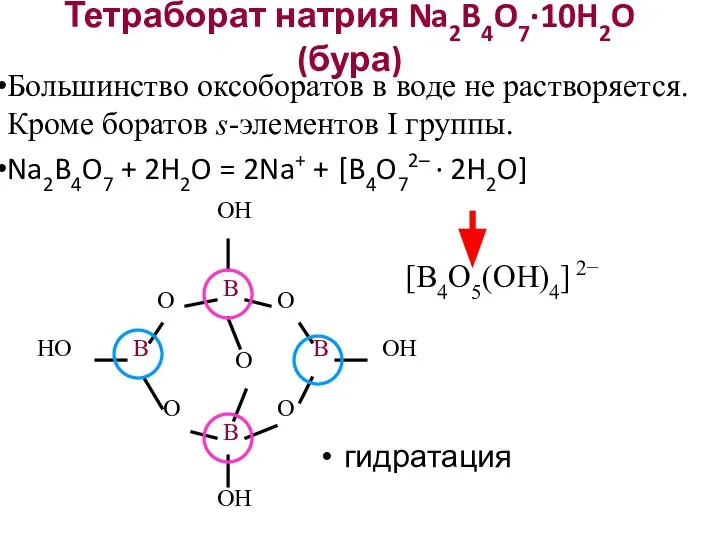
- 25. Тетраборат натрия Na2B4O7·10H2O (бура) Большинство оксоборатов в воде не растворяется. Кроме боратов s-элементов I группы. Na2B4O7
- 26. При прокаливании буры с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты — стекла, часто окрашенные в
- 27. Борная кислота против муравьев эффективна за счет того, что влияет на работу его нервной системы. После
- 28. Ортоборная кислота Н3ВО3 антисептическое средство удобрение
- 29. Алюминий Al 27 +13 0 2 8 3 P = 13 e = 13 N =
- 30. Нахождение в природе По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е
- 31. AL2O3 Корунд сапфир рубин
- 32. Синий цвет сапфира обусловлен примесями титана и железа в кристаллической решётке Al2O3.
- 33. Физические свойства Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы) легкий (с малой плотностью
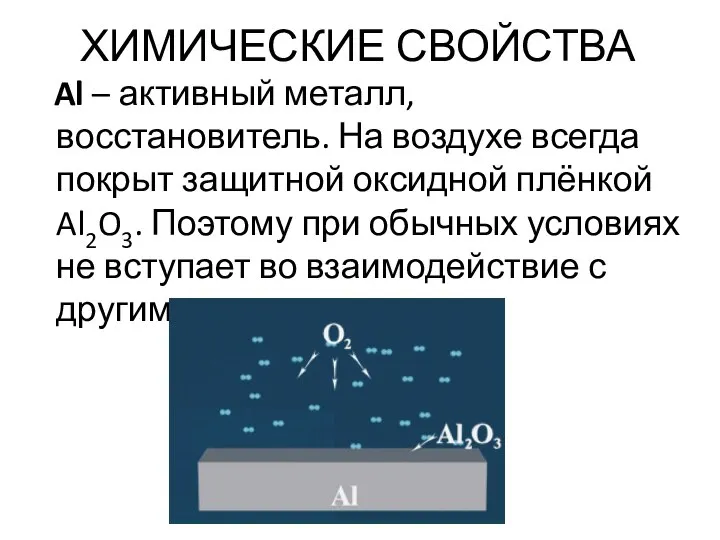
- 34. ХИМИЧЕСКИЕ СВОЙСТВА Al – активный металл, восстановитель. На воздухе всегда покрыт защитной оксидной плёнкой Al2O3. Поэтому
- 36. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 37. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки, например, амальгамированием или растворами горячей
- 38. УДАЛЕНИЕ ОКСИДНОЙ ПЛЕНКИ АЛЮМИНИЯ https://www.youtube.com/watch?v=9wnYXTP1OC8
- 39. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4 и HNO3
- 40. Домашнее задание Подберите коэффициенты методом электронного баланса: Al + разб. H2SO4= Al2(SO4)3 + SO2 + H2O
- 41. Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит) имеет слоистую кристаллическую решетку. .
- 42. При прокаливании гидроксида алюминия А12О3⋅nН2О постепенно теряет воду, превращаясь в конечном счете в А12О3. Одна из
- 43. Современный метод получения алюминия Современный метод получения заключается в растворении оксида алюминия в расплаве криолита с
- 44. ПРИМЕНЕНИЕ АЛЮМИНИЯ В Авиации Военная промышленность В Космической технике В Электротехнике В Судостроении В Строительстве В
- 46. Скачать презентацию

![Элементы IIIА-группы Общая электронная формула: […] ns 2 (n –1)d 10](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395868/slide-3.jpg)






























 Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Электронное строение атома
Электронное строение атома Лед – как состояние воды
Лед – как состояние воды Соли азотной кислоты, применение
Соли азотной кислоты, применение Липидтер. Сабынданатын және сабынданбайтын липидтер
Липидтер. Сабынданатын және сабынданбайтын липидтер Знаки химических элементов. Дополнение
Знаки химических элементов. Дополнение Презентация по Химии "Химия и пища" - скачать смотреть
Презентация по Химии "Химия и пища" - скачать смотреть  Ароматические углеводороды
Ароматические углеводороды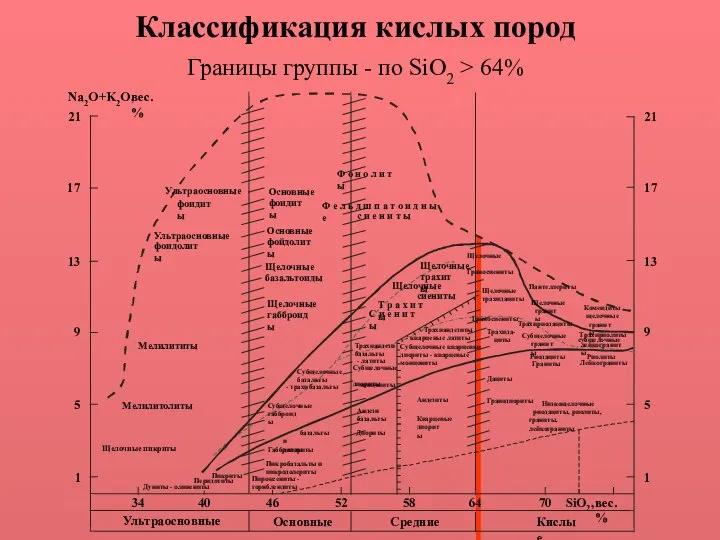 Классификация кислых пород
Классификация кислых пород Механизм старения масел
Механизм старения масел Товароведная характеристика и показатели качества соленой рыбы
Товароведная характеристика и показатели качества соленой рыбы Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» “РОЗЧИННИК”
“РОЗЧИННИК”  Щелочные породы среднего состава
Щелочные породы среднего состава Уральские горы. Самоцветы
Уральские горы. Самоцветы Sources of alkanes and cycloalkanes. Crude oil
Sources of alkanes and cycloalkanes. Crude oil Геометрия молекул
Геометрия молекул Основы промышленной экологии. Занятие 2
Основы промышленной экологии. Занятие 2 Гетерофункциональные соединения. (Лекция 14)
Гетерофункциональные соединения. (Лекция 14) Лужні метали Підготувала: Анна Сідорова
Лужні метали Підготувала: Анна Сідорова  Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Работу выполнил: ученик 11 класса Палкин Денис
Работу выполнил: ученик 11 класса Палкин Денис ФЕРРОМАГНИТНЫЕ ЖИДКОСТИ Исполнитель: Измоденова Дарья Игоревна Ученица 11 «А» МБОУ СОШ №151
ФЕРРОМАГНИТНЫЕ ЖИДКОСТИ Исполнитель: Измоденова Дарья Игоревна Ученица 11 «А» МБОУ СОШ №151 Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых ГИА. Вопрос А2. ПЗ и ПСХЭ
ГИА. Вопрос А2. ПЗ и ПСХЭ Получение спиртов. Применение
Получение спиртов. Применение Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості Сведения о воде
Сведения о воде