Содержание
- 2. Химические процессы могут сопровождаться различными явлениями — поглощением и выделением теплоты, света, звука и т.д. В
- 3. Алессандро Вольта опытным путём установил ряд напряжений металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. Сила
- 4. В 1853 г. русский учёный, один из основоположников физической химии Николай Николаевич Бекетов (1827-1911) сделал в
- 5. Теоретическую основу ряда активности (и рядa напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941).
- 6. Величина , характеризующая способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из
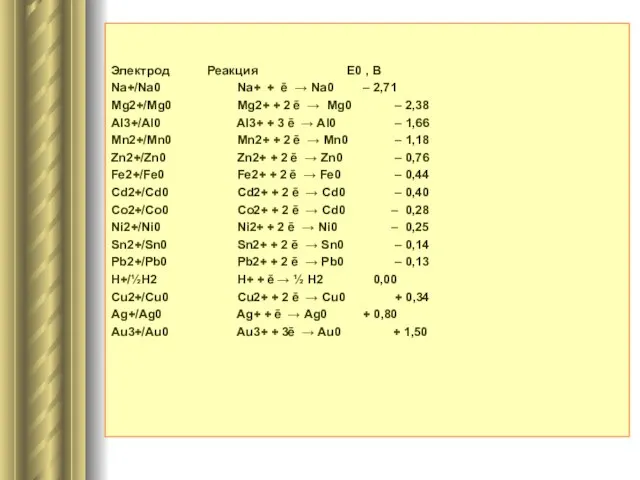
- 7. Электрод Реакция Е0 , В Na+/Na0 Na+ + ē → Na0 – 2,71 Mg2+/Mg0 Mg2+ +
- 8. Величина электродного потенциала зависит от природы металла, концентрации ионов в растворе, температуры и определяется уравнением Нернста:
- 9. Стандартный потенциал окислительно-восстановительной пары, в которой окисленной формой является выбранный нами окислитель, называется потенциалом окислителя φоОк,
- 10. Ряд стандартных электродных потенциалов характеризует восстановительную способность металлов в окислительно-восстановительных реакциях, протекающих в водной среде при
- 15. Скачать презентацию











 Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Оксиды углерода
Оксиды углерода Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно
Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно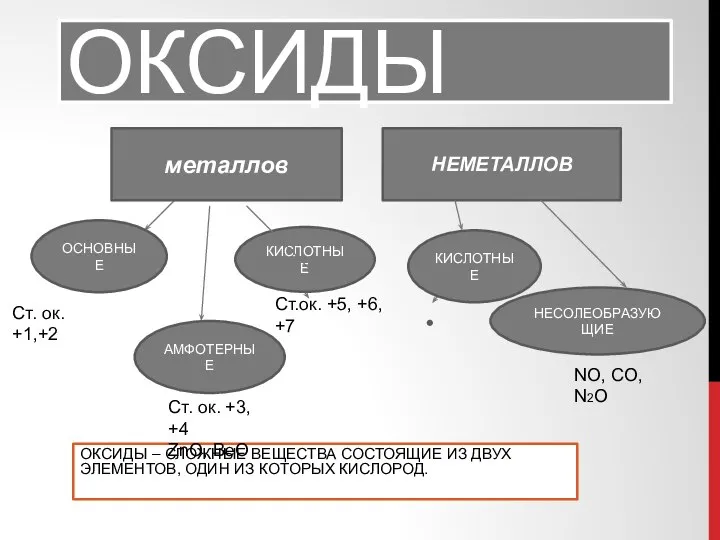 Оксиды
Оксиды Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы Гормоны гипофиза. (Лекция 12)
Гормоны гипофиза. (Лекция 12) Пластмасса
Пластмасса Химия и стирка
Химия и стирка  Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть
Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть  Основы органической химии
Основы органической химии Атом – сложная частица
Атом – сложная частица Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов Химические свойства оксидов
Химические свойства оксидов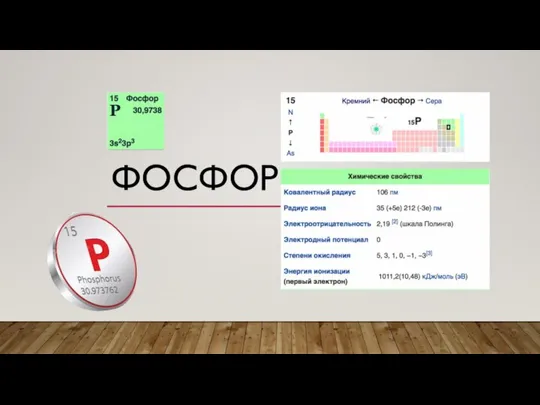 Фосфор. Функции фосфора в организме
Фосфор. Функции фосфора в организме Corrosion
Corrosion 11 хб
11 хб  Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Биогенные s-элементы
Биогенные s-элементы Исследование спектральных и люминесцентных свойств боратных стекол с добавлением висмута
Исследование спектральных и люминесцентных свойств боратных стекол с добавлением висмута Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн
Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева
Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева Углеводороды – самые простые органические соединения
Углеводороды – самые простые органические соединения Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Ионное произведение воды. Понятие о рН раствора
Ионное произведение воды. Понятие о рН раствора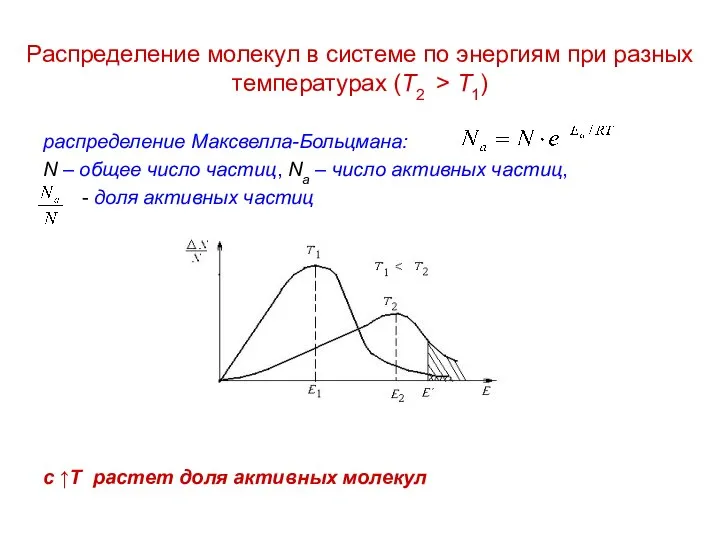 Распределение молекул в системе по энергиям при разных температурах
Распределение молекул в системе по энергиям при разных температурах