Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
Содержание
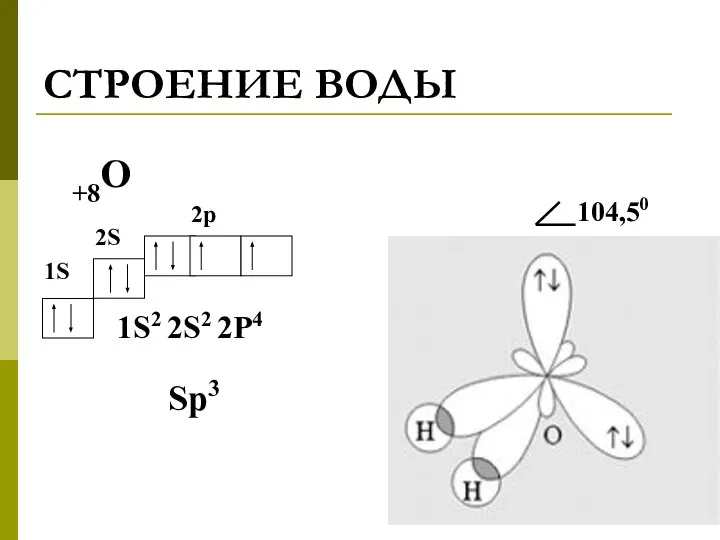
- 2. СТРОЕНИЕ ВОДЫ +8О 1S2 2S2 2P4 1S 2S 2p Sp3
- 3. ОБРАЗОВАНИЕ ВОДОРОДНЫХ СВЯЗЕЙ В ВОДЕ ●●● H - O ●●● H - O ●●● H -
- 4. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ Массовая доля ω(Х) – отношение массы растворённого вещества к общей массе раствора (выражают
- 5. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 2) Молярная концентрация С(Х) – количество молей растворённого вещества в единице объёма раствора
- 6. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 3) Молярная концентрация эквивалента растворённого вещества – отношение количества вещества эквивалента к объёму
- 7. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ - молярная масса эквивалента;
- 8. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ - фактор эквивалентности; Z - основность кислоты или кислотность основания в кислотно-основной реакции
- 9. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 4) Моляльная концентрация – показывает отношение количества вещества в молях к массе растворителя
- 10. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 5) Молярная доля растворённого вещества – отношение количества данного компонента (моль) к сумме
- 11. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 6) Титр – отношение массы вещества к объёму раствора Единица измерения - [г/мл]
- 12. ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ Вещества самопроизвольно могут растворятся, если ΔG0 ΔH0р = ΔH0крист. + ΔH0сольват. ∆G0= ∆H0
- 13. САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ 1) При растворении твёрдых веществ с ионной кристаллической решёткой (NaCl, KCl) ΔH0р-я >
- 14. САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ 2) При растворении твёрдых веществ с ковалентной связью (сахар) и жидкостей ΔH0 0,
- 15. САМОПРОИЗВОЛЬНОЕ РАСТВОРЕНИЕ ВЕЩЕСТВ 3) Для газов ΔH0кр = 0, тогда ΔH0раств = ΔH0сольв, ΔH0раств ΔS TΔS
- 16. ЗАКОН ГЕНРИ Количество газа, растворённого при данной температуре в определённом объёме жидкости, при равновесии прямо пропорционально
- 17. ЗАКОН СЕЧЕНОВА Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание газов С(Х) – растворимость
- 18. ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ Давление пара раствора, содержащего нелетучее растворённое вещество, прямо пропорционально молярной доле растворителя
- 19. Р –давление пара над раствором, (Па); Кр – константа Рауля, (Па); æ(Х1) –молярная доля растворителя Х1
- 20. ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ Р0- давление пара над чистым растворителем, (Па); Р – давление пара растворителя
- 21. - относительное понижение давления пара над раствором (Па) Р0 - Р = ΔР ΔР = Р0×æ(раств.
- 22. ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ ΔTК = KЭ×b(Х) b(Х) - моляльная концентрация (моль/кг) KЭ – эбулиометрическая константа,
- 23. ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРОВ
- 24. ТЕМПЕРАТУРА КИПЕНИЯ РАСТВОРА T(КИП.Р-РА) = TКИП.Р-ЛЯ + ΔTК
- 25. ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРА ΔTЗ = KЗ×b(Х) b(Х) – моляльная концентрация, моль/кг KЗ – криометрическая константа,
- 26. ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРА
- 27. ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ РАСТВОРА ТЗАМ. Р-РА = ТЗАМ. Р-ЛЯ - ΔТЗ
- 28. РАСЧЁТ МОЛЯРНЫХ МАСС РАСТВОРЁННОГО ВЕЩЕСТВА-НЕЭЛЕКТРОЛИТА
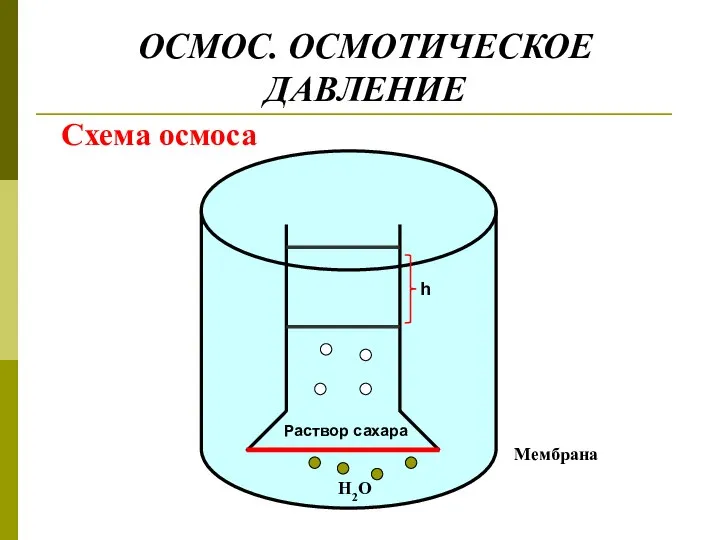
- 29. ОСМОС. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ Схема осмоса
- 30. Расчет величины осмотического давления Р = h ∙ ρ ∙ g Р - гидростатическое давление столба
- 31. Уравнение Вант-Гоффа πосм = С(х) ∙ R ∙ T R – универсальная газовая постоянная (8,3Дж/моль×К);[кПа×л/моль×К]
- 32. РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ В БИОЛОГИЧЕСКИХ СИСТЕМАХ 1) При помещении клеток в изотонический раствор, клетки
- 33. РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ В БИОЛОГИЧЕСКИХ СИСТЕМАХ 3) При помещении клеток в гипотонический раствор вода
- 34. РАСЧЁТ ИЗОТОНИЧЕСКОГО КОЭФФИЦИЕНТА i - показывает во сколько раз практически полученные величины выше теоретических, т. е.
- 35. УРАВНЕНИЯ ДЛЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ ΔТЗ = i×КЗ×b(Х) П =i ×С(Х) × R × T ΔТК =
- 37. Скачать презентацию








![СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ 6) Титр – отношение массы вещества к объёму раствора Единица измерения - [г/мл]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1403273/slide-10.jpg)


















![Уравнение Вант-Гоффа πосм = С(х) ∙ R ∙ T R – универсальная газовая постоянная (8,3Дж/моль×К);[кПа×л/моль×К]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1403273/slide-30.jpg)




 Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Электрохимическая защита
Электрохимическая защита Карбоновые кислоты
Карбоновые кислоты Кислотные и основные свойства биоорганических соединений. (Лекция 2)
Кислотные и основные свойства биоорганических соединений. (Лекция 2) Островные силикаты (Орто)
Островные силикаты (Орто) Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Элементы V А группы. Азот и его соединения
Элементы V А группы. Азот и его соединения Валетные состояния атома углерода
Валетные состояния атома углерода Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу
Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу Смесители. Пропеллерная мешалка
Смесители. Пропеллерная мешалка Титан. Технология титана
Титан. Технология титана Классификация опасных грузов
Классификация опасных грузов Химия лекция (вебинар)
Химия лекция (вебинар) Кислород. Происхождение слова Кислород
Кислород. Происхождение слова Кислород Катализаторы
Катализаторы Презентация по Химии "Законы газового состояния вещества" - скачать смотреть
Презентация по Химии "Законы газового состояния вещества" - скачать смотреть  Выращивание кристаллов из соли
Выращивание кристаллов из соли Релаксационные свойства полимеров
Релаксационные свойства полимеров Создание косметических средств
Создание косметических средств Взаимосвязь между классами неорганических веществ
Взаимосвязь между классами неорганических веществ Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.
Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.  Бу́ферные систе́мы кро́ви
Бу́ферные систе́мы кро́ви Детонаційна стійкість бензину Підготувала учениця 11-Б класу ЖЕЛ №24 Гуленко Катерина
Детонаційна стійкість бензину Підготувала учениця 11-Б класу ЖЕЛ №24 Гуленко Катерина  Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях
Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях Atomic structure
Atomic structure Эндогенная серия. Скарновая группа
Эндогенная серия. Скарновая группа Стекло — твердое неорганическое вещество
Стекло — твердое неорганическое вещество