Содержание
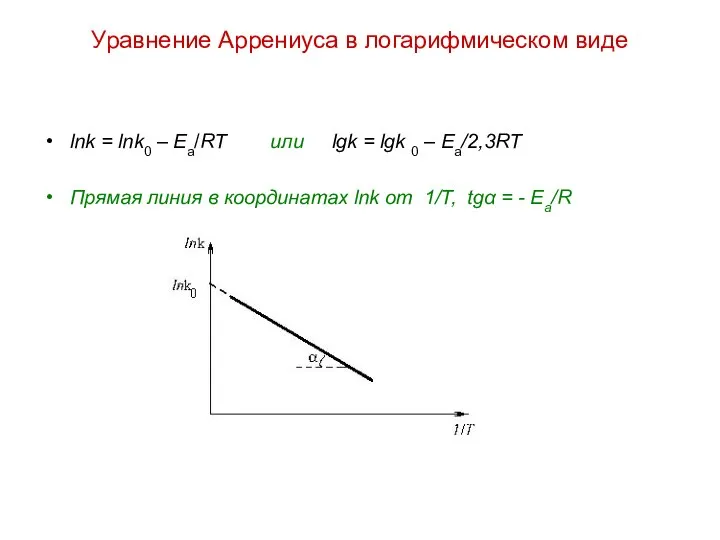
- 2. Уравнение Аррениуса в логарифмическом виде lnk = lnk0 – Еа/RT или lgk = lgk 0 –
- 3. Приведем уравнение Аррениуса для двух температур (Т1 и Т2): lnk1 = lnk0 – Еа/RT1 lgk1 =
- 4. Уравнение Аррениуса в дифференциальной форме: Ea /(RT2) > 0 k возрастает с ↑Т
- 5. Связь энергии активации с тепловым эффектом реакции Обратимые химические реакции протекают в прямом и обратном направлении
- 6. Заменим (Константа равновесия) Получим Запишем изобару Вант-Гоффа Следовательно связь термодинамических и кинетических параметров: Разность между энергиями
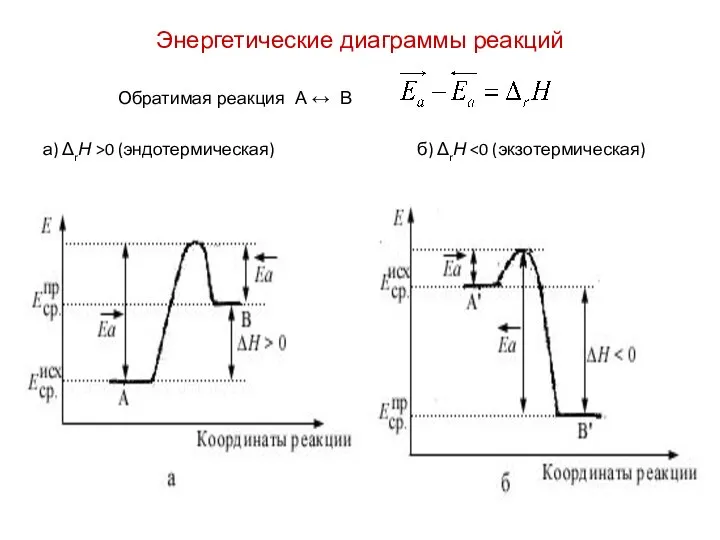
- 7. Энергетические диаграммы реакций Обратимая реакция А ↔ В а) ΔrН >0 (эндотермическая) б) ΔrН
- 8. Катализ Явление изменения скорости реакции под воздействием катализаторов называется катализом Положительный катализ – процесс, ускоряющий реакцию
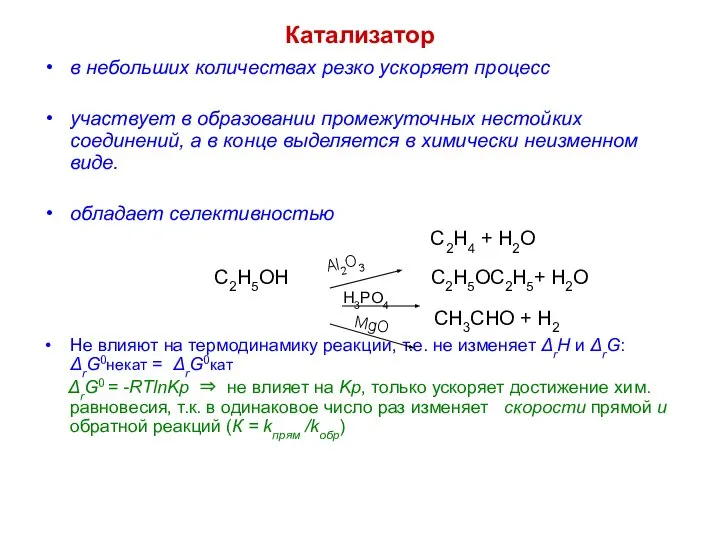
- 9. Катализатор в небольших количествах резко ускоряет процесс участвует в образовании промежуточных нестойких соединений, а в конце
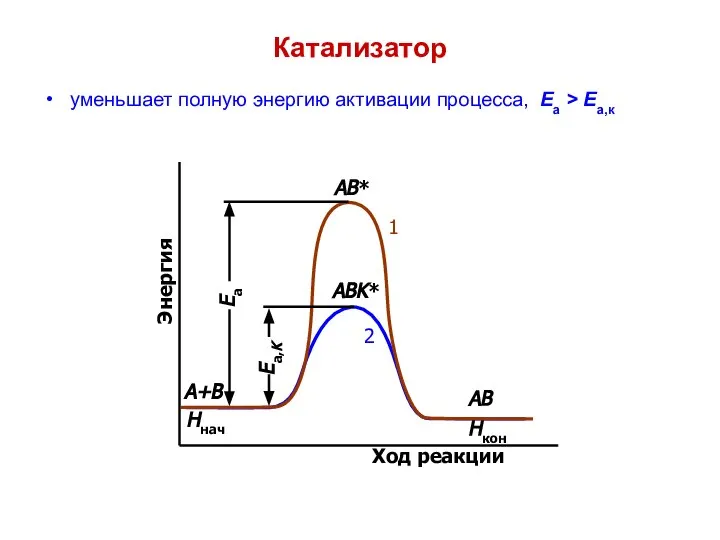
- 10. Катализатор уменьшает полную энергию активации процесса, Еа > Еа,к
- 11. Каталитическая реакция с образованием двух активированных комплексов
- 12. Механизм гомогенного катализа: катализатор образует с реагентами промежуточное соединение, разложение которого является лимитирующей стадией процесса. Газофазный
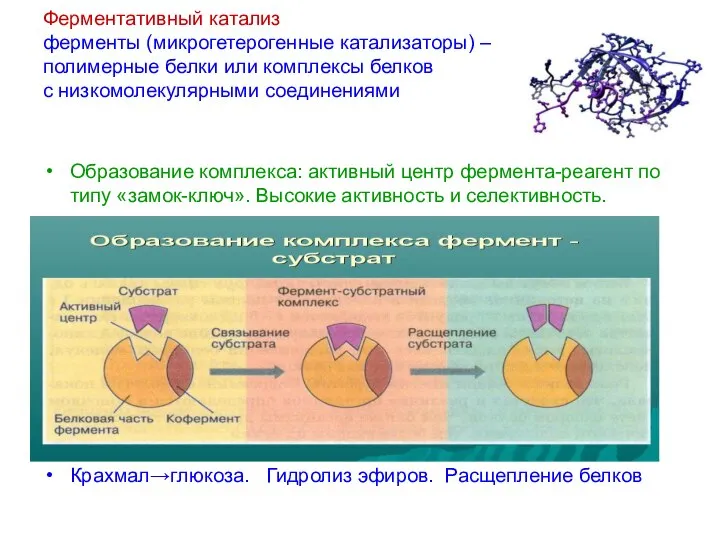
- 13. Ферментативный катализ ферменты (микрогетерогенные катализаторы) – полимерные белки или комплексы белков с низкомолекулярными соединениями Образование комплекса:
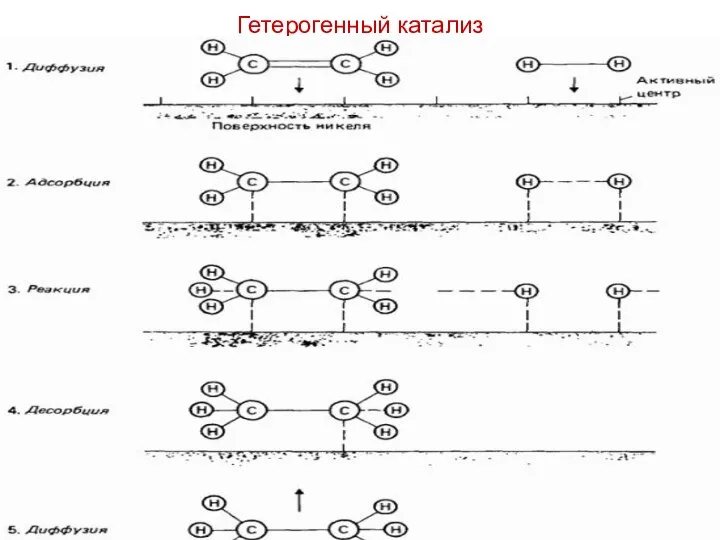
- 14. Гетерогенный катализ
- 15. Теория гетерогенного катализа В результате адсорбции на поверхности катализатора ослабляются или разрываются химические связи в молекулах
- 16. Особенности гетерогенного катализа: Действие kt зависит от способа получения kt: акт Cu(NO3)2 to Cu + 2NO2
- 18. Скачать презентацию









 Элементарные процессы роста кристаллов (лекция 2)
Элементарные процессы роста кристаллов (лекция 2) c4bf82f888b84ff1b75efb1a64c84b0f
c4bf82f888b84ff1b75efb1a64c84b0f Получение и реакции пиразина
Получение и реакции пиразина Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Энергетический обмен
Энергетический обмен Правила поведения зимой на воде
Правила поведения зимой на воде  Классы неорганических соединений Оксиды Кислоты Соли Основания
Классы неорганических соединений Оксиды Кислоты Соли Основания Основы промышленной экологии. Занятие 2
Основы промышленной экологии. Занятие 2 Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Ізотопи і нукліди
Ізотопи і нукліди Номенклатура органических веществ - алканов
Номенклатура органических веществ - алканов Своя игра «Знаешь ли ты химические элементы?»
Своя игра «Знаешь ли ты химические элементы?» Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Л3.12 Композицитонные материалы
Л3.12 Композицитонные материалы Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза Полимеры. Классификация, применение
Полимеры. Классификация, применение Значение органической химии Кондрашов Алексей | 9 А класс
Значение органической химии Кондрашов Алексей | 9 А класс  Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Игра «Химические элементы» (формулы и названия)
Игра «Химические элементы» (формулы и названия) Агрохимия растений
Агрохимия растений Штучні і синтетичні волокна
Штучні і синтетичні волокна  Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Релаксационные свойства полимеров
Релаксационные свойства полимеров Роль металлов в нашей жизни
Роль металлов в нашей жизни Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Предмет химии. Вещества
Предмет химии. Вещества Гидролиз солей.
Гидролиз солей.  Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал
Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал