Содержание
- 2. Общая характеристика
- 3. Натрий, химические свойства Электронная формула: 11Na 1s22s22p63s1; c.o.+1, комплексообразование не характерно. 2Na+Cl2=2NaCl хлорид натрия 2Na+S=Na2S сульфид
- 4. Натрий, химические свойства Для регенерации воздуха в замкнутых помещениях используется реакция: 2Na2O2+2CO2=2Na2CO3+O2 Na2O2+Na=2Na2O оксид натрия, основный
- 5. Топография ω(Na) в организме=0,08%, макроэлемент, при массе тела 70 кг масса натрия 60г. Топография натрия: Na+-
- 6. Биороль натрия: 1. Поддерживает постоянное осмотическое давление в 7,7 атм. (осмотический гомеостаз). 2. Поддерживает постоянное значение
- 7. Избыток и дефицит Na: Избыток Na+ в клетках головного мозга угнетает ЦНС, вызывает депрессию. Недостаток Na+
- 8. Лекарственные препараты: 1. NaCl - 0,9%-ный раствор, физиологический раствор, изотонический раствор. Внутривенно при интоксикациях и обезвоживании,
- 9. Лекарственные препараты: б) при повышенной кислотности желудочного сока: NaHCO3+HCl=NaCl+H2O+CO2↑ в) слабый антисептик, т.к. в результате гидролиза
- 10. Калий Электронная формула: 19К 1s22s22p63s23p64s1, с.о.=+1, комплексообразование не характерно. ω(К) в организме=0,23%, макроэлемент, масса калия в
- 11. Биороль К: Участвует в сокращении мышц, способствует мышечному расслаблению. Участвует в проведении нервных импульсов (совместно с
- 12. Избыток и недостаток: Избыток K+ ведет к снижению содержания Na+, внеклеточная среда становится гипотонической и происходит
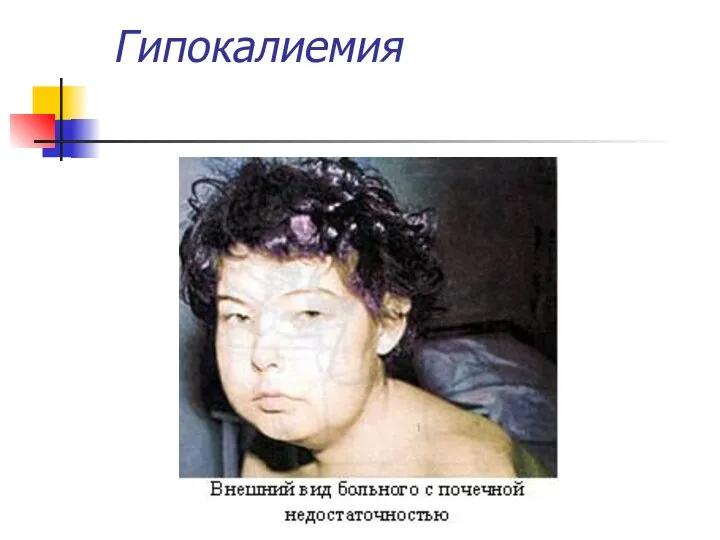
- 13. Гипокалиемия
- 14. Лекарственные препараты: KCl – при гипокалиемии, аритмии, рвоте. KI – при эндемическом зобе. KMnO4 – сильный
- 15. Кальций Электронная формула: 20Ca 1s22s22p63s23p64s2, с.о.=+2, координационное число в комплексных соединений 6,7,8. Кальций образует несимметричные комплексы
- 16. Химические свойства: Ca+S=CaS сульфид кальция Ca+Cl2=CaCl2 хлорид кальция 3Ca+N2=Ca3N2 нитрид кальция Ca+H2=CaH2 гидрид кальция Ca+2H2O=Ca(OH)2+H2↑ гидроксид
- 17. Химические свойства: CaO+CO2=CaCO3 карбонат кальция, мел CaO+H2O=Ca(OH)2 Ca(OH)2+2CO2=Ca(HCO3)2 гидрокарбонат кальция Ca(HCO3)2→CaCO3↓+H2O+CO2↑ Ca(OH)2+2HCl=CaCl2+2H2O Ca(OH)2+H2SO4=CaSO4↓+2H2O сульфат кальция
- 18. Са in vivo ω (Ca) в организме = 1, 4%, макроэлемент, масса кальция ~ 1,5 кг.
- 19. Биороль кальция: 1. Является основным минеральным компонентом костной и зубной ткани в виде гидроксил- и фторапатитов
- 20. Избыток и недостаток: Суточная потребность ~ 1г. При недостатке Ca2+ : снижение свертываемости крови, судороги, конвульсии,
- 21. Дефицит кальция. Тонические судороги мышц кисти руки.
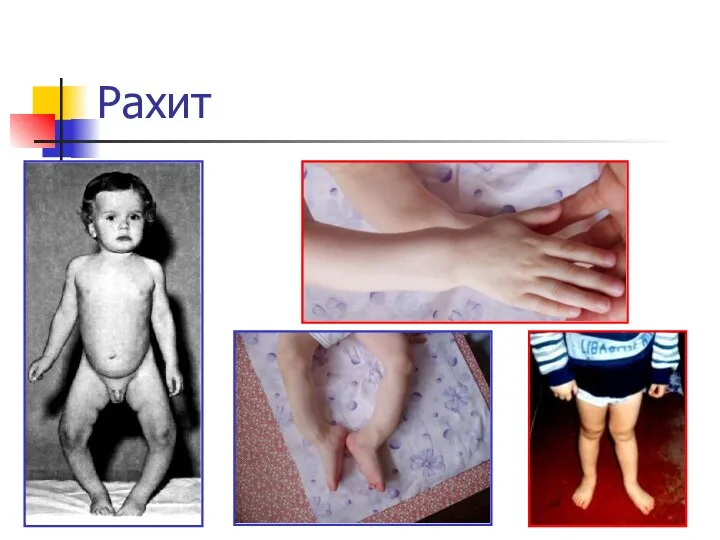
- 22. Рахит
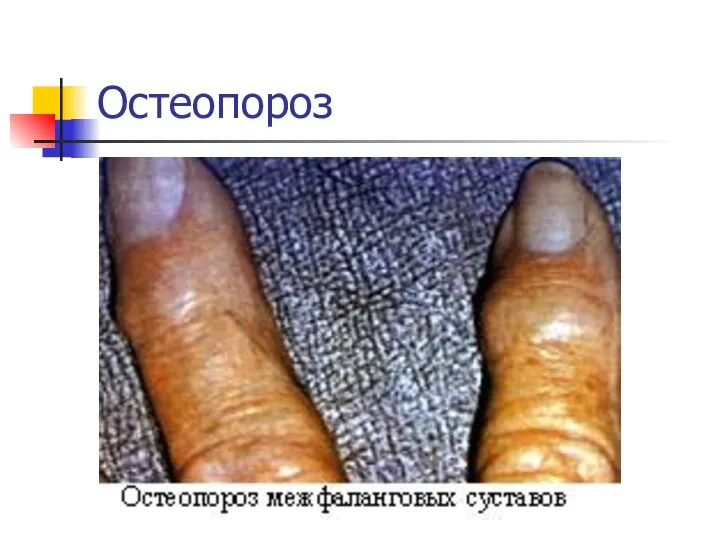
- 23. Остеопороз
- 24. Артроз
- 25. Лекарственные препараты кальция: 1. CaCO3 – мел осажденный, антацидное средство, применяется для уменьшения кислотности желудочного сока:
- 26. Магний Электронная формула: 12Mg 1s22s22p63s2, с.о.=+2, координационное число 6, магний образует комплексы с биолигандами, в составе
- 27. Биороль магния: 1. Регулирует артериальное давление. 2. Уменьшает спазм сосудов. 3. Регулирует работу сердца ( при
- 28. Mg in vivo ω(Mg)в организме=0,027%, макроэлемент, масса магния в организме 20г. Топография: дентин и эмаль зубов,
- 29. Избыток и недостаток Mg: В организм поступает с пищей: рыба, морская капуста, соя, какао, грецкие орехи,
- 30. Лекарственные препараты: MgO - жженая магнезия, антацидное средство без побочного действия: MgO+2HCl=MgCl2+H2O. MgO+MgO2 – «магний перекись»,
- 32. Скачать презентацию


























 Ионная химическая связь
Ионная химическая связь Ароматические углеводороды
Ароматические углеводороды Комплексные соединения
Комплексные соединения Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Урок по химии в 10 классе по теме Каучуки
Урок по химии в 10 классе по теме Каучуки Углеводы. Глюкоза
Углеводы. Глюкоза Алюминий и его свойства
Алюминий и его свойства Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов
Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов Интересные факты о нефти
Интересные факты о нефти Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Бальзам-ополаскиватель для волос
Бальзам-ополаскиватель для волос Углеводы. Структура
Углеводы. Структура Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Обмен белков - 1
Обмен белков - 1 Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Cтроение и спектры молекул
Cтроение и спектры молекул L’introduction a la biochimie. La structure et les proprietes des proteines
L’introduction a la biochimie. La structure et les proprietes des proteines Углерод. Нахождение в природе
Углерод. Нахождение в природе Интернет-тренажеры
Интернет-тренажеры Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) Окислительные методы получения органических соединений
Окислительные методы получения органических соединений Презентация по Химии "Вода - найдивовижніша речовина в світі" - скачать смотреть бесплатно
Презентация по Химии "Вода - найдивовижніша речовина в світі" - скачать смотреть бесплатно Фотосинтез. Суммарное уравнение, общий вид
Фотосинтез. Суммарное уравнение, общий вид