Содержание
- 2. Ознакомиться с электролитической диссоциацией , её особенностями , рассмотреть примеры. Цель:
- 3. -Определение -Особенности -Тип кристаллической решетки -Схемы образования -Примеры -Тест -Вывод -Литература Содержание:
- 4. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Определение:
- 6. Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем. Диссоциация в растворах
- 7. Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой
- 8. -Процессу диссоциации подвержены все вещества, имеющие ионный и ковалентный полярный тип химических связей. -Все вещества в
- 9. Сильные электролиты Слабые электролиты Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью
- 10. Электроли́ты — вещества, которые проводят электрический ток вследствие диссоциации на ионы, что происходит в растворах и
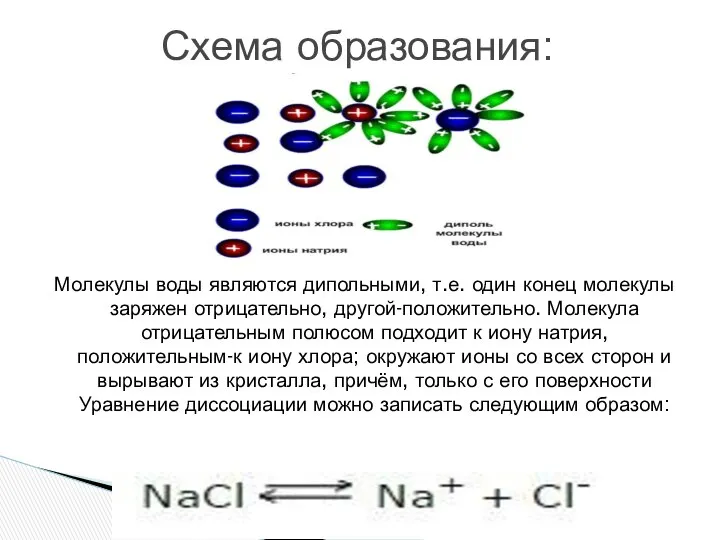
- 11. Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к
- 12. Электролиты: -Кислоты (HCl;HNO3;H2SO4) -Щелочи( NaOH; KOH; Ba(OH)2) -Соли(NaCl; CuSO4; Al(NO3)3) Неэлектролиты: -Органические вещества(сахар, ацетон,бензин, керосин, глицерин,
- 13. Электролитическая диссоциация это..? А)Сливание жидкости с отстоявшегося осадка. Б) Получение сложных эфиров из кислот и спиртов.
- 16. 2.Верны ли следующие суждения об электролитах: 1)Растворы и расплавы электролитов проводят электрический ток. 2) Электролитами являются
- 19. 3.Все вещества в растворах делят на...? А)Электролиты и неэлектролиты Б)Летучие и нелетучие В)Растворимые и нерастворимые Г)Горючие
- 22. 4.Вещества растворы которых проводят электрический ток называют? А)Неэлектролитами Б)Электролитами
- 25. 5.На что распадаются электролиты при растворение или расплавление? 1)Анионы 2) Катионы А) Верно только 1 Б)
- 28. 6.К электролитам относят: А) Сахар Б) Оксид меди( 2) В)Оксид углерода(4) Г)Соляная кислота
- 31. 7.К неэлектролитам относят: А)Гидрооксид натрия Б)Оксид углерода(4) В) Хлорид натрия Г) Серная кислота
- 34. 8.Все за исключением одного относятся к электролитам ,лишнее в списке ? А)Кислоты Б)Оксиды В)Соли Г)Щелочи
- 37. Ознакомилась с электролитической диссоциацией и её особенностями , рассмотрела примеры. Вывод:
- 39. Скачать презентацию



































 Галогенопроизводные углеводородов. (Лекция 8)
Галогенопроизводные углеводородов. (Лекция 8) Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Химия Чудес
Химия Чудес Свойства изомеров. Курсовая работа
Свойства изомеров. Курсовая работа Урок в 7 класі КЗ Верхівцевського НВК учитель хімії Кукса Н.М.
Урок в 7 класі КЗ Верхівцевського НВК учитель хімії Кукса Н.М.  Химия плутония, америция и трансамерициевых актиноидов
Химия плутония, америция и трансамерициевых актиноидов Химия вокруг нас
Химия вокруг нас Металловедение. Химический состав, структура, термическая обработка, технология изготовления металлов
Металловедение. Химический состав, структура, термическая обработка, технология изготовления металлов Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Методы определения физико-химических условий минерало-и рудообразования
Методы определения физико-химических условий минерало-и рудообразования Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК) Детоксикация ксенобиотиков
Детоксикация ксенобиотиков Презентация по химии Химия в повседневной жизни человека
Презентация по химии Химия в повседневной жизни человека  Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Dmitri Ivanovich Mendeleev
Dmitri Ivanovich Mendeleev Электролиз. Классификация
Электролиз. Классификация Вода. Физические и химические свойства
Вода. Физические и химические свойства Презентация по Химии "Основные законы химии" - скачать смотреть бесплатно
Презентация по Химии "Основные законы химии" - скачать смотреть бесплатно Структура периодической системы химических элементов (8 класс)
Структура периодической системы химических элементов (8 класс) Основные законы химии
Основные законы химии Процеси гниття. Хімізм процесу гниття
Процеси гниття. Хімізм процесу гниття Реферат по химии на тему
Реферат по химии на тему Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Органические и неорганические вещества
Органические и неорганические вещества Атомы и молекулы
Атомы и молекулы Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Аммиак. Физические и химические свойства
Аммиак. Физические и химические свойства