Содержание
- 2. 8.2.1.1 - объяснять физический смысл атомного номера, группы, периода Цель обучения
- 3. Сабақты бекіту 3 По-видимому, периодическому закону – будущее не грозит разрушением, а только надстройки и развитие
- 4. 4 Психологический настрой Приветствую вас на уроке химии. Хорошего вам настроения и желания учиться!
- 5. Менделеева таблица, Каковы ж ее границы, Число периодов в ней семь Они известны почти всем, Групп
- 6. Предпосылки открытия Периодического закона 6
- 7. Попытки систематизации химических элементов
- 8. Жизнь и деятельность Дмитрия Ивановича Менделеева 27.01.1834-20.01.1907 гг Русский учёный-энциклопедист, химик, физик, метролог, экономист, педагог, приборостроитель,
- 9. «Заподозрив о существовании взаимосвязи между элементами еще в студенческие годы, я не уставал обдумывать эту проблему
- 10. Периодический закон Д.И.Менделеева «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят
- 11. Периодическая система химических элементов (ПСХЭ) Графическим отображением периодического закона является Периодическая система химических элементов. Известно более
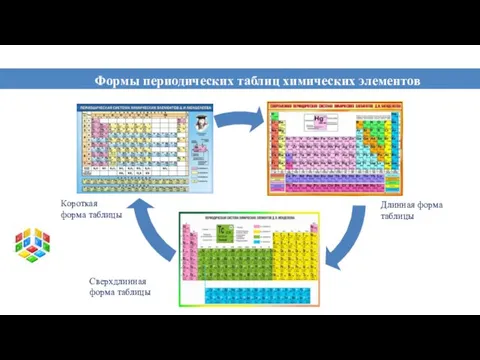
- 12. Формы периодических таблиц химических элементов Короткая форма таблицы Длинная форма таблицы Сверхдлинная форма таблицы
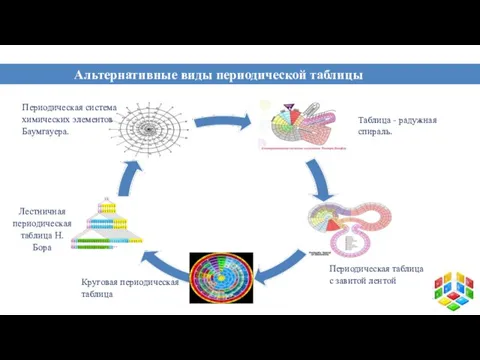
- 13. Альтернативные виды периодической таблицы химических элементов Таблица - радужная спираль. Периодическая система химических элементов Баумгауера. Лестничная
- 14. – известны с древности; – известны во времена Лавуазье; – во времена Менделеева; – к публикации
- 15. Металлы и неметаллы в Периодической таблице Если в периодической таблице элементов Д.И. Менделеева провести диагональ от
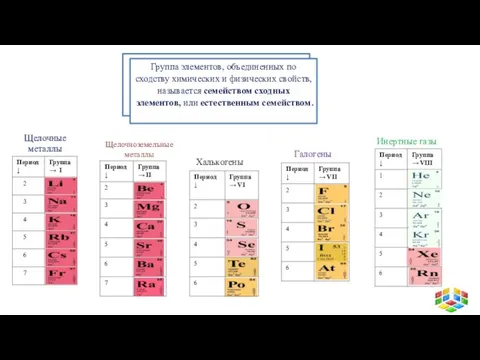
- 16. Группа элементов, объединенных по сходству химических и физических свойств, называется семейством сходных элементов, или естественным семейством.
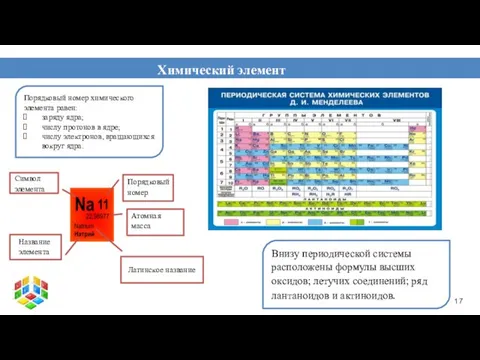
- 17. Порядковый номер химического элемента равен: заряду ядра; числу протонов в ядре; числу электронов, вращающихся вокруг ядра.
- 18. Структура ПСХЭ Периодическая таблица Периоды 7 Группы 8 Побочные Б Главные А Малые (1-3) Большие (4-7)
- 19. Большие периоды Ряды Период – горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов
- 20. Группы Главная подгруппа А Побочная подгруппа Б Группы. Подгруппы. – столбик элементов в группе слева, состоят
- 21. Изменение свойств элементов главных подгрупп и периодов. 21
- 22. Периодический закон, является одним из основных законов природы. Построенная на его основе периодическая система химических элементов
- 23. Задача Неизвестный элемент находится в I группе, относительная молекулярная масса высшего оксида 231,736.Назовите этот элемент. а)
- 24. 1 группа. Неизвестный элемент находится в V группе, относительная молекулярная масса высшего оксида 142. Назовите этот
- 25. Задание 2. Отметьте правильные утверждения (« Правда или нет, что…»). а) Каждый без исключения период начинается
- 26. Задание 3. Определить положение в ПС (период, группа, подгруппа) элементов № 14, 25, 34, 36, 53.
- 28. Скачать презентацию




















 Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1
Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1 Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Тип перовскита
Тип перовскита Нефть и способы её переработки.
Нефть и способы её переработки. Виды присадок к моторному топливу
Виды присадок к моторному топливу Смазочные материалы
Смазочные материалы Colloidal solutions coarsely dispersed systems
Colloidal solutions coarsely dispersed systems Рецепторы анионов
Рецепторы анионов Едкость Coca-Cola
Едкость Coca-Cola Кислоты
Кислоты Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Альдегиды. Строение молекул
Альдегиды. Строение молекул Фильтрационные свойства.Решение уравнений Стокса для несжимаемой жидкости
Фильтрационные свойства.Решение уравнений Стокса для несжимаемой жидкости Химия в моей специальности
Химия в моей специальности Общее понятие о липидах. Переваривание и всасывание липидов
Общее понятие о липидах. Переваривание и всасывание липидов Обмен липидов
Обмен липидов Электрохимические методы анализа
Электрохимические методы анализа XIII конференция ИХТРЭМС «Научно-практические проблемы в области химии и химических технологий»
XIII конференция ИХТРЭМС «Научно-практические проблемы в области химии и химических технологий» Азот и его соединения
Азот и его соединения Строение, получение и применение полимеров
Строение, получение и применение полимеров Химический элемент медь. (11 класс)
Химический элемент медь. (11 класс) Нефть. Способы её переработки. Продукты переработки нефти
Нефть. Способы её переработки. Продукты переработки нефти Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Химические свойства металлов
Химические свойства металлов Варианты заданий к расчету однократной экстракции
Варианты заданий к расчету однократной экстракции Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства