Содержание
- 2. C4-1-2009 Какой объем хлора (н.у.) выделится, если к 200 мл 35%-ной соляной кислоты (плотность 1,17 г/мл)
- 3. C4-1-2009 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O Vр-ра = 200 мл w =
- 4. Cl2 + 2NaOH = NaClO + NaCl + H2O n = 0,3 моль n = 0,6
- 5. Расчетные задачи по теме «Электролиз» Через 10%-ный раствор хлорида натрия массой 400 г пропустили постоянный электрический
- 6. Решение 2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑ эл.ток mр-ра = 400 г w
- 7. Решение (продолжение) 2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑ эл.ток Ответ: w(NaOH) = 5,2%
- 8. С4-2-2009 Рассчитайте, какой объем 10%-ного раствора хлороводорода плотностью 1,05 г/мл пойдет на полную нейтрализацию гидроксида кальция,
- 9. С4-3-2009 Газообразный аммиак, выделившийся при кипячении 160 г 7%-ного раствора гидроксида калия с 9,0 г хлорида
- 10. С4-4-2009 При обработке карбида алюминия раствором соляной кислоты, масса которого 320 г и массовая доля HCl
- 11. С4-5-2009 Карбид кальция обработан избытком воды. Выделившийся газ занял объем 4,48 л (н.у.). Рассчитайте, какой объем
- 12. C4-6-2009 На нейтрализацию 7,6 г смеси муравьиной и уксусной кислот израсходовано 35 мл 20%-ного раствора гидроксида
- 13. С4-7-2009 Определите массу Mg3N2, полностью подвергшегося разложению водой, если для солеобразования с продуктами гидролиза потребовалось 150
- 14. С4-8-2009 Сероводород, выделившийся при взаимодействии избытка концентрированной серной кислоты с 1,44 г магния, пропустили через 160
- 15. С4-9-2009 Оксид фосфора(V) массой 1,42 г растворили в 60 г 8,2%-ной ортофосфорной кислоты и полученный раствор
- 16. С4-10-2009 Рассчитайте, какой объем 10%-ного раствора хлороводорода плотностью 1,05 г/мл пойдет на полную нейтрализацию гидроксида кальция,
- 17. C5 Задачи на вывод формул
- 18. С5-2009-2 При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г
- 19. Решение CnH2n + HCl → CnH2n+1Cl CnH2n + HBr → CnH2n+1Br m = 7,85 г m
- 21. Скачать презентацию


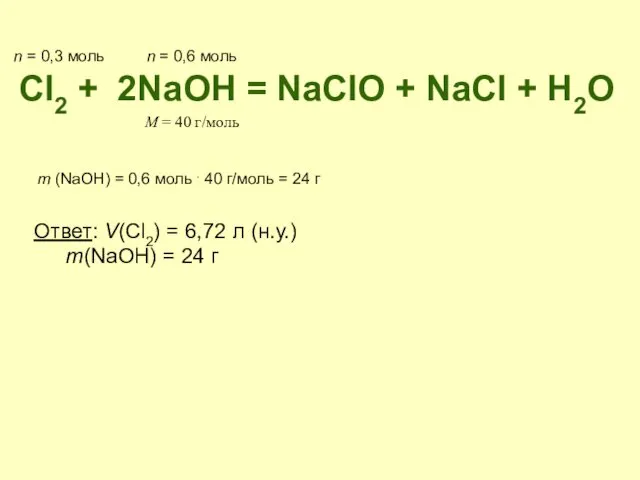















 Понятие «Эффективность». Принцип Ле-Шателье
Понятие «Эффективность». Принцип Ле-Шателье Выращивание кристаллов
Выращивание кристаллов Волшебные кристалы
Волшебные кристалы Алкены
Алкены Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение Презентация по Химии "Органическая химия" - скачать смотреть
Презентация по Химии "Органическая химия" - скачать смотреть  Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Классификация основных пород
Классификация основных пород Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Жири як компоненти їжі. Їхня роль в організмі
Жири як компоненти їжі. Їхня роль в організмі  Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде
Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы
Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Жиры в питании спортсмена
Жиры в питании спортсмена Оже спектроскопия
Оже спектроскопия Legătura chimică
Legătura chimică Энтропия и уравнение состояния идеального газа
Энтропия и уравнение состояния идеального газа Стандартизація лікарської рослинної сировини
Стандартизація лікарської рослинної сировини Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть
Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть  Булану мен конденсация
Булану мен конденсация Презентация по Химии "Молекула в расчетных методах" - скачать смотреть
Презентация по Химии "Молекула в расчетных методах" - скачать смотреть  Материаловедение. Основы металловедения
Материаловедение. Основы металловедения ТЕМА УРОКА:
ТЕМА УРОКА: Классификация металлов
Классификация металлов Роль ученых в становлении органической химии
Роль ученых в становлении органической химии Дорогие и дешёвые лекарства: «Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: «Чем похожи и чем отличаются друг от друга? Химия атмосферы
Химия атмосферы