Содержание
- 2. 1 14.09.2016 Урок 9M класса. Электролитическая диссоциация.
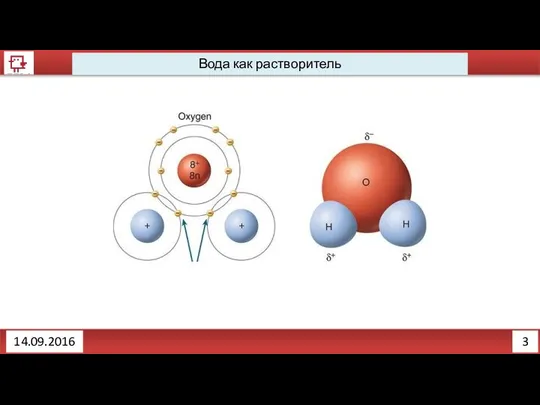
- 3. 2 Вода как растворитель 14.09.2016
- 4. 3 Вода как растворитель 14.09.2016
- 5. 4 Вода как растворитель 14.09.2016 Вещества с какой связь лучше будут растворяться в воде? С ковалентной
- 6. 5 Правило растворимости 14.09.2016 Подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу.
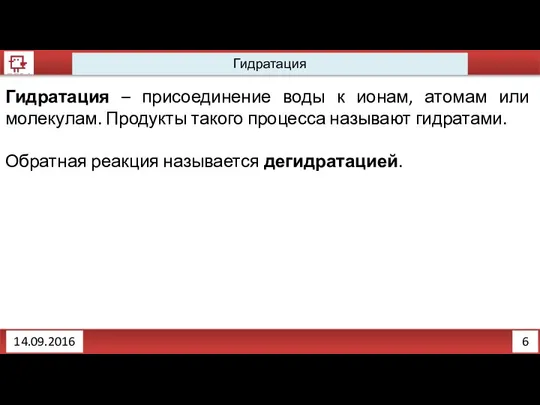
- 7. 6 Гидратация 14.09.2016 Гидратация – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют
- 8. 7 Гидратация 14.09.2016 Кристаллогидраты – кристаллические вещества, в состав которых входит химически связанная вода. Такую воду
- 9. 1 15.09.2016 Урок 9M класса. Электролитическая диссоциация.
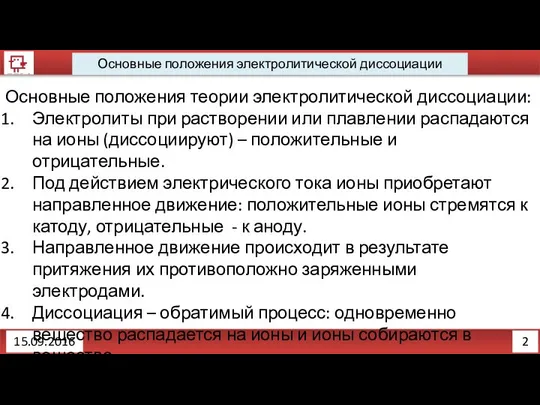
- 10. 2 Основные положения электролитической диссоциации 15.09.2016 Основные положения теории электролитической диссоциации: Электролиты при растворении или плавлении
- 11. 3 Диссоциация разных веществ 15.09.2016 Диссоциировать могут соли, кислоты, щелочки. Наиболее хорошо диссоцируют вещества с ионной
- 12. 4 Диссоциация кислот 15.09.2016 Кислоты – такие вещества, при диссоциации в водных растворах которых в качестве
- 13. 5 Диссоциация кислот 15.09.2016 H2SO4 HSO4- + H+ HSO4- SO42- + H+ H3PO4 H+ +H2PO4- H2PO4-
- 14. 6 Диссоциация щелочей 15.09.2016 Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы
- 15. 7 Диссоциация солей 15.09.2016 Соли – сложные вещества, которые в водных растворах диссоциируют на катионы металлов
- 16. 8 Сильные и слабые электролиты 15.09.2016 Бывают электролиты распадающиеся полностью, например: NaOH Na+ + OH- Бывают
- 17. 8 Сильные и слабые электролиты 15.09.2016 Бывают электролиты распадающиеся полностью, например: NaOH Na+ + OH- Бывают
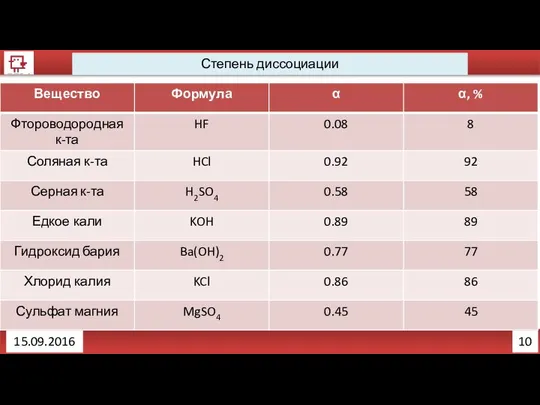
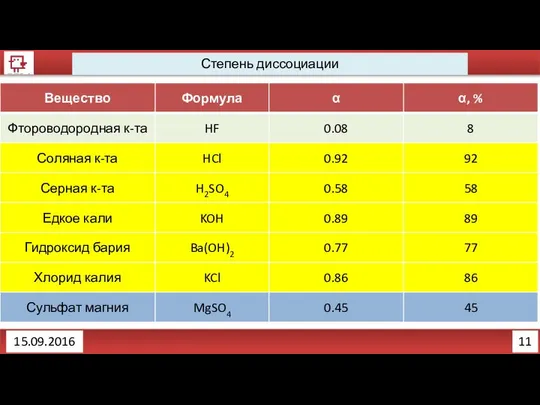
- 18. 9 Степень диссоциации 15.09.2016 Различить слабые электролиты и сильные электролиты помогает показатель степень диссоциации (α). Степень
- 19. 10 Степень диссоциации 15.09.2016
- 20. 11 Степень диссоциации 15.09.2016
- 21. 12 Степень диссоциации 15.09.2016 Нужно отметить, что при диссоциации электролита происходит увеличение количества частиц в растворе.
- 22. 13 Степень диссоциации 15.09.2016 Давайте считать! Взяли 154 г. Ba(OH)2, потом растворили в воде. Сколько частиц
- 24. Скачать презентацию
















 Ядра и частицы
Ядра и частицы Водородная связь
Водородная связь Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Химия полимерных материалов для буровых растворов. Лекция 3. Технологические жидкости для бурения скважин
Химия полимерных материалов для буровых растворов. Лекция 3. Технологические жидкости для бурения скважин Классификация неорганических веществ
Классификация неорганических веществ Презентация по Химии "Патофизиология аритмий сердца ПАТОФИЗИОЛОГИЯ АРИТМИЙ СЕРДЦА" - скачать смотреть бесплатно
Презентация по Химии "Патофизиология аритмий сердца ПАТОФИЗИОЛОГИЯ АРИТМИЙ СЕРДЦА" - скачать смотреть бесплатно Дизельное топливо
Дизельное топливо Гидролиз солей
Гидролиз солей Дисперсные системы
Дисперсные системы Синтетические лекарственные препараты
Синтетические лекарственные препараты Неорганическое композиционное антикоррозионное покрытие для защиты стальных деталей и особенности его формирования
Неорганическое композиционное антикоррозионное покрытие для защиты стальных деталей и особенности его формирования Образовательная программа дополнительного образования «Химия в центре наук»
Образовательная программа дополнительного образования «Химия в центре наук» Configuratia electronica. Sistemul periodic al elementelor. (Curs 3)
Configuratia electronica. Sistemul periodic al elementelor. (Curs 3) Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Дюралюминий. Дюраль
Дюралюминий. Дюраль Роль металлов в истории человеческой цивилизации
Роль металлов в истории человеческой цивилизации Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Кремний – бог неорганической природы
Кремний – бог неорганической природы Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н.
Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н. Металлы и их соединения
Металлы и их соединения Биогеохимиялық шет аймақтар туралы түсінік
Биогеохимиялық шет аймақтар туралы түсінік Аминокислоты Модели молекул
Аминокислоты Модели молекул Органическая химия
Органическая химия Обмен нуклеотидов. Матричные биосинтезы
Обмен нуклеотидов. Матричные биосинтезы Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Химические волокна. Свойства и технология производства
Химические волокна. Свойства и технология производства Чистые вещества и смеси Способы разделения смесей Цели: 1. Выяснить какое вещество считают чистым. 2. Что такое смесь? Какие бы
Чистые вещества и смеси Способы разделения смесей Цели: 1. Выяснить какое вещество считают чистым. 2. Что такое смесь? Какие бы Минеральные удобрения
Минеральные удобрения