Содержание
- 2. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического
- 3. На катоде происходит процесс восстановления Мn+ + nē = М0 Электролиз в расплавах На аноде происходит
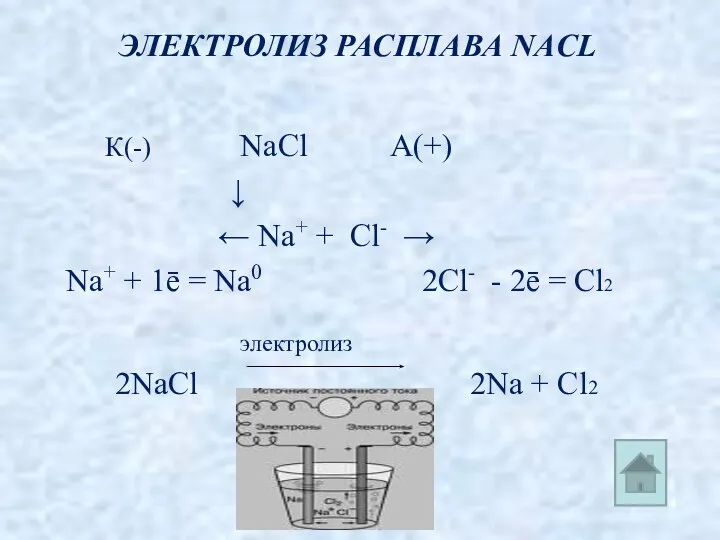
- 4. ЭЛЕКТРОЛИЗ РАСПЛАВА NАCL К(-) NaCl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē =
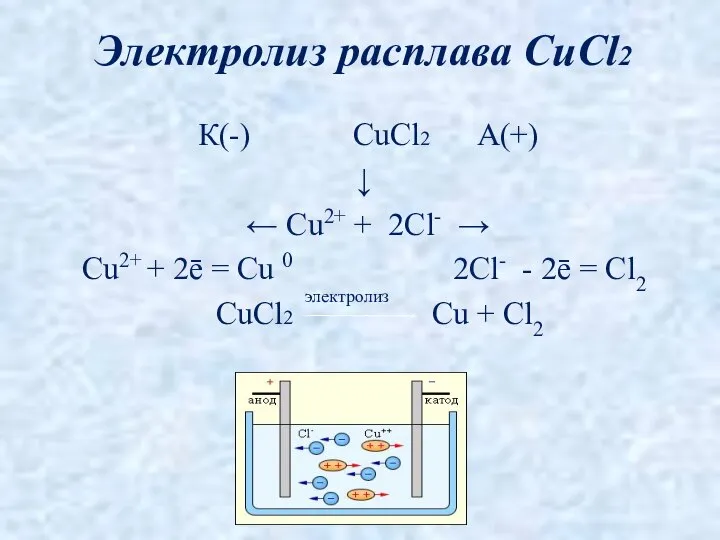
- 5. К(-) CuCl2 А(+) ↓ ← Cu2+ + 2Cl- → Cu2+ + 2ē = Cu 0 2Cl-
- 6. Катодные процессы в водных растворах электролитов
- 7. ПРОЦЕСС НА АНОДЕ В растворах процесс на аноде зависит от материала анода и от природы аниона.
- 8. Анодные процессы в водных растворах электролитов
- 9. Изменение восстановительной активности анионов Анионы по их способности окисляться располагаются в следующем порядке: I-, Br-, S2-,
- 10. Электролиз раствора поваренной соли
- 11. Электролиз раствора хлорида меди (II) CuCl2 (-)Катод Cu2+ + 2Cl- Анод(+) восстановление: окисление: Cu2+ +2е- =
- 12. Схема электролиза раствора сульфата меди (II) CuSO4 (-)Катод Cu2+ + SO42- Анод(+) восстановление окисление ионов меди:
- 13. Электролиз раствора иодида калия KI (-)Катод K+ + I- Анод(+) Восстановление KOH окисление анионов молекул воды:
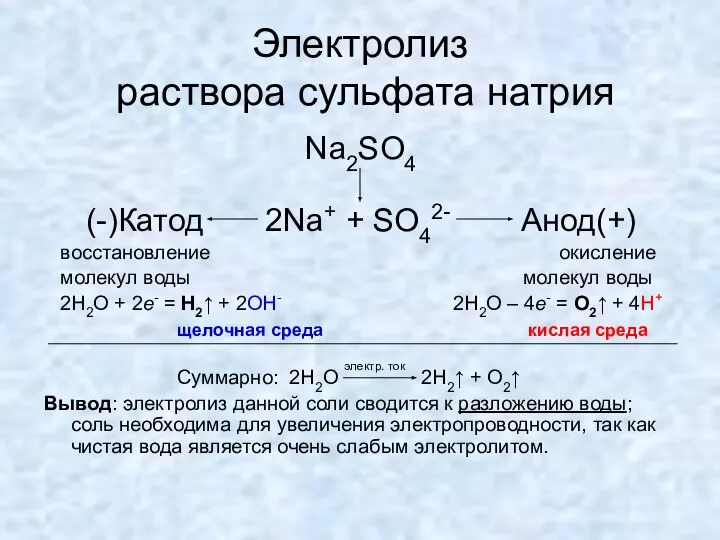
- 14. Электролиз раствора сульфата натрия Na2SO4 (-)Катод 2Na+ + SO42- Анод(+) восстановление окисление молекул воды молекул воды
- 15. Применение электролиза Электрометаллургия: а) получение активных металлов (K, Na, Ca, Mg, Al и др.) электролизом расплавов
- 16. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА: получение чистых металлов (Алюминий, магний, натрий, кадмий получают только электролизом)
- 17. ПОЛУЧЕНИЕ ЩЕЛОЧЕЙ, ХЛОРА, ВОДОРОДА
- 18. ОЧИСТКА МЕТАЛЛОВ
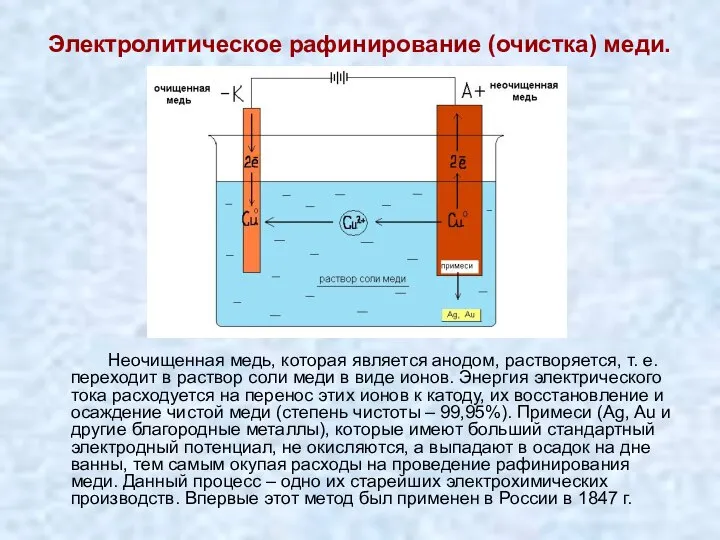
- 19. Электролитическое рафинирование (очистка) меди. Неочищенная медь, которая является анодом, растворяется, т. е. переходит в раствор соли
- 20. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ (ПРИ ЭТОМ НА ПОВЕРХНОСТИ МЕТАЛЛИЧЕСКИХ ИЗДЕЛИЙ ЭЛЕКТРОХИМИЧЕСКИМ МЕТОДОМ НАНОСЯТ ТОНКИЙ СЛОЙ ДРУГОГО
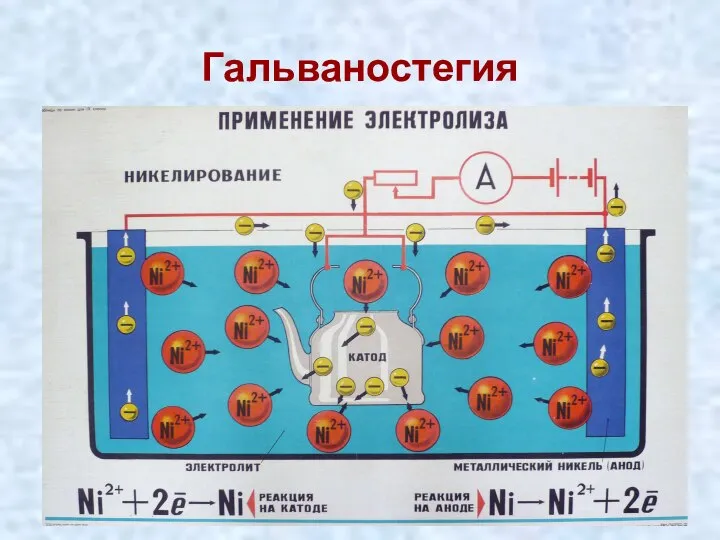
- 21. Гальваностегия
- 22. КОПИРОВАНИЕ РЕЛЬЕФНЫХ ИЗДЕЛИЙ ИЗ МЕТАЛЛОВ И ДРУГИХ МАТЕРИАЛОВ. ГАЛЬВАНОПЛАСТИКА ПОЗВОЛЯЕТ СОЗДАВАТЬ ДОКУМЕНТАЛЬНО ТОЧНЫЕ КОПИИ БАРЕЛЬЕФОВ, МОНЕТ,
- 23. Итоговое тестирование 1. Расплав какого вещества подвержен электролизу? а – оксид кальция б – парафин в
- 25. Скачать презентацию

















 Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов
Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов «РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА
«РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА Белки, протеины, полипептиды
Белки, протеины, полипептиды Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочко
Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочко Углеводы. Сукралоза
Углеводы. Сукралоза Кремний
Кремний Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21) Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Кремний и его соединения
Кремний и его соединения Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Химия и физика полимеров. Курс лекций
Химия и физика полимеров. Курс лекций Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа
Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа Состояние и свойства воды
Состояние и свойства воды Лекция №4. Строение металлических сплавов
Лекция №4. Строение металлических сплавов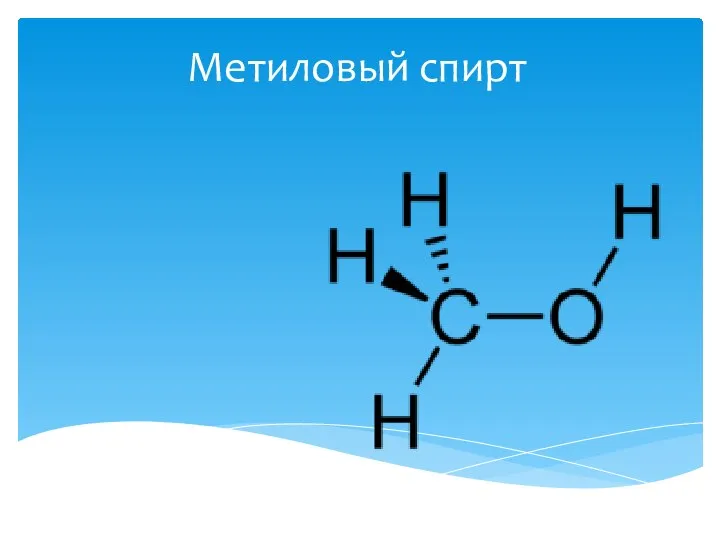 Метиловый спирт
Метиловый спирт Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно
Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно Пневматолито-гидротермальный процесс
Пневматолито-гидротермальный процесс Строение и свойства материалов
Строение и свойства материалов Азот в природе
Азот в природе Обменный и донорно-акцепторный механизм образования связи
Обменный и донорно-акцепторный механизм образования связи Кислоты: классификация, реакции, применение
Кислоты: классификация, реакции, применение Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Нуклеиновые кислоты
Нуклеиновые кислоты Эксперимент. Выращивание солевых кристаллов
Эксперимент. Выращивание солевых кристаллов Оксид серы IV. Сернистая кислота
Оксид серы IV. Сернистая кислота Липиды. Составные части липидов
Липиды. Составные части липидов Радиофармацевтическая химия
Радиофармацевтическая химия