Содержание
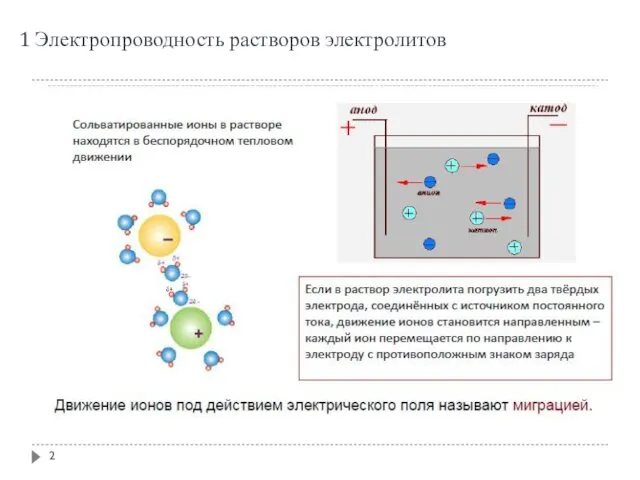
- 2. 1 Электропроводность растворов электролитов
- 3. 1 Электропроводность растворов электролитов Факторы, влияющие на скорость движения иона в электрическом поле Размер иона: чем
- 4. 1 Электропроводность растворов электролитов Скорость движения иона в электрическом поле Отношение скорости иона к напряженности электрического
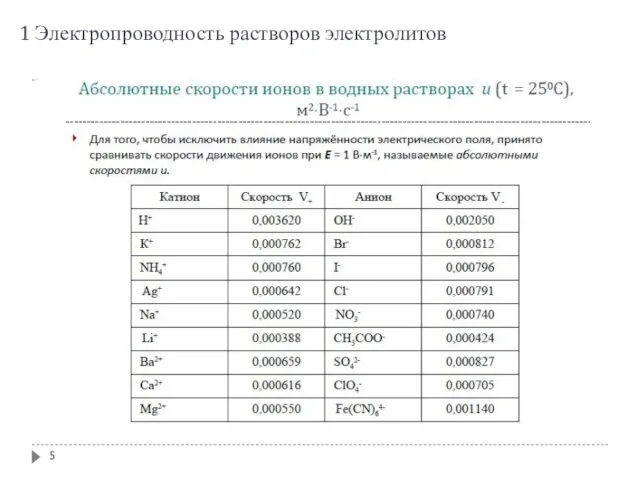
- 5. 1 Электропроводность растворов электролитов
- 6. 1 Электропроводность растворов электролитов Электропроводность растворов электролитов Мерой способности раствора электролита проводить электрический ток является комплексная
- 7. Удельная электропроводность - проводимость единицы объема раствора, обратно пропорциональна удельному сопротивлению Удельная электропроводность (κ, χ) раствора
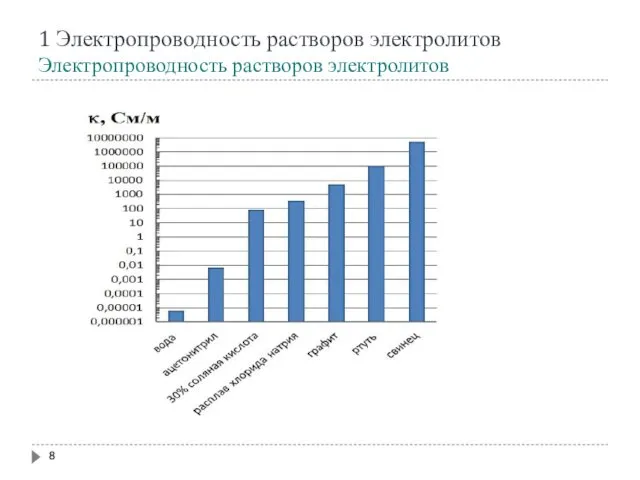
- 8. 1 Электропроводность растворов электролитов Электропроводность растворов электролитов
- 9. 1 Электропроводность растворов электролитов Кондуктометрическая ячейка Для определения удельной электропроводности необходимо знать площадь электродов и расстояние
- 10. 1 Электропроводность растворов электролитов Электропроводность растворов электролитов Удельная электропроводность зависит от: природы электролита и растворителя концентрации
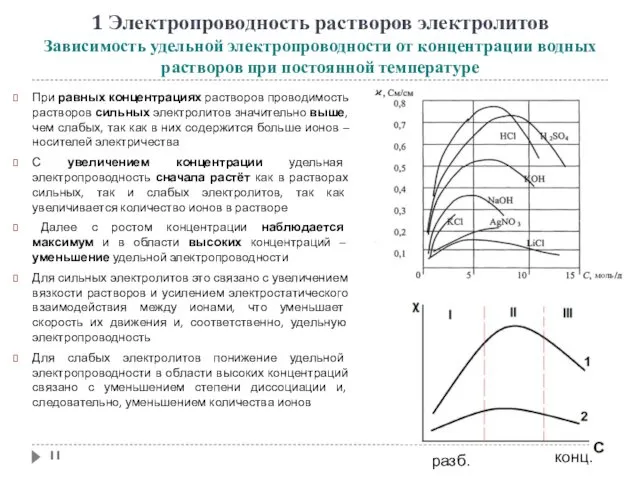
- 11. 1 Электропроводность растворов электролитов Зависимость удельной электропроводности от концентрации водных растворов при постоянной температуре При равных
- 12. 1 Электропроводность растворов электролитов Зависимость удельной электропроводности от температуры При повышении температуры удельная электропроводность растворов электролитов
- 13. 1 Электропроводность растворов электролитов Эквивалентная электропроводность λэ
- 14. 1 Электропроводность растворов электролитов Молярная электропроводность Молярная электропроводность λ (лямбда) или μ (мю)– это проводимость раствора,
- 15. 1 Электропроводность растворов электролитов Молярная электропроводность
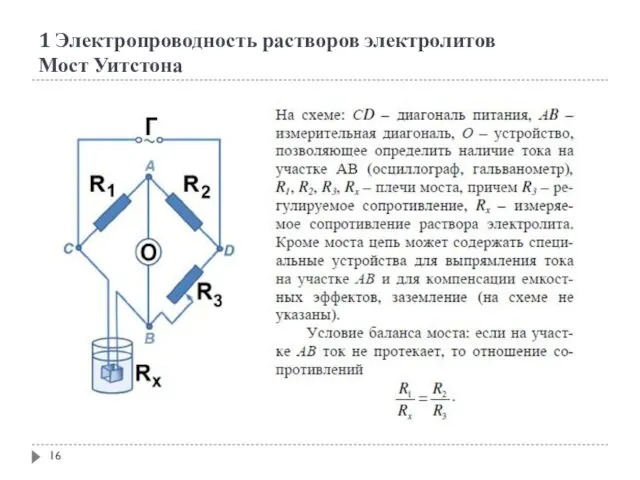
- 16. 1 Электропроводность растворов электролитов Мост Уитстона
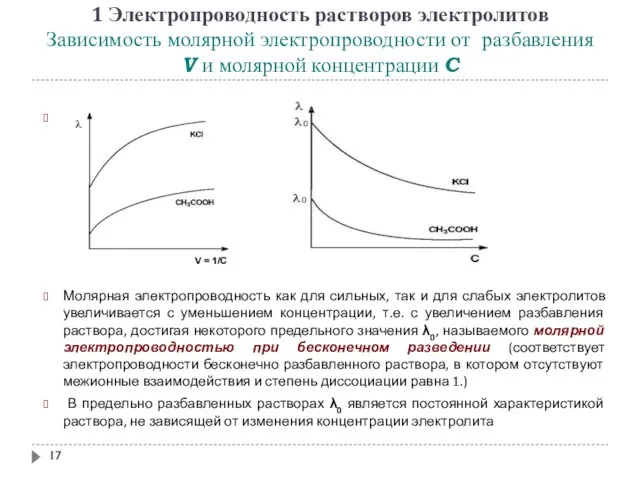
- 17. 1 Электропроводность растворов электролитов Зависимость молярной электропроводности от разбавления V и молярной концентрации C Молярная электропроводность
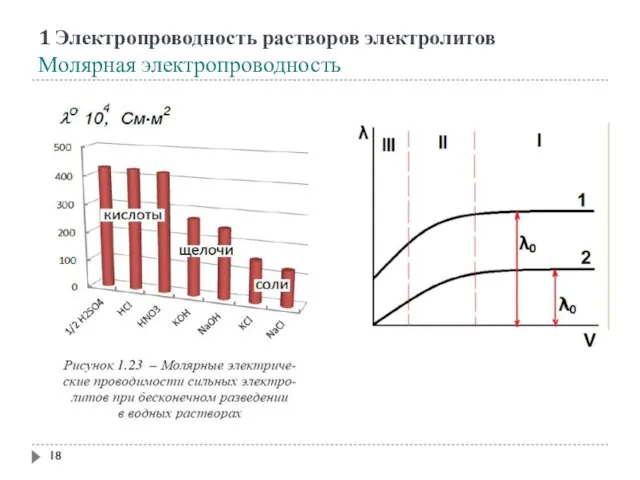
- 18. 1 Электропроводность растворов электролитов Молярная электропроводность
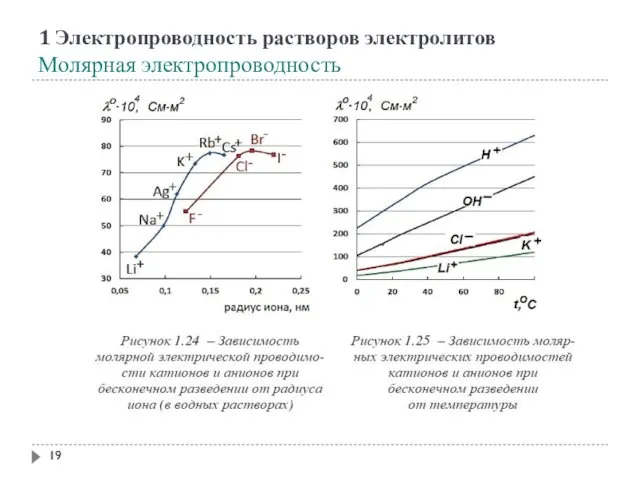
- 19. 1 Электропроводность растворов электролитов Молярная электропроводность
- 20. 1 Электропроводность растворов электролитов
- 21. 1 Электропроводность растворов электролитов
- 22. 1 Электропроводность растворов электролитов
- 23. 1 Электропроводность растворов электролитов Закон Кольрауша
- 24. 1 Электропроводность растворов электролитов Молярная электропроводимость сильных электролитов Закон Кольрауша для разбавленных растворов сильных электролитов А
- 25. 1 Электропроводность растворов электролитов Молярная электропроводимость слабых электролитов Молярная проводимость слабых электролитов значительно меньше, чем для
- 26. 1 Электропроводность растворов электролитов Молярная электропроводимость слабых электролитов
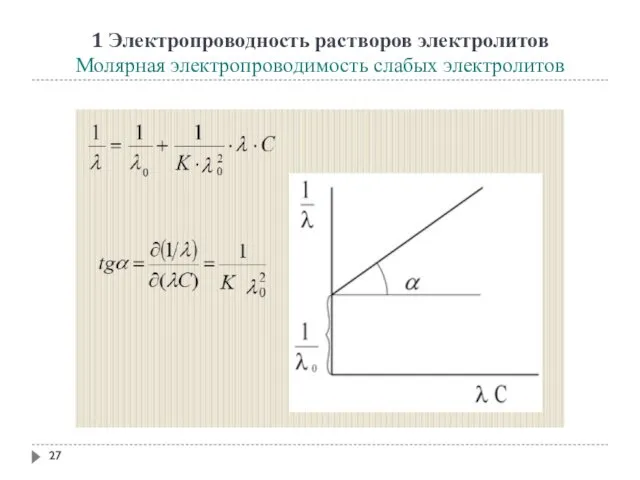
- 27. 1 Электропроводность растворов электролитов Молярная электропроводимость слабых электролитов
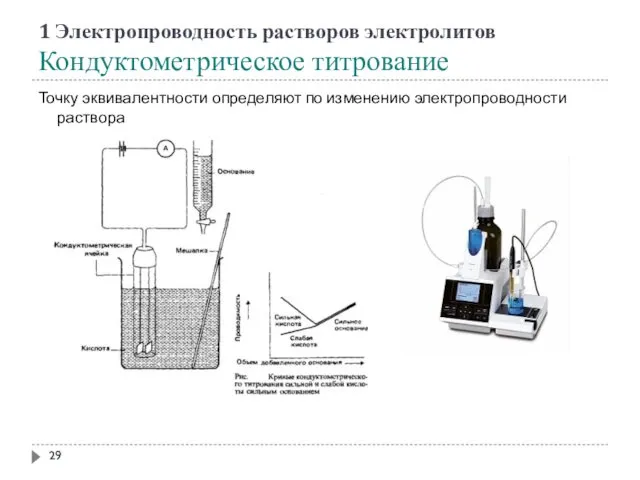
- 29. 1 Электропроводность растворов электролитов Кондуктометрическое титрование Точку эквивалентности определяют по изменению электропроводности раствора
- 30. 1 Электропроводность растворов электролитов Кондуктометрическое титрование
- 31. 2 Числа переноса ионов
- 32. 2 Числа переноса ионов
- 33. 2 Числа переноса ионов
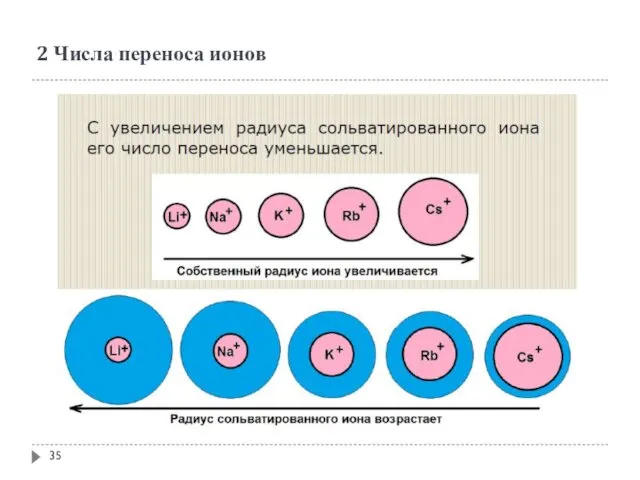
- 34. 2 Числа переноса ионов
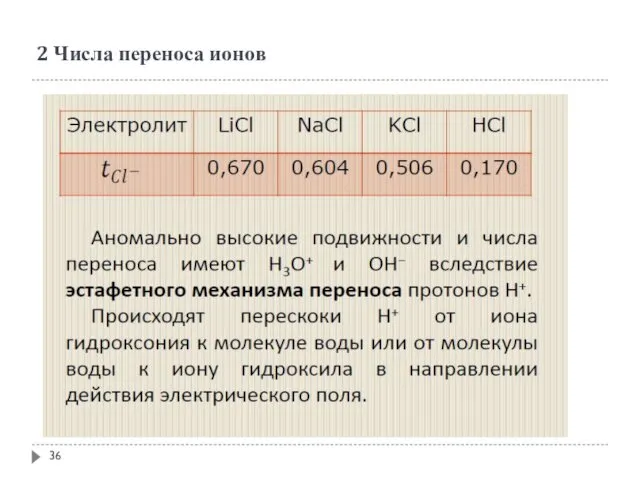
- 35. 2 Числа переноса ионов
- 36. 2 Числа переноса ионов
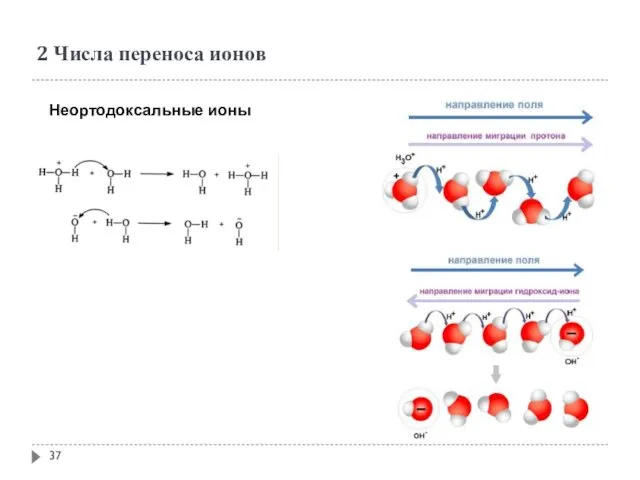
- 37. 2 Числа переноса ионов Неортодоксальные ионы
- 38. 2 Числа переноса ионов
- 39. 2 Числа переноса ионов
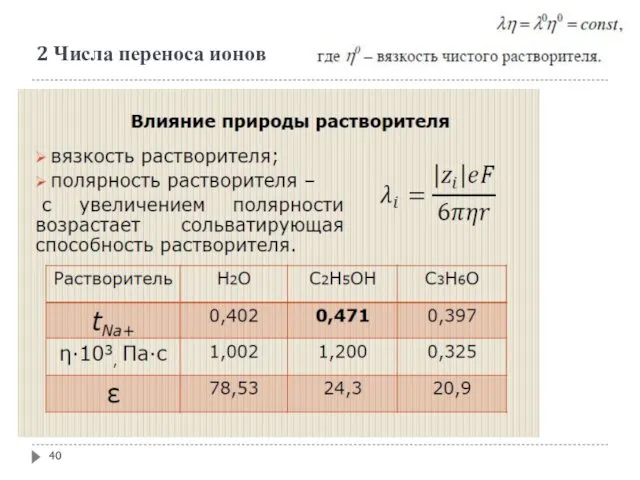
- 40. 2 Числа переноса ионов
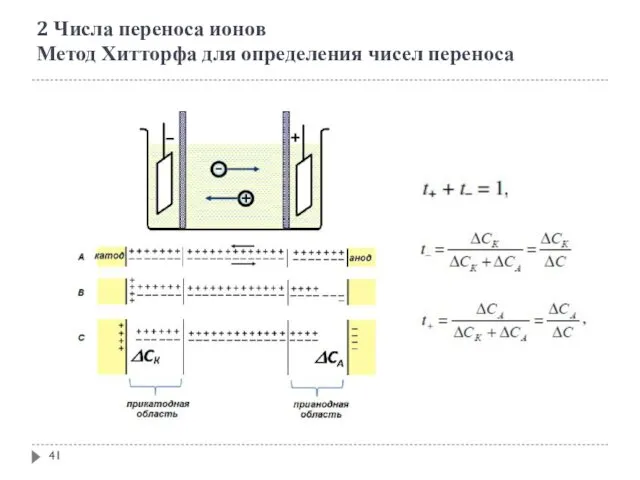
- 41. 2 Числа переноса ионов Метод Хитторфа для определения чисел переноса
- 42. 3 Полиэлектролиты
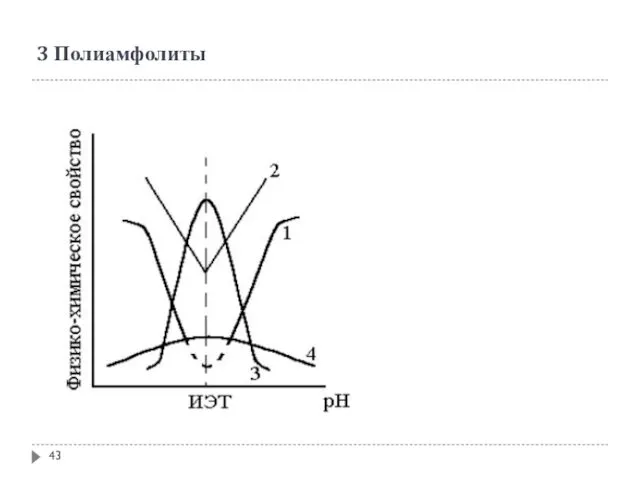
- 43. 3 Полиамфолиты
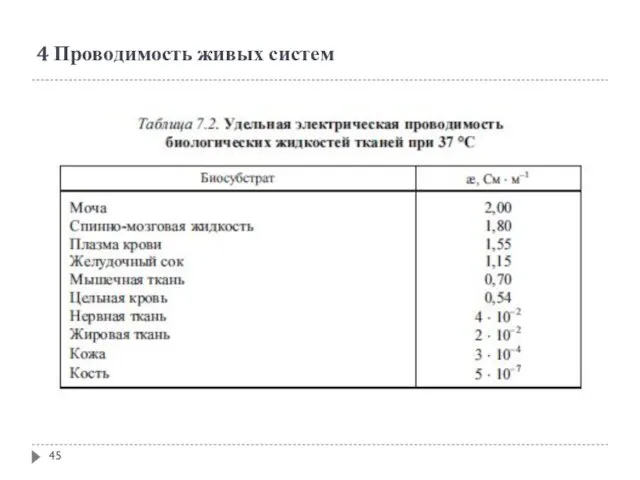
- 44. 4 Проводимость живых систем
- 45. 4 Проводимость живых систем
- 47. Скачать презентацию



























 Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Оксиды углерода
Оксиды углерода Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно
Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно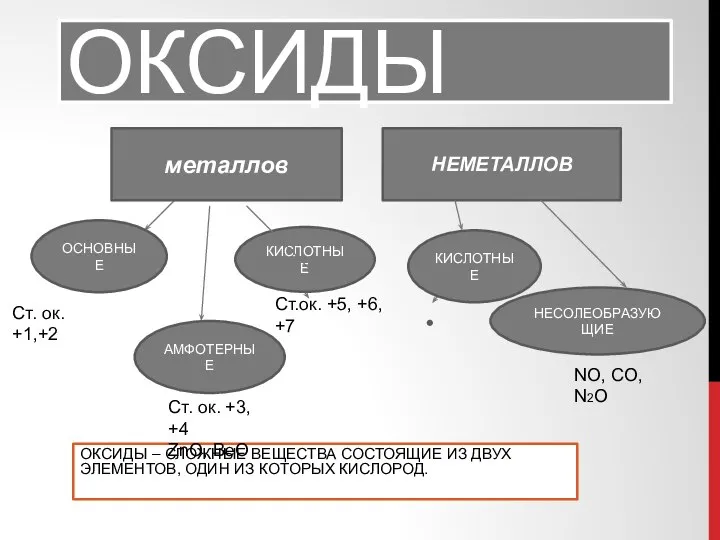 Оксиды
Оксиды Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы Гормоны гипофиза. (Лекция 12)
Гормоны гипофиза. (Лекция 12) Пластмасса
Пластмасса Химия и стирка
Химия и стирка 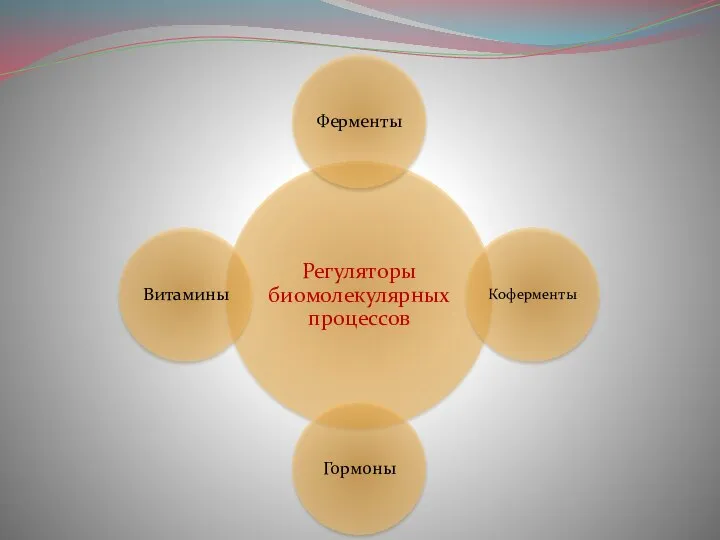 Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть
Презентация по Химии "Регуляторы биомолекулярных процессов" - скачать смотреть  Основы органической химии
Основы органической химии Атом – сложная частица
Атом – сложная частица Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов
Роль воды в жизнедеятельности организма. Теория растворов электролитов и неэлектролитов коллигативные свойства растворов Химические свойства оксидов
Химические свойства оксидов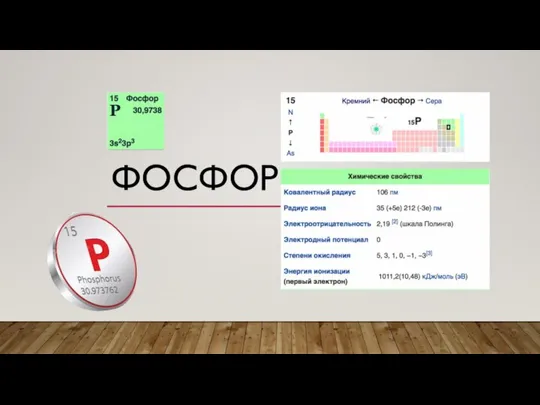 Фосфор. Функции фосфора в организме
Фосфор. Функции фосфора в организме Corrosion
Corrosion 11 хб
11 хб  Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Биогенные s-элементы
Биогенные s-элементы Исследование спектральных и люминесцентных свойств боратных стекол с добавлением висмута
Исследование спектральных и люминесцентных свойств боратных стекол с добавлением висмута Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн
Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева
Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева Углеводороды – самые простые органические соединения
Углеводороды – самые простые органические соединения Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Ионное произведение воды. Понятие о рН раствора
Ионное произведение воды. Понятие о рН раствора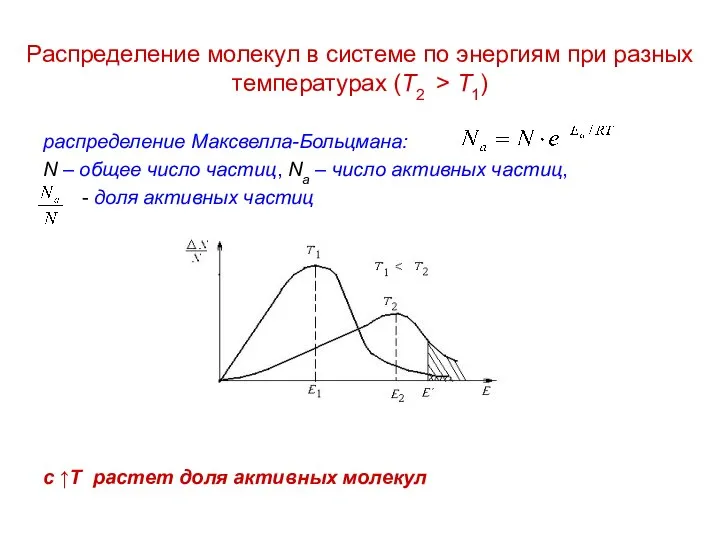 Распределение молекул в системе по энергиям при разных температурах
Распределение молекул в системе по энергиям при разных температурах