Содержание
- 2. Основные минералы боксит Al2O3·H2O каолинит Al2O3·2SiO2·2H2O алунит (Na,K)2SO4·Al2(SO4)3·4Al(OH)3 корунд Al2O3
- 3. Получение электролитическое восстановление
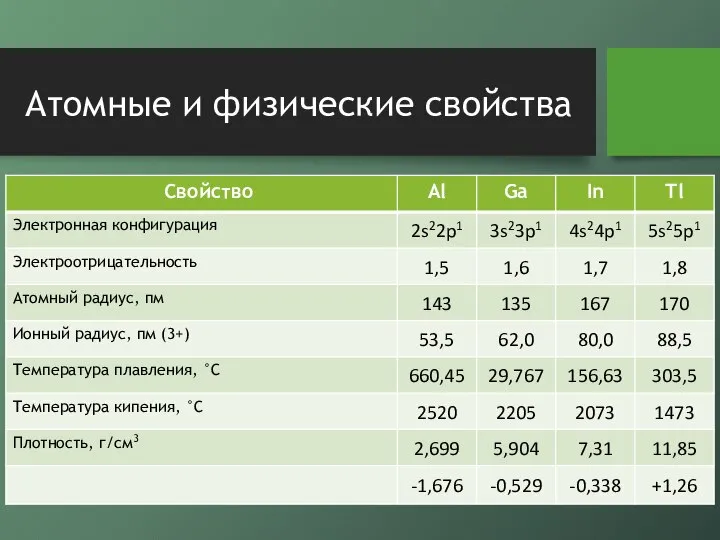
- 4. Атомные и физические свойства
- 5. Алюминий устойчив к коррозии благодаря образованию прочной тонкой оксидной пленки после удаления пленки медленно реагирует с
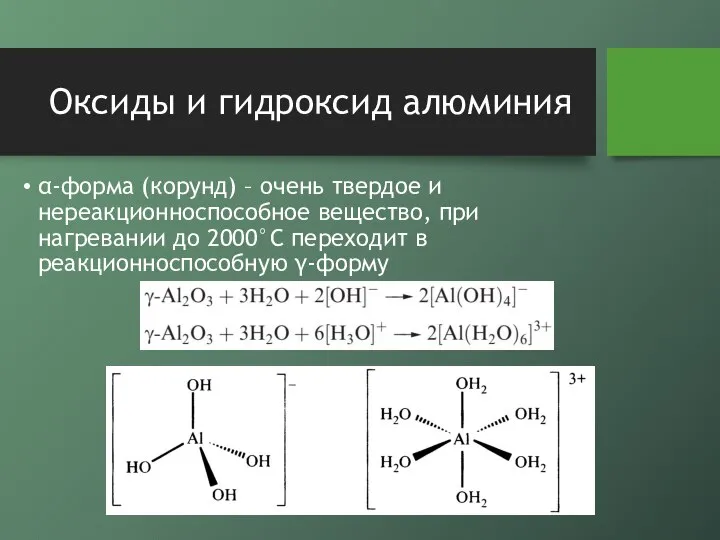
- 6. Оксиды и гидроксид алюминия α-форма (корунд) – очень твердое и нереакционноспособное вещество, при нагревании до 2000°С
- 7. Оксиды и гидроксид алюминия имелись сведения о получении β-формы, но на самом деле она представляет собой
- 8. Алюминаты β-алюминат натрия (NaAl11O17) является твердым электролитом, обладая высокой ионной проводимостью другие алюминаты (например, NaAlO2) используют
- 9. Галогениды алюминия моногалогениды получаются при реакции тригалогенидов с алюминием при 1000°С в виде двухатомных короткоживущих структур
- 10. Галогениды алюминия безводные галогениды нельзя получить дегидратацией солей из-за присутствия устойчивых катионов [Al(OH2)6]3+ хлорид алюминия димерен
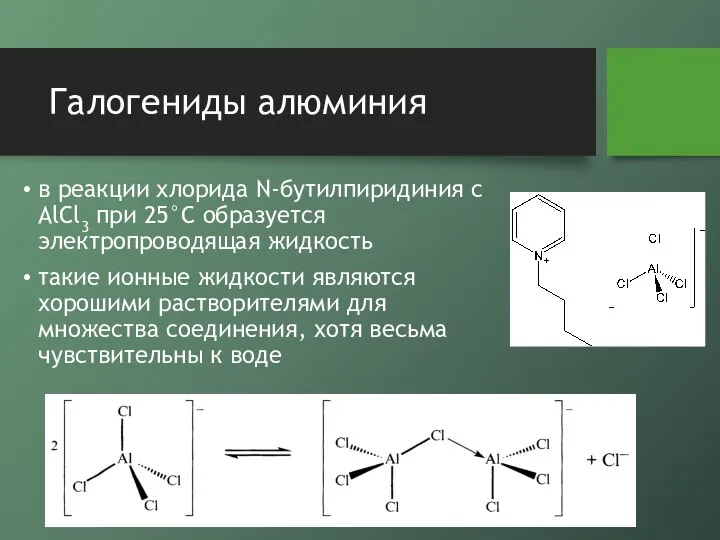
- 11. Галогениды алюминия в реакции хлорида N-бутилпиридиния с AlCl3 при 25°С образуется электропроводящая жидкость такие ионные жидкости
- 12. Галлий, индий, таллий мягкие серебристые, сравнительно реакционноспособные металлы, легко растворяющиеся в кислотах (кроме таллия) жидкий галлий
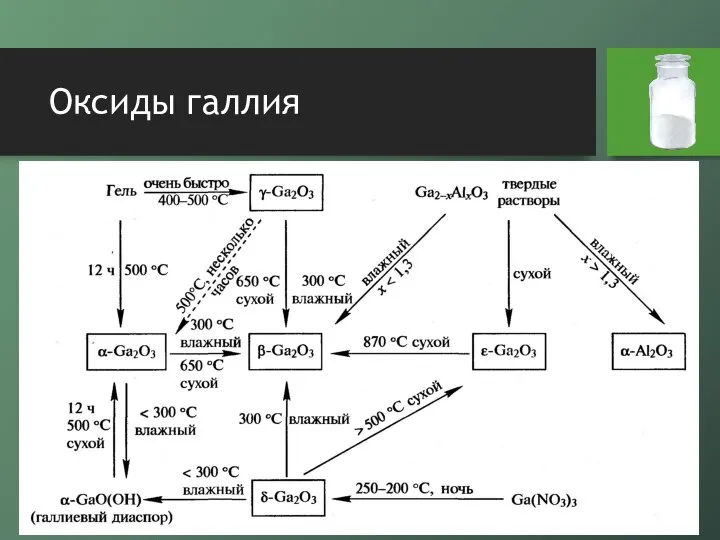
- 13. Оксиды галлия
- 14. Оксиды галлия оксид галлия (I) относительно стабилен, представляет собой темно-коричневый диамагнитный порошок он получается при нагревании
- 15. Гидроксид галлия, галлаты по свойствам очень похож на гидроксид алюминия при нагревании оксида галлия с оксидами
- 16. Галогениды галлия (III) фторид получают из других галогенидов или разложением (NH4)3[GaF6] или [GaF3(NH3)3] в отсутствие влаги
- 17. Галогениды галлия (III) бесцветные кристаллические гигроскопичные вещества в твердом и жидком состояниях димерны кислоты Льюиса, образуют
- 18. Галогениды галлия (I) и (II) известны все 4 галогенида GaX образуются при термическом разложении тригалогенидов при
- 19. Оксиды индия существует 2 оксида индия трехвалентный оксид получается при сгорании индия на воздухе (фиол. пламя)
- 20. Гидроксид индия получается в виде желеобразного осадка из растворов солей In3+ плохо растворяется в воде и
- 21. Галогениды индия (III) легко получаются при растворении металла в кислотах безводные фторид и хлорид (б/цв.) получают
- 22. Соединения индия (I) и (II) In+ можно получить при реакции амальгамы индия с трифлатом серебра в
- 23. Оксиды и гидроксиды таллия известно 2 оксида Tl2O (черный) и Tl2O3 (темно-коричневый) Tl2O образуется при разложении
- 24. Оксиды и гидроксиды таллия оксид таллия (III) проявляет окислительные свойства гидроксид таллия (III) получается в виде
- 25. Галогениды таллия (I) известны все 4 галогенида похожи на галогениды серебра (восприимчивы к свету) при добавлении
- 26. Галогениды таллия (III) известны 3 нестабильных галогенида Tl3+ сильно гидролизуется трифторид получают фторированием Tl2O3 фтором, трифторидом
- 27. Токсичность соединений таллия замещает калий в биохимических процессах летальная доза лежит в пределах 10-50 мг/кг НО
- 28. Диаграммы Латимера
- 29. Применение
- 30. Применение
- 32. Скачать презентацию










![Галогениды галлия (III) фторид получают из других галогенидов или разложением (NH4)3[GaF6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1336201/slide-15.jpg)














 Нуклеофилы и электрофилы. Лекция 2
Нуклеофилы и электрофилы. Лекция 2 «Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т
«Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т Необычные минералы
Необычные минералы Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз Строение, свойства и многообразие функций белков
Строение, свойства и многообразие функций белков Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Засоби побутової хімії – небезпечні джерела шкідливих для здоров’я людини речовин.
Засоби побутової хімії – небезпечні джерела шкідливих для здоров’я людини речовин.  Воздух, его состав и значение
Воздух, его состав и значение Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации
Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации Титан и его сплавы
Титан и его сплавы Полимеризация циклов. Сополимеризация
Полимеризация циклов. Сополимеризация Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды
Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды Строение вещества
Строение вещества Składniki odżywcze
Składniki odżywcze Аллотропные модификации. Углерод
Аллотропные модификации. Углерод Презентация по Химии "Растворимость веществ в воде" - скачать смотреть
Презентация по Химии "Растворимость веществ в воде" - скачать смотреть  Растворы ВМС
Растворы ВМС Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева
Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Классификация методов аналитической химии
Классификация методов аналитической химии Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Кремний. Химические свойства
Кремний. Химические свойства Важнейшие классы бинарных соединений. Оксиды, гидриды и летучие водородные соединения
Важнейшие классы бинарных соединений. Оксиды, гидриды и летучие водородные соединения КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс
КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс  Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Важнейшие химические понятия и законы
Важнейшие химические понятия и законы