Содержание
- 2. 3. Установление критериев равновесного состояния термодинамических систем. Задачи химической термодинамики: 1 Установление энергетических эффектов химических и
- 3. Терминология химической термодинамики: Термодинамическая система – Изолированные системы - Закрытые системы - Открытые системы -
- 4. Гомогенные и гетерогенные системы. Гетерогенные системы – Пример: - Zn (тв.) + HCl (ж) → ZnCl2
- 5. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ СИСТЕМЫ (ТПСС) 2. Функции состояния : внутренняя энергия (U), U = Eкин. +
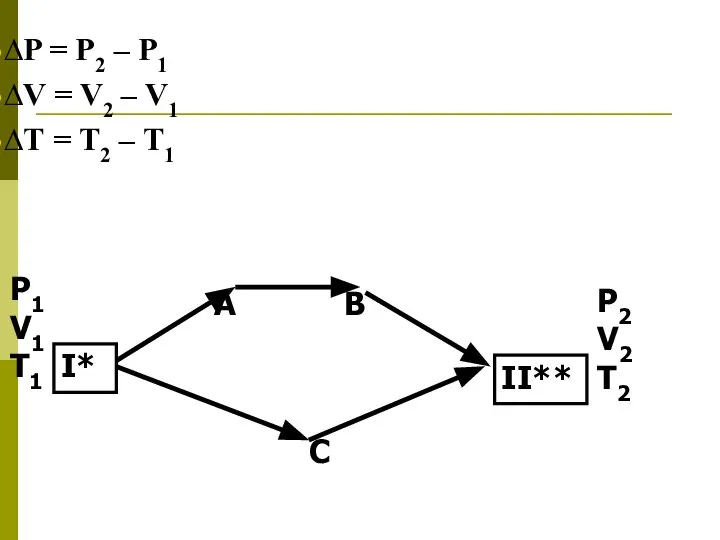
- 6. P1 V1 T1 P2 V2 T2 I* A B II** C ∆P = P2 – P1
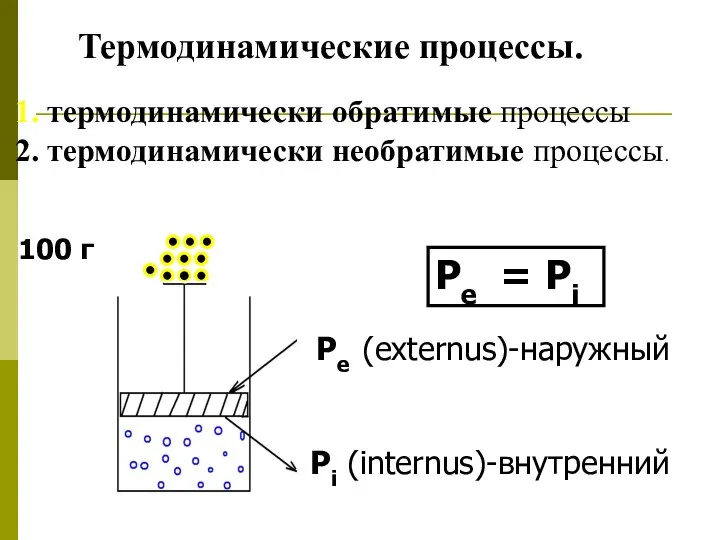
- 7. Pe (externus)-наружный Pi (internus)-внутренний Pe = Pi 100 г Термодинамические процессы. 1. термодинамически обратимые процессы 2.
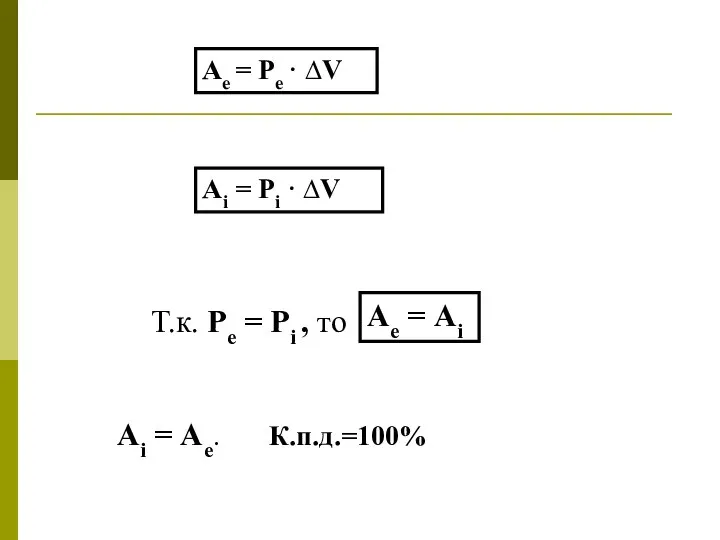
- 8. Аi = Рi · ∆V Т.к. Ре = Рi , то Ае = Ре · ∆V
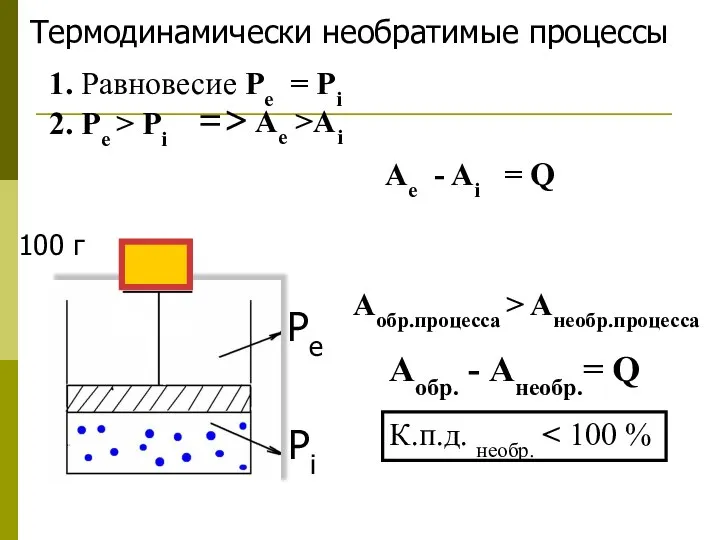
- 9. Термодинамически необратимые процессы Pe Pi 1. Равновесие Pe = Pi 2. Ре > Рi => Ae
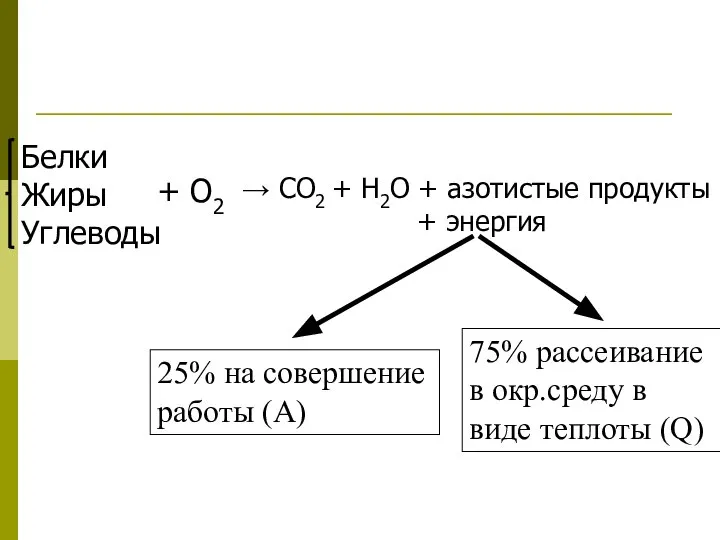
- 10. → СО2 + Н2О + азотистые продукты + энергия Белки Жиры Углеводы + О2 25% на
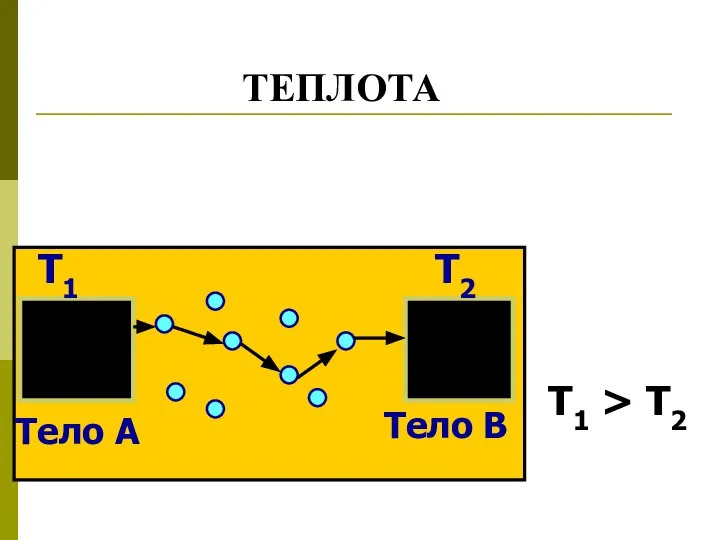
- 11. Тело А Тело В Т1 Т2 Т1 > Т2 ТЕПЛОТА
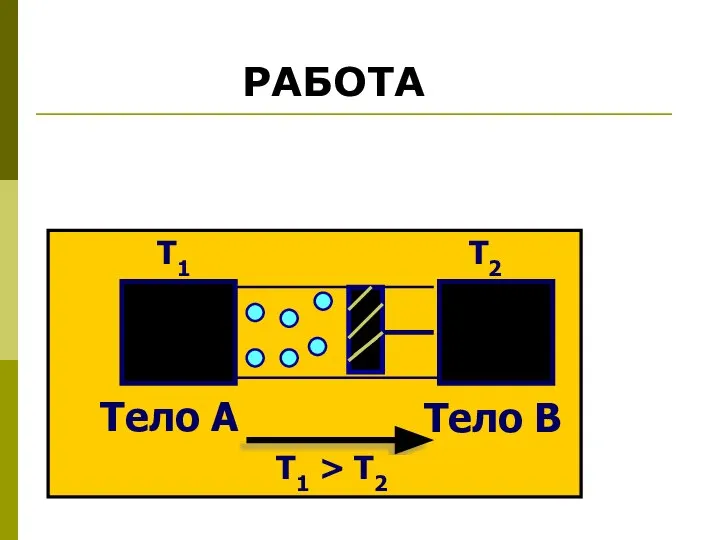
- 12. Тело А Тело B Т1 Т2 Т1 > Т2 РАБОТА
- 13. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Р.Майер (1842 г.), Д. Джоуль (1842 г.), Л. Гельмгольц (1847 г.) Q =
- 14. Применение первого закона (Q = ∆U + А) термодинамики к различным процессам. 1. Изохорные процессы. V
- 15. 2. Изобарные процессы. р =const, ∆р=0, QР = U2 – U1 + р(V2 – V1); QР
- 16. 3. Изотермические процессы. Т = const, ∆Т =0 Q=∆U + A ∆Т = 0, ∆U =
- 17. ТЕРМОХИМИЯ - Тепловой эффект реакции - Стандартный тепловой эффект - Р = 1атм; 101,3 кПа; Т=298
- 18. Термохимические уравнения - Термохимическая форма записи: Н2 (г) + ½ О2(г) → Н2О (ж) + Q;
- 19. Закон Гесса (1840 г.) ΙΙ. а) С + ½ О2 → СО ∆Н1 = - 283
- 20. С6Н12О6(тв) + 6 О2(г) →6 СО2(г) + 6 Н2О(ж); ∆Н =? ∆Нор-ции= (6∆НообрСО2 + 6∆НообрН2О) –
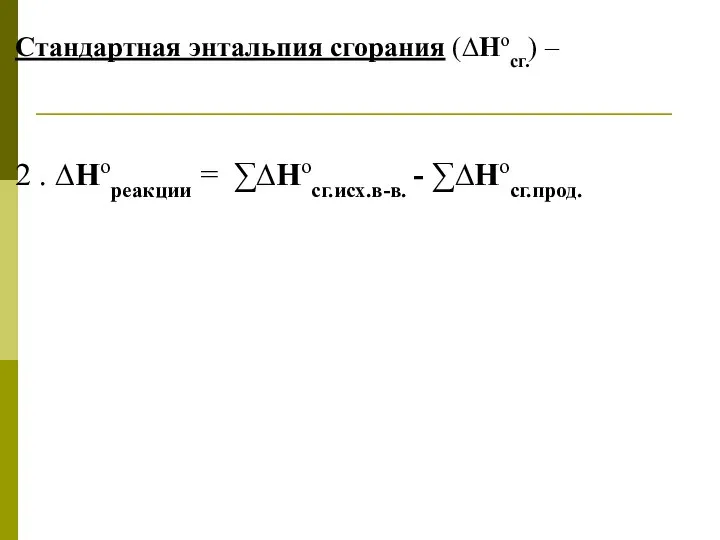
- 21. Стандартная энтальпия сгорания (∆Носг.) – 2 . ∆Нореакции = ∑∆Носг.исх.в-в. - ∑∆Носг.прод.
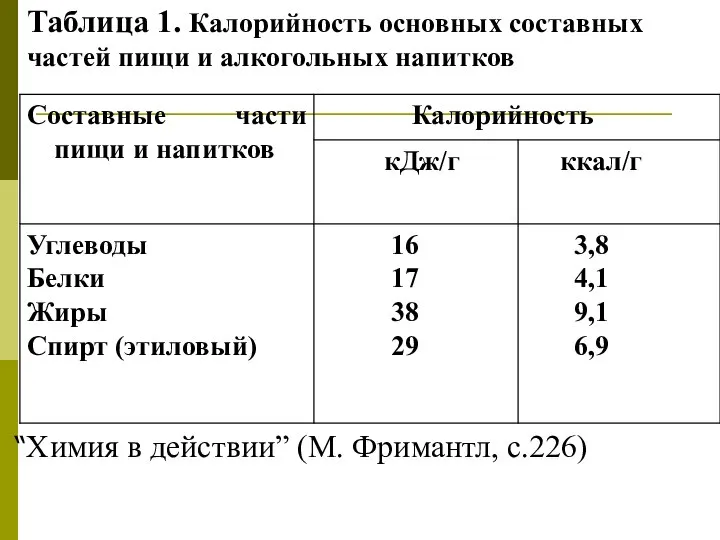
- 22. Таблица 1. Калорийность основных составных частей пищи и алкогольных напитков “Химия в действии” (М. Фримантл, с.226)
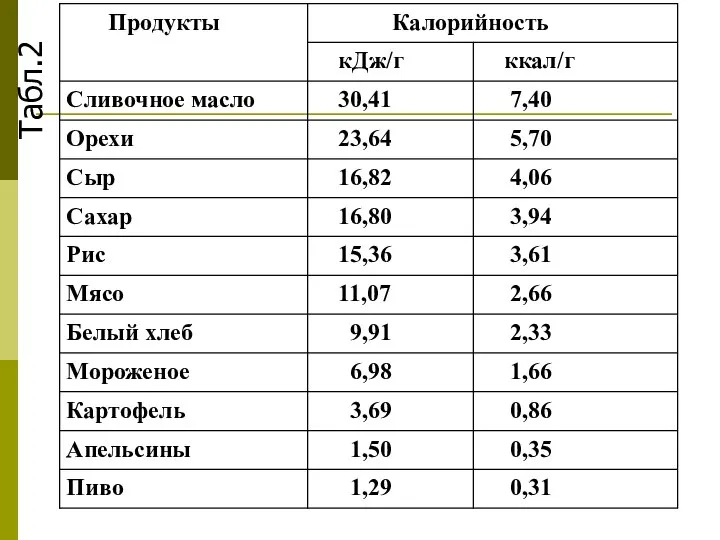
- 23. Табл.2
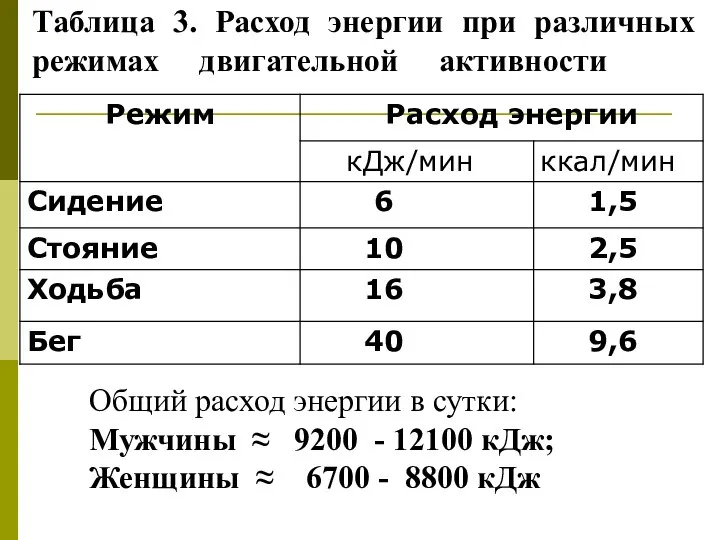
- 24. Таблица 3. Расход энергии при различных режимах двигательной активности Общий расход энергии в сутки: Мужчины ≈
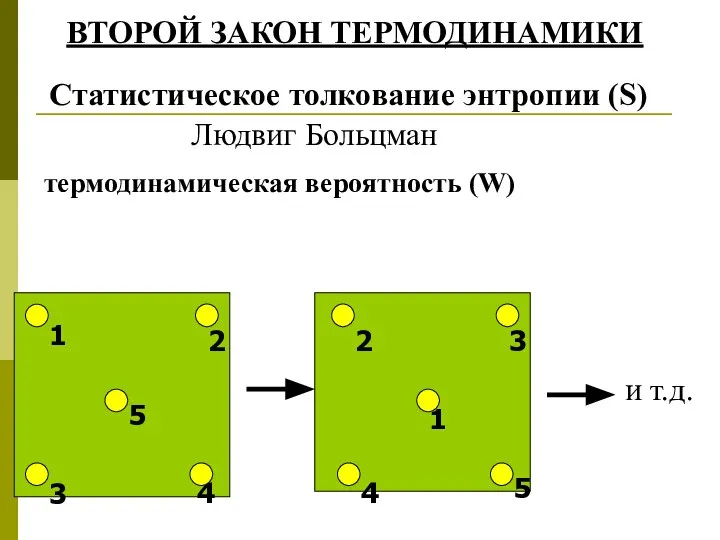
- 25. 1 2 3 4 1 3 4 2 5 5 и т.д. Статистическое толкование энтропии (S)
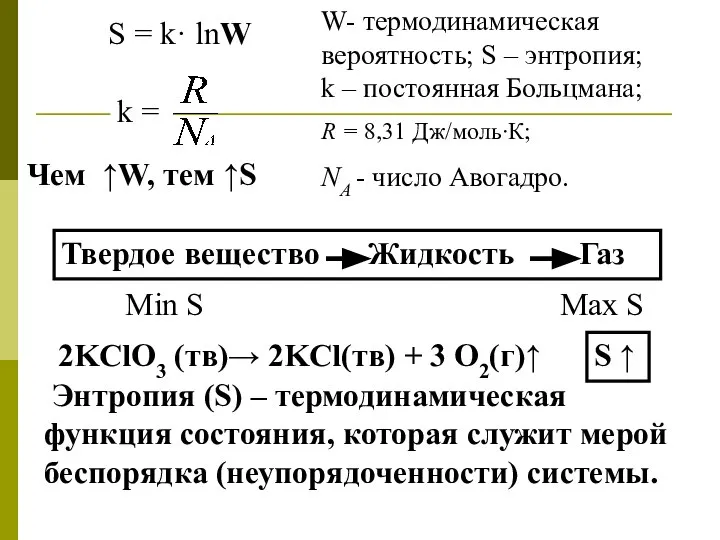
- 26. S = k· lnW W- термодинамическая вероятность; S – энтропия; k – постоянная Больцмана; R =
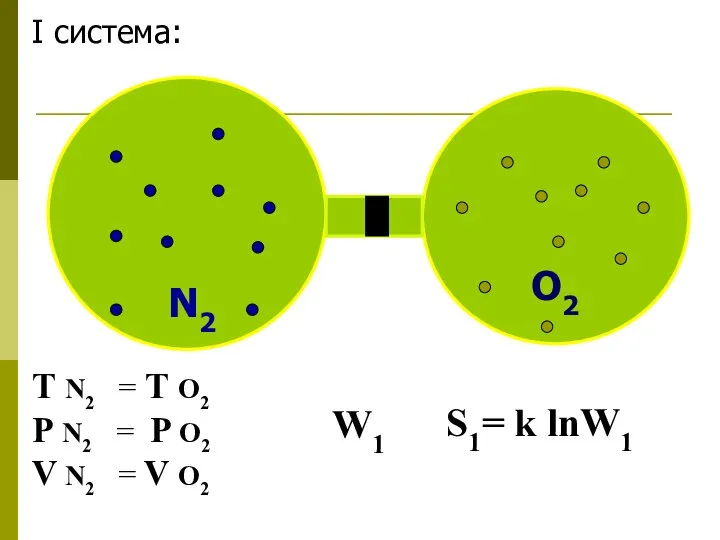
- 27. N2 O2 I система: Т N2 = Т O2 P N2 = P O2 V N2
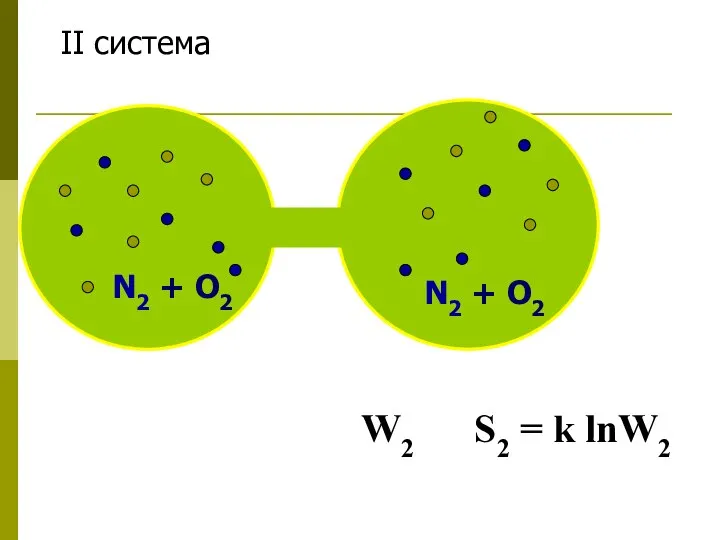
- 28. N2 + O2 N2 + O2 II система W2 S2 = k lnW2
- 29. W2 > W1 => S2 > S1 ∆S = S2 - S1 = k lnW2- k
- 30. ∆S математическое выражение второго закона термодинамики. [S]– [ Дж/ моль·К] Изолированная система: Q = 0 ∆S
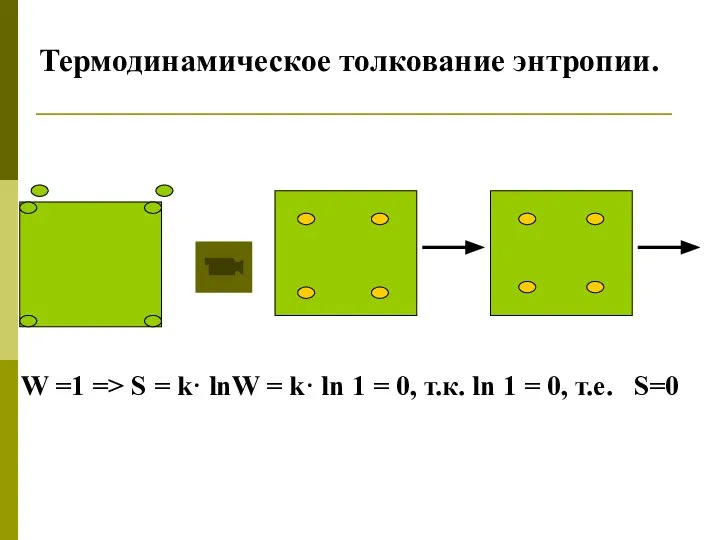
- 31. Термодинамическое толкование энтропии. W =1 => S = k· lnW = k· ln 1 = 0,
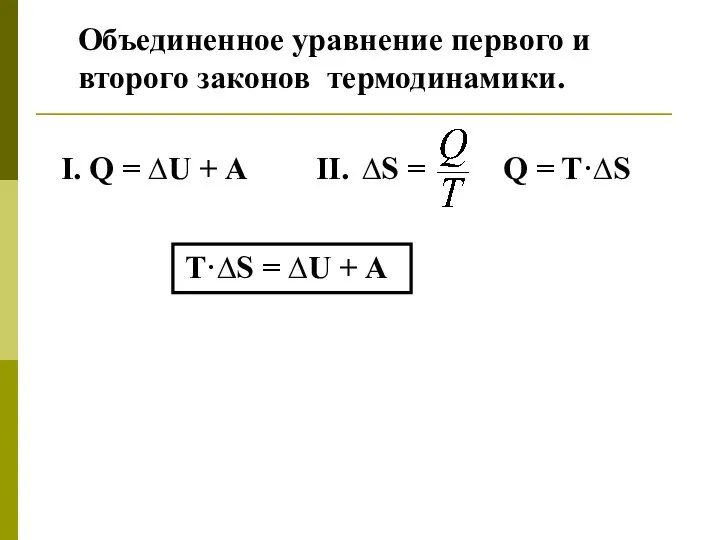
- 32. Объединенное уравнение первого и второго законов термодинамики. I. Q = ∆U + А II. ∆S =
- 33. Аобщ. = р·∆V + Аполезн. T·∆S = ∆U + А общая T·∆S = ∆U + р·∆V
- 34. 1. А>0, ∆G 2. А=0, ∆G=0 3. А 0 Влияние энтальпийного (∆Н) и энтропийного (∆S) фактора
- 35. Анализ: ∆G = ∆Н - Т∆S 1) если ∆Н 0, то ∆G 2) если ∆Н>0 (эндо-)
- 36. Расчет свободной энергии Гиббса при стандартных условиях (∆Gо) в химических реакциях. ∆Gо298 обр. - стандартная из
- 37. Расчет ∆Gреакции в реальных условиях. А + В С + D ∆G = ∆Gо + RT
- 38. Термодинамика химического равновесия. хА + уВ mC + nD V1 V2 V1 = V2 химическое равновесие.
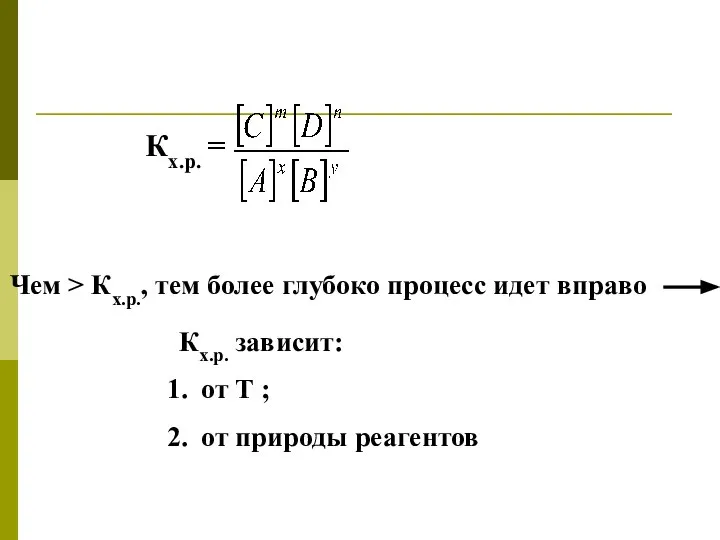
- 39. Кх.р. = Чем > Кх.р., тем более глубоко процесс идет вправо Кх.р. зависит: от Т ;
- 40. Уравнение изотермы химической реакции. А + В C + D ∆G = ∆Gо + RT ln
- 41. Анализ: ∆G = RT (ln R, T, Кх.р. - это const в уравнении, поэтому, знак ∆G
- 42. Уравнение изобары химической реакции. р=const; ∆р=0 А + В C + D ∆Gо = - RT
- 43. Анализ: 1. экзотермические реакции: ∆Н а) повышаем Т => Т2>Т1 и тогда ln >0 и К1>К2
- 45. Скачать презентацию













![∆S математическое выражение второго закона термодинамики. [S]– [ Дж/ моль·К] Изолированная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1389678/slide-29.jpg)










 Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы
Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы Ցեմենտի արտադրություն
Ցեմենտի արտադրություն Ученые – химики в годы Великой Отечественной войны
Ученые – химики в годы Великой Отечественной войны Кремний и его соединения
Кремний и его соединения Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации ЗОЛОТОЙ ВЕК ГОЛЛАНДСКОЙ ЖИВОПИСИ
ЗОЛОТОЙ ВЕК ГОЛЛАНДСКОЙ ЖИВОПИСИ  Кристаллдық және аморфтық күй
Кристаллдық және аморфтық күй Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс А.Д. Сахаров – выдающийся ученый и правозащитник современности МБОУ «Гимназия № 13», 9 «Б» класс. Выполнил: Артёмов Александр. На
А.Д. Сахаров – выдающийся ученый и правозащитник современности МБОУ «Гимназия № 13», 9 «Б» класс. Выполнил: Артёмов Александр. На Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Токсичность. Параметры токсичности
Токсичность. Параметры токсичности Электронное строение атома
Электронное строение атома Разработка технологии получения наноструктурированных катализаторов для гидрирования
Разработка технологии получения наноструктурированных катализаторов для гидрирования Синтетические моющие средства
Синтетические моющие средства Металловедение. Основные типы диаграмм состояния двойных сплавов. (Лекция 4)
Металловедение. Основные типы диаграмм состояния двойных сплавов. (Лекция 4) Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Щелочноземельные металлы
Щелочноземельные металлы Галогены: Хлор, бром, иод
Галогены: Хлор, бром, иод Путешествие по континенту Химия. Познавательная игра по химии, 8 класс
Путешествие по континенту Химия. Познавательная игра по химии, 8 класс Эластомеры (резины)
Эластомеры (резины) Презентация по Химии "«Щелочные металлы»" - скачать смотреть
Презентация по Химии "«Щелочные металлы»" - скачать смотреть  Химиялық элемент алюминий
Химиялық элемент алюминий Строение атома. Атомные орбитали. Типы связей. Основные органогенные элементы, их роль
Строение атома. Атомные орбитали. Типы связей. Основные органогенные элементы, их роль Аминокислоты и белки
Аминокислоты и белки λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Галогены - друзья или враги?
Галогены - друзья или враги?