Содержание
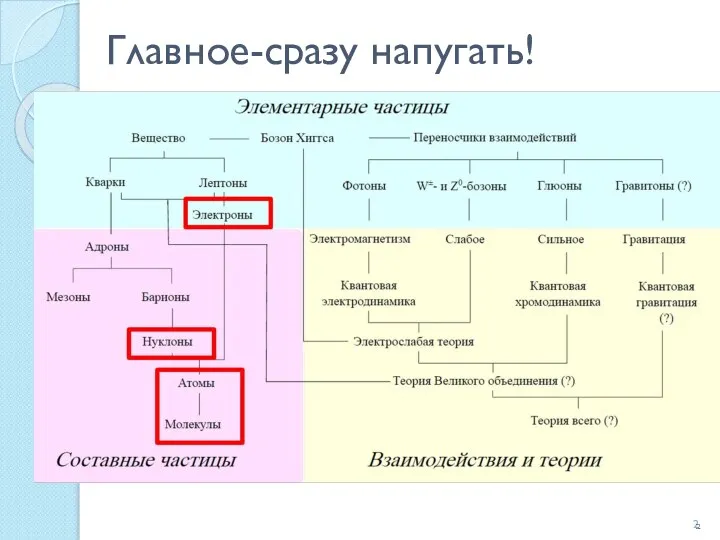
- 2. Главное-сразу напугать!
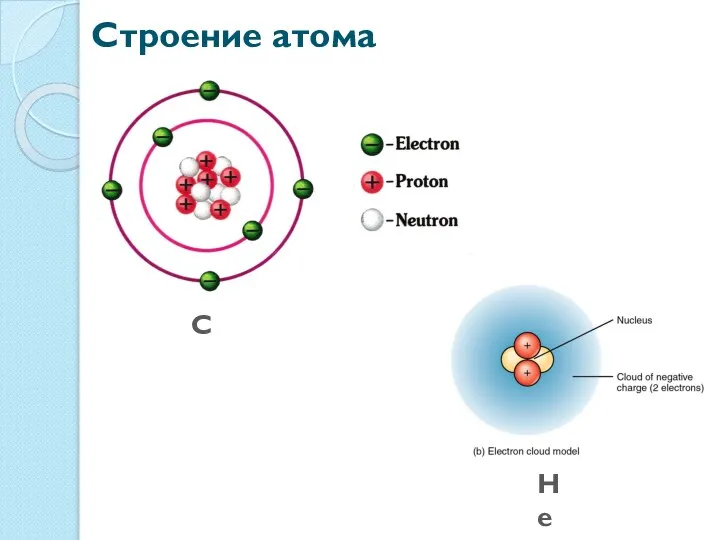
- 3. Строение атома He C
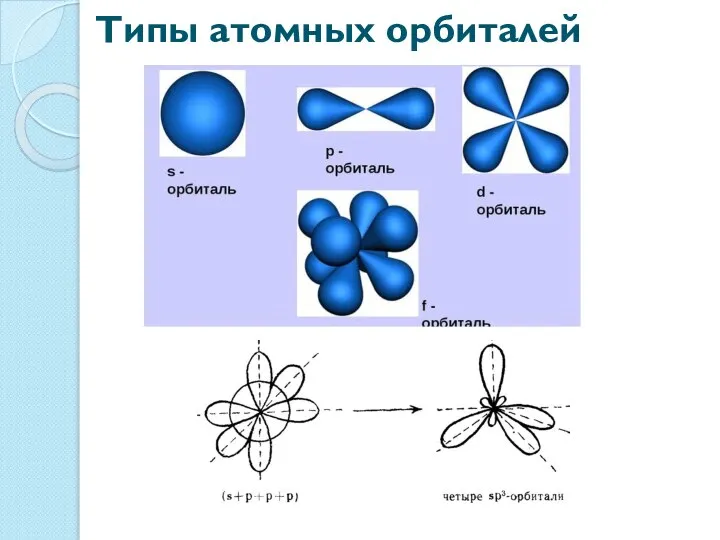
- 4. Типы атомных орбиталей
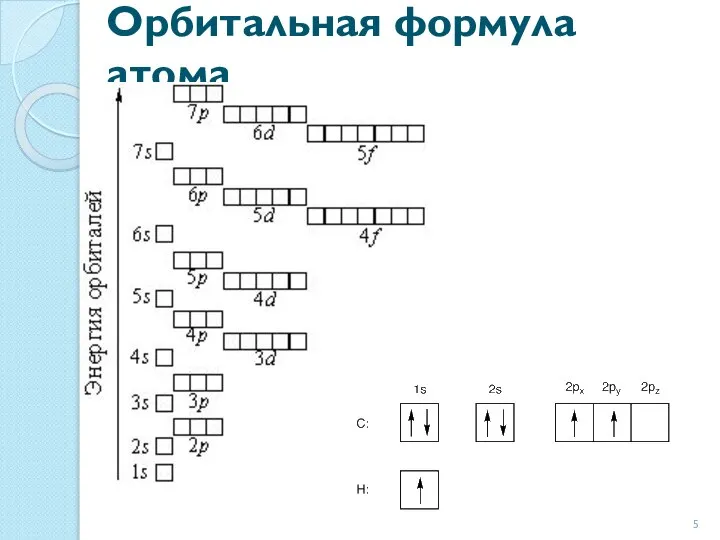
- 5. Орбитальная формула атома
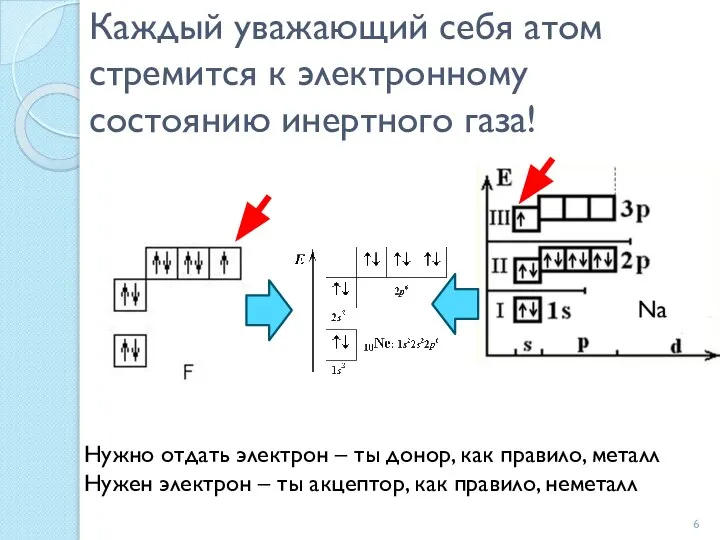
- 6. Каждый уважающий себя атом стремится к электронному состоянию инертного газа! Нужно отдать электрон – ты донор,
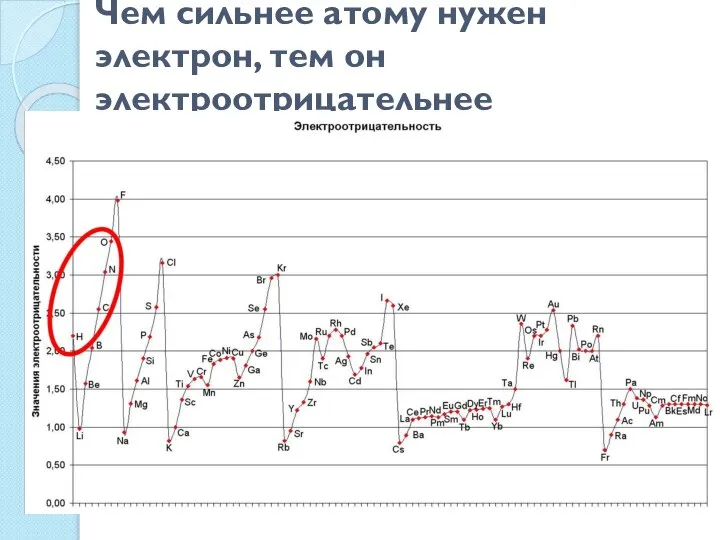
- 7. Чем сильнее атому нужен электрон, тем он электроотрицательнее
- 8. Приобрёл стабильность – стал ионом!
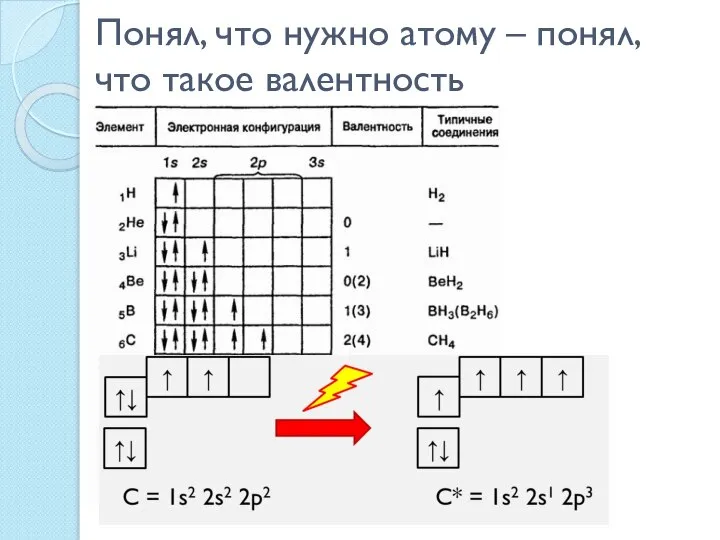
- 9. Понял, что нужно атому – понял, что такое валентность
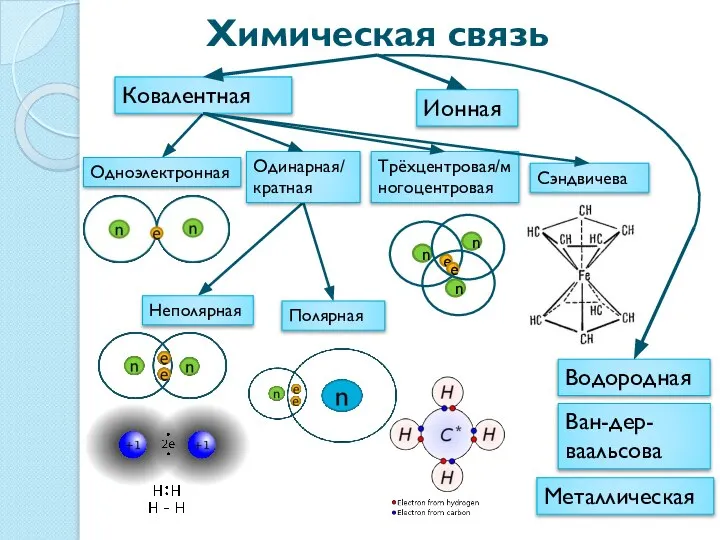
- 10. Химическая связь Ковалентная Одноэлектронная n е Одинарная/кратная е Полярная Неполярная Трёхцентровая/многоцентровая n n Сэндвичева Металлическая Ионная
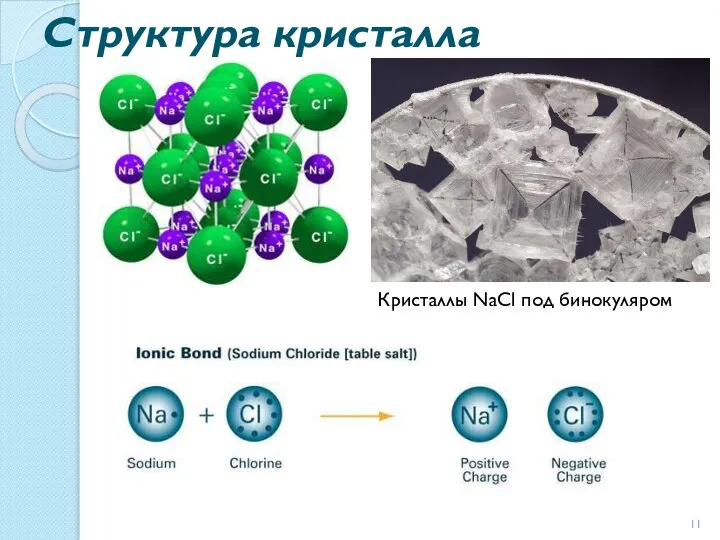
- 11. Структура кристалла Кристаллы NaCl под бинокуляром
- 12. Вода, ее свойства и роль в организмах К+
- 13. Водородные связи Поверхностное натяжение воды, вязкость Поддержание структуры белка Поддержание структуры нуклеиновых кислот Поддержание структуры углеводных
- 14. Гидрофобные взаимодействия Правило первое: полярному хорошо с полярным Правило второе: неполярному хорошо с неполярным
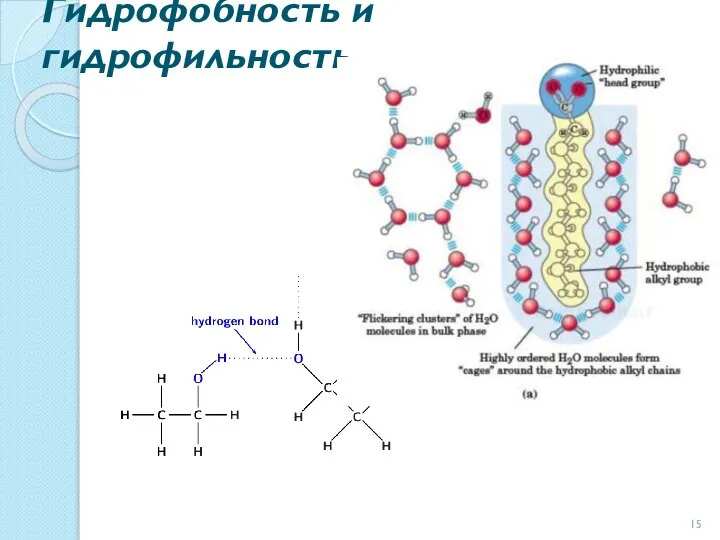
- 15. Гидрофобность и гидрофильность
- 16. Ван-дер-ваальсовы взаимодействия Сцепление частиц малых астероидов кольца́ Сатурна Способность гекконов взбираться по гладким поверхностям, например, по
- 17. Элементный состав человеческого организма
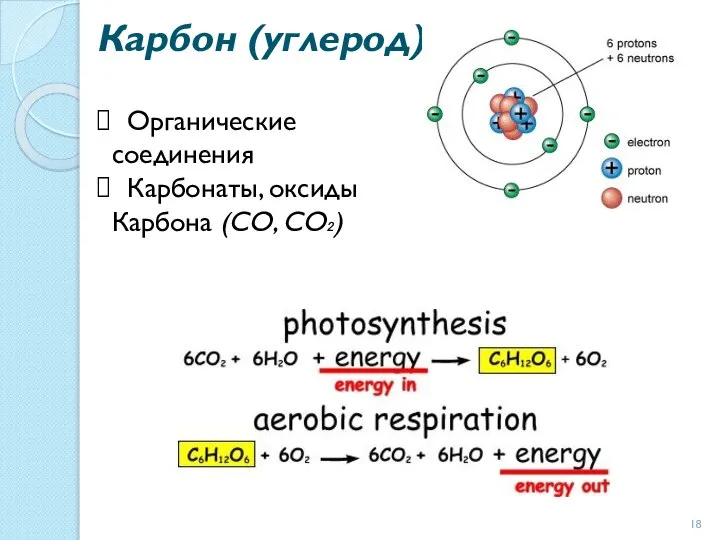
- 18. Карбон (углерод) Органические соединения Карбонаты, оксиды Карбона (СО, СО₂)
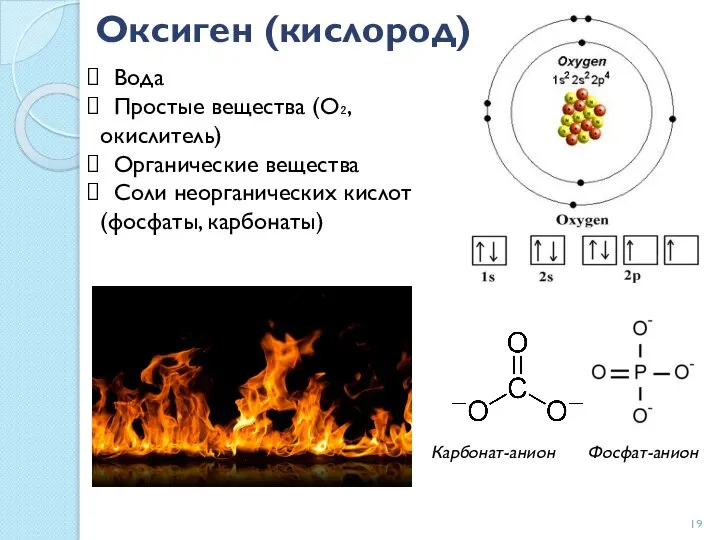
- 19. Оксиген (кислород) Вода Простые вещества (О₂, окислитель) Органические вещества Соли неорганических кислот (фосфаты, карбонаты) Карбонат-анион Фосфат-анион
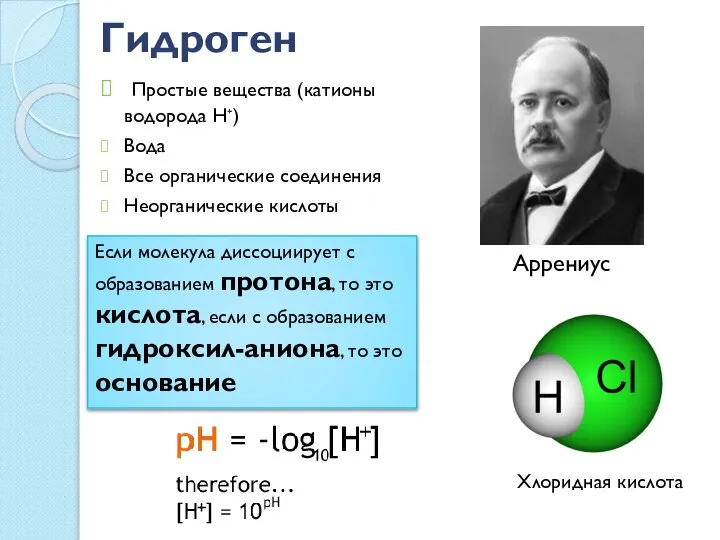
- 20. Гидроген Простые вещества (катионы водорода Н⁺) Вода Все органические соединения Неорганические кислоты Хлоридная кислота Аррениус Если
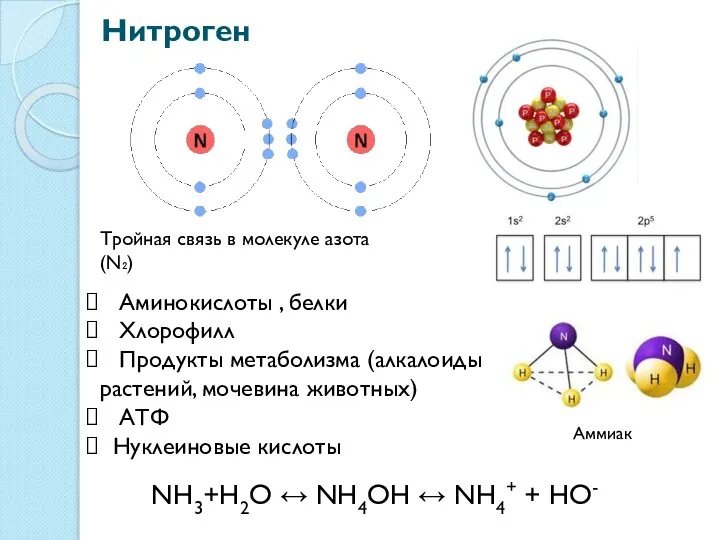
- 21. Нитроген Тройная связь в молекуле азота (N₂) Аминокислоты , белки Хлорофилл Продукты метаболизма (алкалоиды растений, мочевина
- 23. Скачать презентацию






 Области применения серной, соляной, азотной, и уксусной кислот
Области применения серной, соляной, азотной, и уксусной кислот Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Алюминий и его соединения
Алюминий и его соединения Біогеохімічні цикли та їх еволюція
Біогеохімічні цикли та їх еволюція Презентация Витамин Е
Презентация Витамин Е  Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Естествознание. Раздел II. Химия с элементами экологии Урок по теме:
Естествознание. Раздел II. Химия с элементами экологии Урок по теме: Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть
Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть  Презентация по Химии "Пластмаса" - скачать смотреть бесплатно
Презентация по Химии "Пластмаса" - скачать смотреть бесплатно Кислотно-основное титрование. 4 лекция. Часть 2
Кислотно-основное титрование. 4 лекция. Часть 2 Реакции координированных лигандов
Реакции координированных лигандов Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Основные классы неорганических соединений
Основные классы неорганических соединений Электролиз
Электролиз ГОД ЭКОЛОГИИ-2013
ГОД ЭКОЛОГИИ-2013  Растворы
Растворы Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Химия и здоровье
Химия и здоровье  Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей В чём вкус хлеба?
В чём вкус хлеба? Катализ.Лекция
Катализ.Лекция Антибиотики как ЛС
Антибиотики как ЛС Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров
Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров КВН В МИРЕ ВЕЩЕСТВ
КВН В МИРЕ ВЕЩЕСТВ Полимерные реагенты в бурении
Полимерные реагенты в бурении Хімічний лабіринт
Хімічний лабіринт