Содержание
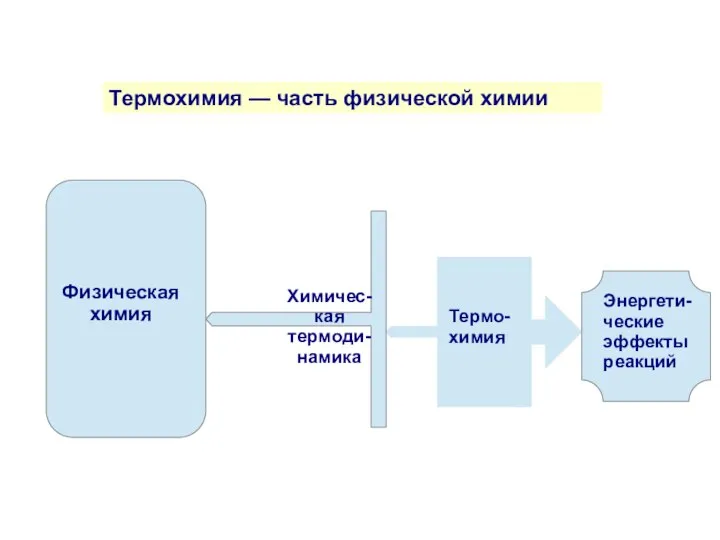
- 2. Термохимия — часть физической химии Энергети-ческие эффекты реакций Термо-химия Химичес-кая термоди-намика Физическая химия
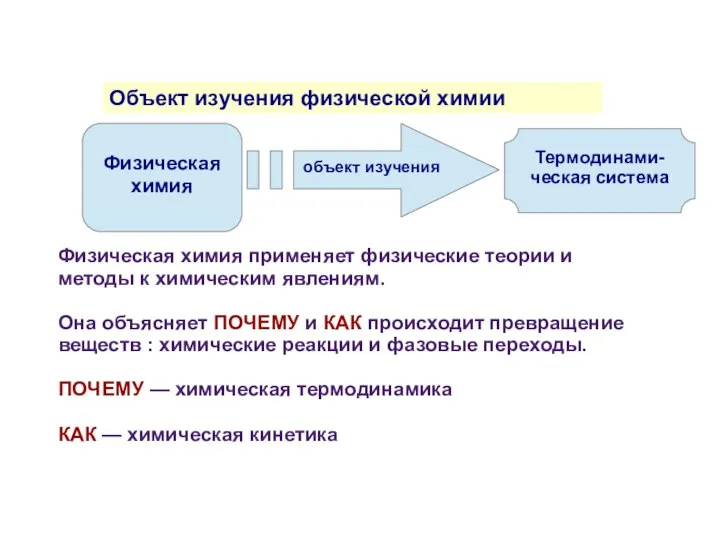
- 3. Объект изучения физической химии Термодинами-ческая система Физическая химия объект изучения Физическая химия применяет физические теории и
- 4. Химическая термодинамика
- 5. Задачи химической термодинамики
- 6. Термо-динами-ческая система Вселенная Окружающая Среда Термодинамическая система Объект изучения физической химии
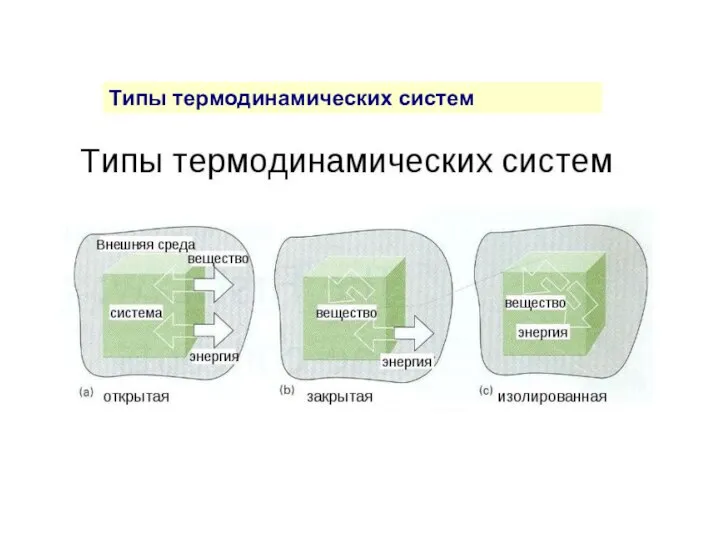
- 7. Типы термодинамических систем
- 8. Типы термодинамических систем
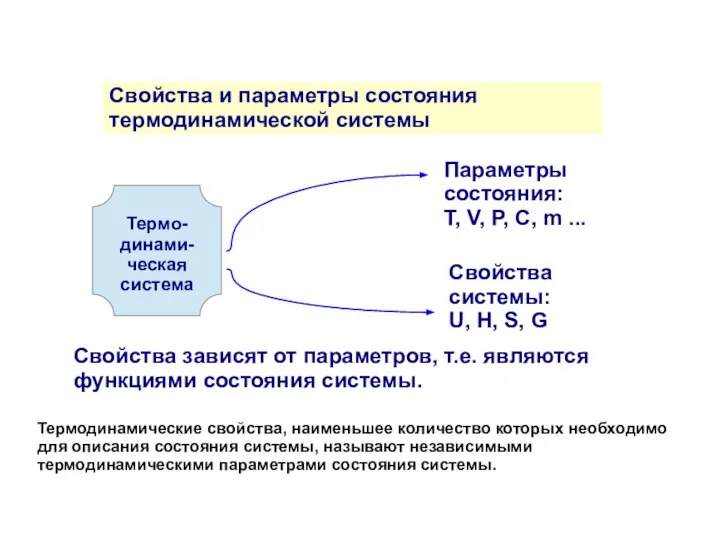
- 9. Свойства и параметры состояния термодинамической системы Термо-динами-ческая система Параметры состояния: Т, V, P, C, m ...
- 10. Первое начало термодинамики
- 11. Первое начало термодинамики И выражает универсальный закон сохранения энергии применительно к задачам термодинамики. 1-я формулировка: энергия
- 12. Теплота, получаемая Работа, совершаемая системой системой Первое начало термодинамики Внутренняя энергия: - не имеет точки отсчета:
- 13. - изохорный V = const - изобарный Р = const - изотермический T = const -
- 14. При изобарном процессе тепловой эффект называется изменением энтальпии или просто энтальпией: Qp = -ΔH Экзотермический процесс
- 15. Уравнения реакций с указанием энтальпии и агрегатных состояний веществ, называют термохимическими. H2 (г) + 0,5O2 (г)
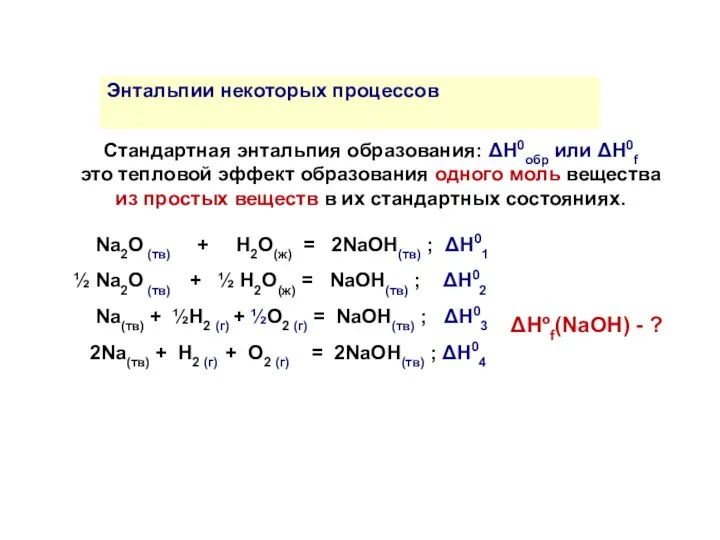
- 16. Стандартная энтальпия образования: ΔH0обр или ΔH0f это тепловой эффект образования одного моль вещества из простых веществ
- 17. Энтальпии всех простых веществ в стандартном состоянии равны нулю Энтальпии некоторых процессов ΔНºf(I2 (т) ) =
- 18. Стандартная энтальпия сгорания: ΔH0сгор это тепловой эффект сгорания одного моль вещества до образования высших оксидов (органики
- 19. Стандартная энтальпия разрыва связи или энергия связи: ΔH0св или Есв энергия, поглощаемая при разрыве одного моль
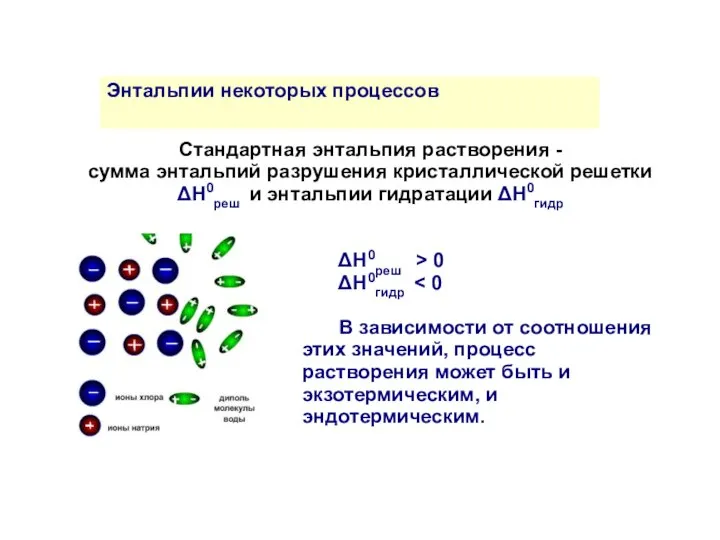
- 20. Стандартная энтальпия растворения - сумма энтальпий разрушения кристаллической решетки ΔH0реш и энтальпии гидратации ΔH0гидр ΔH0реш >
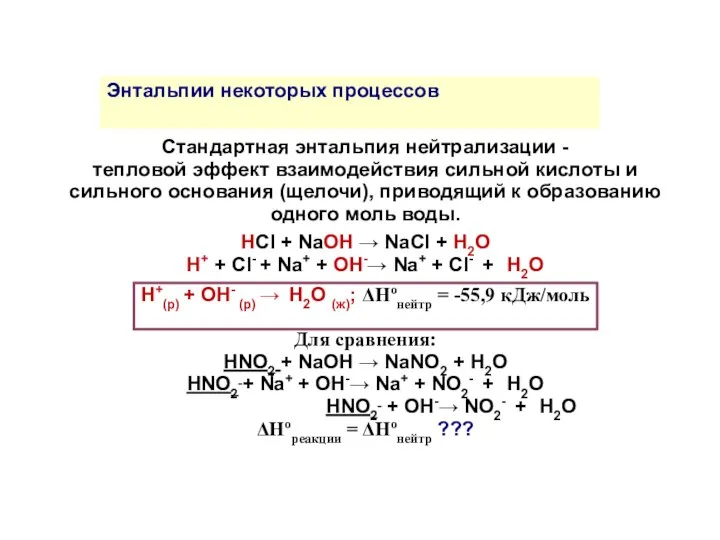
- 21. Стандартная энтальпия нейтрализации - тепловой эффект взаимодействия сильной кислоты и сильного основания (щелочи), приводящий к образованию
- 22. Стандартная энтальпия реакции ΔНºреакции — тепловой эффект реакции определенного числа моль реагентов, задаваемого уравнением реакции при
- 23. Закон Гесса Герман Иванович Гесс (1802-1850) Окончил Дерптский университет. С 1832 г. профессор химии в Горном
- 24. Закон Гесса Тепловой эффект процесса зависит только от начального и конечного состояния системы, но не зависит
- 25. 1) ΔНp = ∑∆Нf продуктов - ∑∆Нf исх. веществ 2) ΔНp = ∑∆Нсгор исх. в-в -
- 26. Задача: Определите стандартную энтальпию гидратации Na2CO3∙H2O до Na2CO3∙10H2O, если при растворении первого выделяется 10,5 кДж/моль, а
- 27. Какие процессы протекают самопроизвольно? Е полн Е полн Q
- 28. Какие процессы протекают самопроизвольно? +∆H -∆H Почему?
- 29. Какие процессы протекают самопроизвольно? Энтальпия не является критерием, однозначно определяющим направление процесса.
- 30. Энтропия Энтропия — мера хаоса.
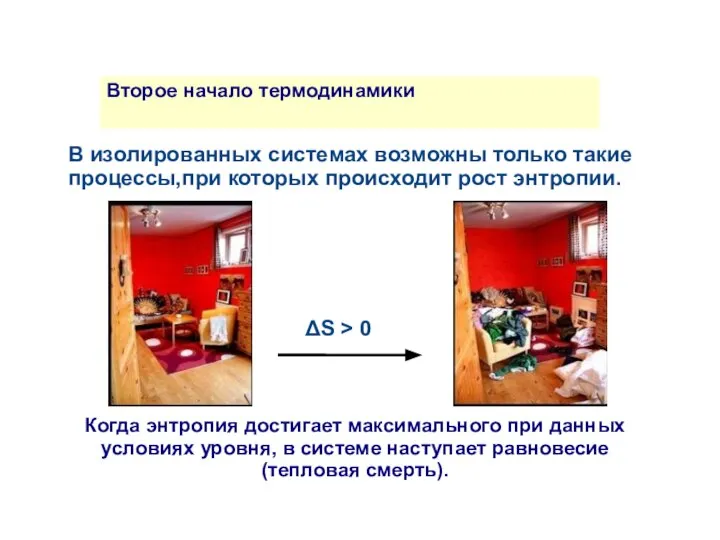
- 31. Второе начало термодинамики В изолированных системах возможны только такие процессы,при которых происходит рост энтропии. ΔS >
- 32. Энтропия Постулат Больцмана:
- 33. Энтропия Людвиг Больцман (1844 — 1906) Австрийский физик, Один из основоположников статистической механики и молекулярно-кинетической теории.
- 34. Энтропия Расчет энтропии реакции ΔS0р аналогичен расчету ΔН0р: ΔSp = ∑∆Sf продуктов - ∑∆Sf исх. веществ
- 35. Третье начало термодинамики Энтропия чистого, совершенного кристалла при 0К равна нулю.
- 36. Энтропийный фактор Чем больше температура, тем больше тепловое движение частиц, тем больше энтропия. Произведение Т на
- 37. Вероятность протекания процесса Ни энтальпия, ни энтропия не могут порознь предсказать вероятность протекания процесса. Для этого
- 38. Вероятность протекания процесса Энергия Гельмгольца или изохорно-изотермический потенциал: ΔA0 = ΔU0 - TΔS0
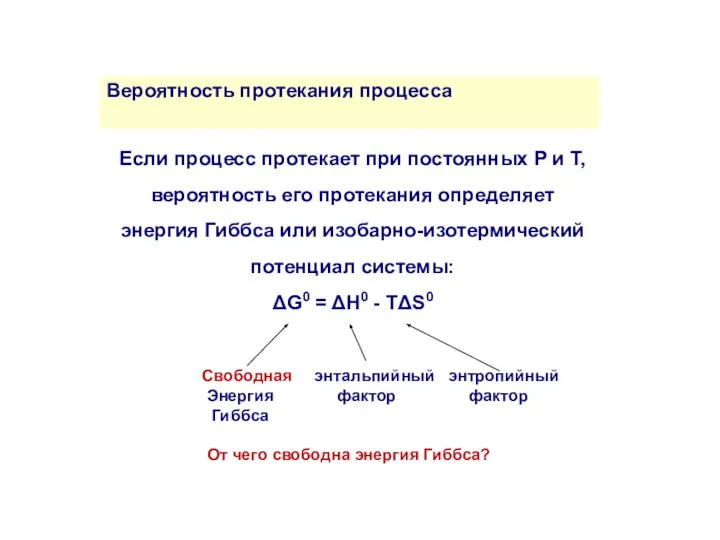
- 39. Вероятность протекания процесса Если процесс протекает при постоянных P и T, вероятность его протекания определяет энергия
- 40. Вероятность протекания процесса ΔG0 = ΔH0 - TΔS0 ΔG0 ΔG0 > 0 - процесс термодинамически запрещен
- 41. Вероятность протекания процесса ΔG0 = ΔH0 - TΔS0 Анализ уравнения Гиббса: Экзотермический процесс, ΔН а) если
- 42. Вероятность протекания процесса Гиббс Джозайя Уиллард (1839 — 1903) американский физик, физикохимик, математик и механик, один
- 43. Вероятность протекания процесса ΔG0 можно рассчитать не только по уравнению Гиббса ΔG0 = ΔH0 — TΔS0,
- 44. Изотерма Вант-Гоффа Энергия Гиббса ΔG0 позволяет не только определять направление процесса, но и оценивать полноту его
- 45. Изотерма Вант-Гоффа Для любого произвольного процесса dD + eE = lL + bB При наступлении равновесия
- 47. Скачать презентацию


































 Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Двойной электрический слой на границе раздела твердое тело. Раствор электролита
Двойной электрический слой на границе раздела твердое тело. Раствор электролита Благородные газы
Благородные газы Hydrogen
Hydrogen Пены. Свойства пен
Пены. Свойства пен Проблемы загрязнения воды Ташбаев Далерхан 7 «А»
Проблемы загрязнения воды Ташбаев Далерхан 7 «А» Липиды. Химические свойства
Липиды. Химические свойства Многоатомные Спирты
Многоатомные Спирты  Электрические свойства дисперсных систем. (Лекция 5)
Электрические свойства дисперсных систем. (Лекция 5) Аттестационная работа. Химия в продуктах питания
Аттестационная работа. Химия в продуктах питания Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Типы кристаллических решеток. Вещества молекулярного и немолекулярного строения
Типы кристаллических решеток. Вещества молекулярного и немолекулярного строения Весь курс химии. Кратко
Весь курс химии. Кратко Янтарь – солнечный камень. Рассказ об удивительном минерале
Янтарь – солнечный камень. Рассказ об удивительном минерале Кислоты. Состав, строение, классификация
Кислоты. Состав, строение, классификация Электролитическая диссоциация
Электролитическая диссоциация Екологічні продукти Знаки світу та України
Екологічні продукти Знаки світу та України  Основы молекулярной биологии
Основы молекулярной биологии Химические уравнения
Химические уравнения Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения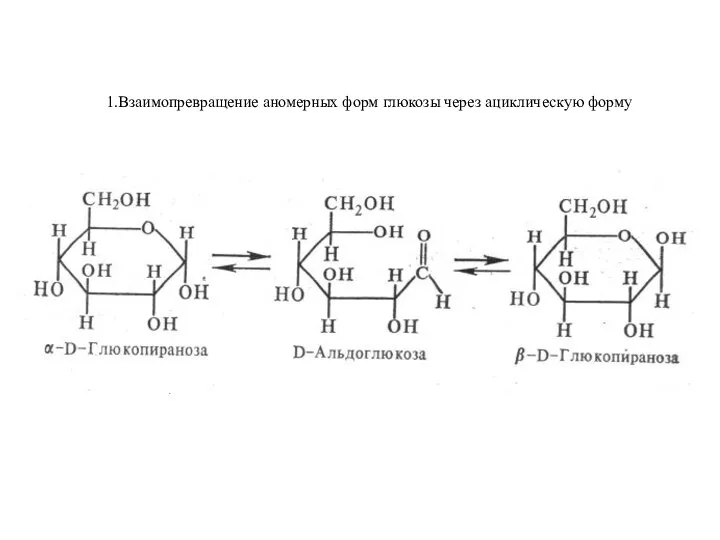 Взаимопревращение аномерных форм глюкозы через ациклическую форму
Взаимопревращение аномерных форм глюкозы через ациклическую форму Урок русского языка 7 класс Автор – Грязнова Ирина Сергеевна Г. Благовещенск МОУ СОШ № 15 2010 г.
Урок русского языка 7 класс Автор – Грязнова Ирина Сергеевна Г. Благовещенск МОУ СОШ № 15 2010 г.  Презентация по Химии "Дмитро Іванович Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Іванович Менделєєв" - скачать смотреть бесплатно Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс ОСНОВАНИЕ
ОСНОВАНИЕ Фармакология, её задачи. Этапы развития. Краткий очерк истории отечественной фармакологии
Фармакология, её задачи. Этапы развития. Краткий очерк истории отечественной фармакологии Базальтовое волокна
Базальтовое волокна Види пластмаси
Види пластмаси