Содержание
- 2. ФИЗИЧЕСКАЯ ХИМИЯ Наука о закономерностях химических процессов и химических явлений. Объясняет эти явления на основе фундаментальных
- 3. ФИЗИЧЕСКАЯ ХИМИЯ Задачи: - изучение строения и свойств вещества и составляющих его частиц изучение процессов взаимодействия
- 4. Основные разделы Строение вещества Химическая термодинамика Химическая кинетика и равновесие Учение о растворах Электрохимия Коллоидная химия
- 5. Все разделы физической химии объединяет единая основа – общие законы природы, которые применимы к любым процессам
- 6. ФИЗИЧЕСКАЯ ХИМИЯ Основоположник - М. В. Ломоносов (1711-1765)
- 7. ФИЗИЧЕСКАЯ ХИМИЯ Внесли огромный вклад в развитие науки – Карно, Джоуль, Гесс, Клаузиус, Гиббс, Вант-Гофф, Нернст
- 8. ФИЗИЧЕСКАЯ ХИМИЯ Многие специальные дисциплины (агрохимия, физиология растений и животных, биохимия, микробиология) на современном уровне не
- 9. ФИЗИЧЕСКАЯ ХИМИЯ Особое значение физической химии состоит в формировании у студентов диалектико-материалистического мировоззрения, которое обеспечивает наиболее
- 10. Строение вещества Молекулярно-кинетическая теория объясняет свойства тел взаимодействием и движением молекул и атомов В зависимости от
- 11. Агрегатные состояния Газообразное состояние идеальный газ - в котором можно пренебречь силами молекулярного взаимодействия и объемом
- 12. Агрегатные состояния Плазменное состояние частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов
- 13. Агрегатные состояния Жидкое состояние вещества Поверхностное натяжение - сила, которая стремится уменьшить площадь поверхности раздела Вязкость
- 14. Агрегатные состояния Твердое состояние вещества Типы кристаллических решеток триклинная моноклинная ромбическая гексагональная тетрагональная тригональная кубическая
- 15. Лекция № 2 Тема: Основы химической термодинамики
- 16. Химическая термодинамика Нулевым (или общим) началом термодинамики называют принцип, согласно которому замкнутая система независимо от начального
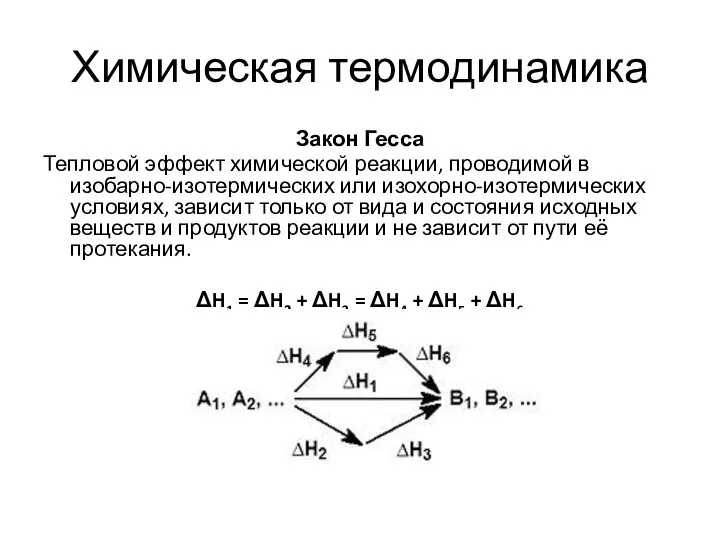
- 17. Химическая термодинамика Закон Гесса Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только
- 18. Химическая термодинамика Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по
- 20. Скачать презентацию
















 Химическая связь
Химическая связь Устойчивость и коагуляция коллоидных систем
Устойчивость и коагуляция коллоидных систем Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Окислительно-восстановительные реакции. Генетическая взаимосвязь неорганических веществ
Окислительно-восстановительные реакции. Генетическая взаимосвязь неорганических веществ Кремнийорганическая гипотеза
Кремнийорганическая гипотеза Агрегатные состояния вещества
Агрегатные состояния вещества Каталитический крекинг
Каталитический крекинг Сейсморазведка
Сейсморазведка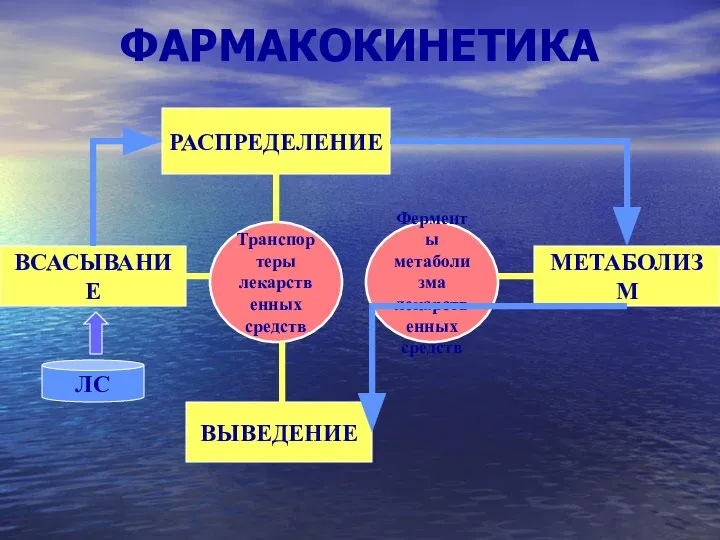 Фармакокинетика
Фармакокинетика Методи очищення води в побуті
Методи очищення води в побуті Альдегіди і кетони аліфатичного ряду. Альдегіди і кетони ароматичного ряду
Альдегіди і кетони аліфатичного ряду. Альдегіди і кетони ароматичного ряду Волшебные кристалы
Волшебные кристалы Гетерофункциональные соединения. (Лекция 14)
Гетерофункциональные соединения. (Лекция 14) Химия и здоровье человека
Химия и здоровье человека Актуалізація опорних знань учнів і мотивація навчальної діяльносты. Хімія 7 клас
Актуалізація опорних знань учнів і мотивація навчальної діяльносты. Хімія 7 клас Водородная связь
Водородная связь МОУ «СОШ № 102» Урок в 9 «Б» классе Презентацию подготовила: учитель химии Зубкова Е. А.
МОУ «СОШ № 102» Урок в 9 «Б» классе Презентацию подготовила: учитель химии Зубкова Е. А.  Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Гiдроксикислоти. Номенклатура
Гiдроксикислоти. Номенклатура Электрохимическая защита
Электрохимическая защита Наука о ферментах
Наука о ферментах Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Презентация на тему: «Химия и пища» Выполнила: студентка группы О-12 Синицкая Ирина
Презентация на тему: «Химия и пища» Выполнила: студентка группы О-12 Синицкая Ирина Курсовая работа. Влияние микроэлементов на физиологические процессы
Курсовая работа. Влияние микроэлементов на физиологические процессы Глюконеогенез. Суммарное уравнение реакций глюконеогенеза
Глюконеогенез. Суммарное уравнение реакций глюконеогенеза Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов
Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов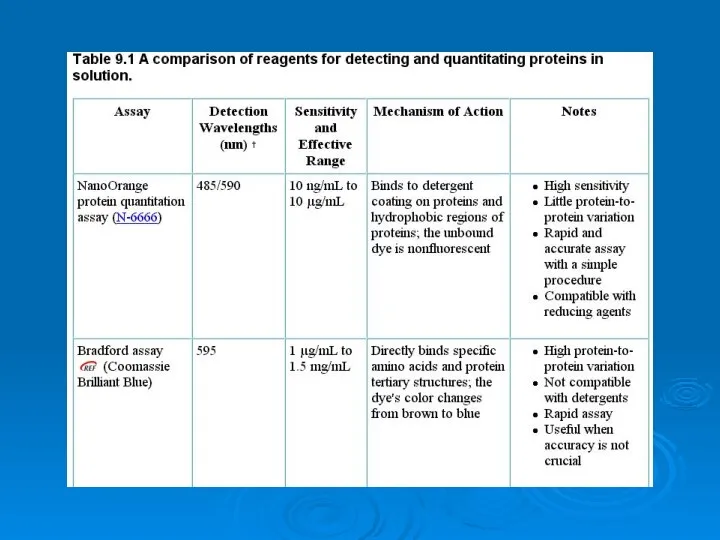 Analysis of proteins
Analysis of proteins Олимпиада по фармацевтической химии. Своя игра
Олимпиада по фармацевтической химии. Своя игра