Содержание
- 2. I. Строение и общие свойства π σ σ σ σ σ С С Н Н Н
- 3. II. Изомерия и номенклатура алкенов Гомологический ряд алкенов СnH2n С2Н4 СН2=СН2 систематическое тривиальное брутто структурная Формула
- 4. Названия алкенам дают от родоначальника ряда этилена, представляя, что атомы водорода замещены на радикалы. Записывая название
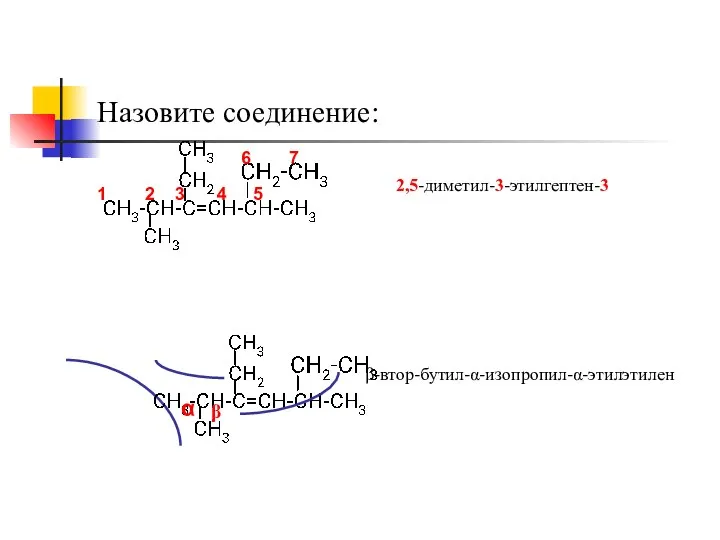
- 5. Назовите соединение: 1 2 3 4 5 6 7 2,5-диметил-3-этилгептен-3 β-втор-бутил-α-изопропил-α-этилэтилен α β
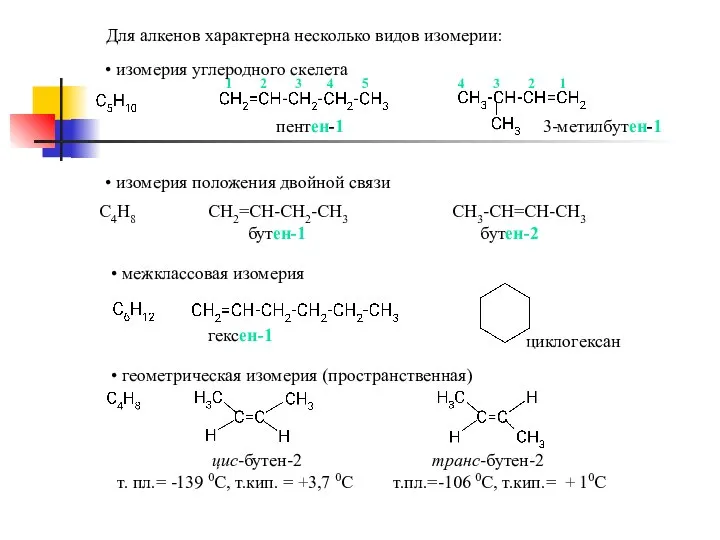
- 6. Для алкенов характерна несколько видов изомерии: изомерия углеродного скелета изомерия положения двойной связи межклассовая изомерия геометрическая
- 7. III. Способы получения. А. Промышленные методы получения: 1. Дегидрирование алканов. пентен-1 пентен-2 Б. Лабораторные методы. 2.Частичное
- 8. 3. Дегидрогалогенирование галогенпроизводных. бутен-1 Правило Зайцева: при отщеплении галогена атом водорода легче всего отщепляется от соседнего
- 9. IV. Физические свойства При обычных условиях: С2-С4 – газы, С5-С17 – жидкости, С18- более – твердые
- 10. V. Химические свойства Алкены вступают в реакции: присоединения; окисления; полимеризации. 1. Гидрирование – присоединение водорода, с
- 11. 3. Гидрогалогенирование – присоединение галогеноводородов (НCl, HBr, HI), с образованием моногалогенпроизводных. Правило Марковникова: атом водорода присоединяется
- 12. 5. Гидратация – присоединение воды, протекает в присутствии серной кислоты, с образованием спиртов. пропилен изопропиловый спирт
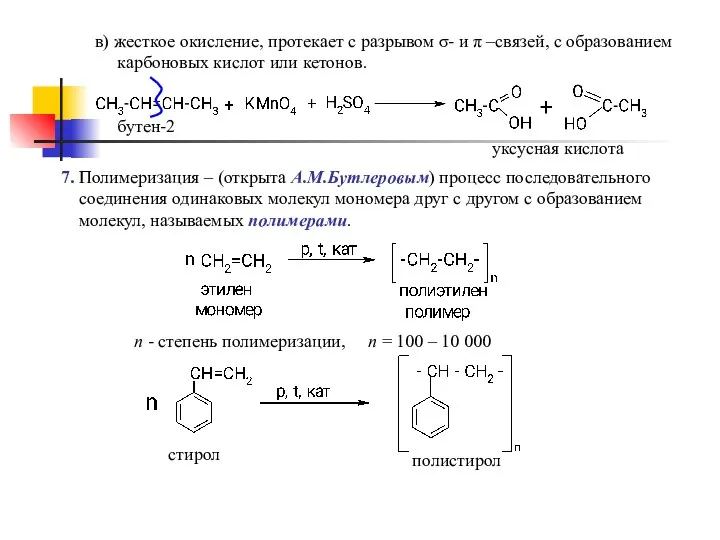
- 13. в) жесткое окисление, протекает с разрывом σ- и π –связей, с образованием карбоновых кислот или кетонов.
- 15. Скачать презентацию









 Белоктар жөніңдегі ілім дамуының қысқаша тарихы
Белоктар жөніңдегі ілім дамуының қысқаша тарихы Оксиды. Гидриды
Оксиды. Гидриды Химические реакции спиртов
Химические реакции спиртов Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Электролитическая диссоциация химических элементов Урок - лекция
Электролитическая диссоциация химических элементов Урок - лекция Массообменные процессы
Массообменные процессы Органическая химия
Органическая химия Знаменитый русский учёный Д. И. Менделеев
Знаменитый русский учёный Д. И. Менделеев Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск
Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск  Галогены. Межгалогенные соединения
Галогены. Межгалогенные соединения Презентация по Химии "углерод" - скачать смотреть бесплатно
Презентация по Химии "углерод" - скачать смотреть бесплатно Алкены. Присоединение простых веществ
Алкены. Присоединение простых веществ Полиоксиалканоаты (ПОА) – Биоразрушаемые полимеры
Полиоксиалканоаты (ПОА) – Биоразрушаемые полимеры Природні і супутні нафтові гази
Природні і супутні нафтові гази  Алкины. Понятие о непредельных углеводородах
Алкины. Понятие о непредельных углеводородах Физико-диагностические свойства минералов
Физико-диагностические свойства минералов Каучуки и резина. Урок 22
Каучуки и резина. Урок 22 Презентация по Химии "Номенклатура алканов разветвлённого строения" - скачать смотреть
Презентация по Химии "Номенклатура алканов разветвлённого строения" - скачать смотреть  ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  «ХИМИКИ НА ЗАЩИТЕ РОДИНЫ»
«ХИМИКИ НА ЗАЩИТЕ РОДИНЫ» Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Исследование орехов мендаля на содержание цианид-ионов
Исследование орехов мендаля на содержание цианид-ионов Строение газообразных, жидких, твердых тел
Строение газообразных, жидких, твердых тел Диаграмма состояния системы железо – углерод
Диаграмма состояния системы железо – углерод Перспективы использования оксигенатов в моторных топливах
Перспективы использования оксигенатов в моторных топливах Дисперсные системы. Основные понятия
Дисперсные системы. Основные понятия Зат алмасу (көмірсу, май)
Зат алмасу (көмірсу, май)