Содержание
- 2. Химическая кинетика - это раздел химии, который изучает скорости химических реакций, их зависимость от различных факторов
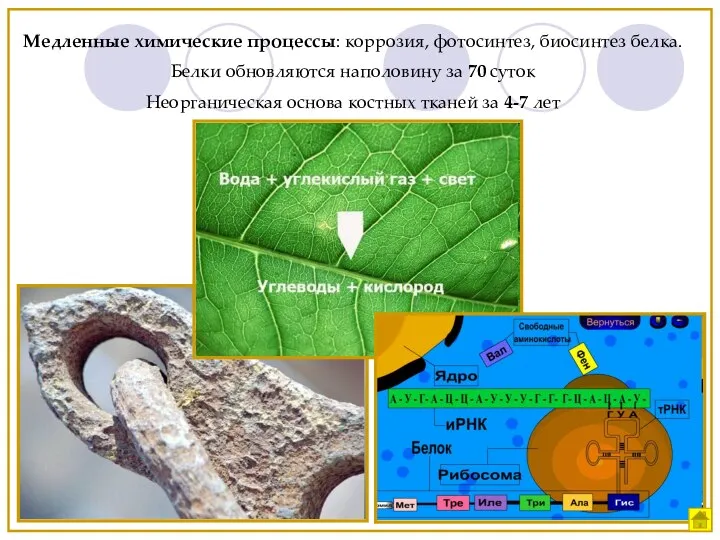
- 3. Медленные химические процессы: коррозия, фотосинтез, биосинтез белка. Белки обновляются наполовину за 70 суток Неорганическая основа костных
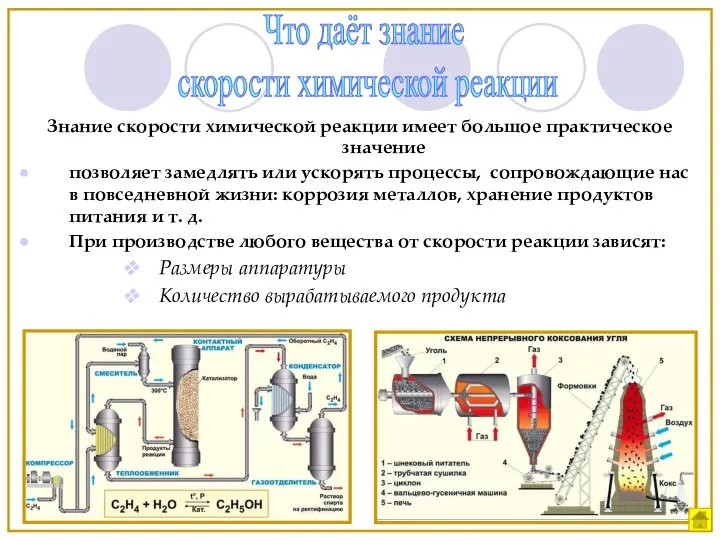
- 4. Знание скорости химической реакции имеет большое практическое значение позволяет замедлять или ускорять процессы, сопровождающие нас в
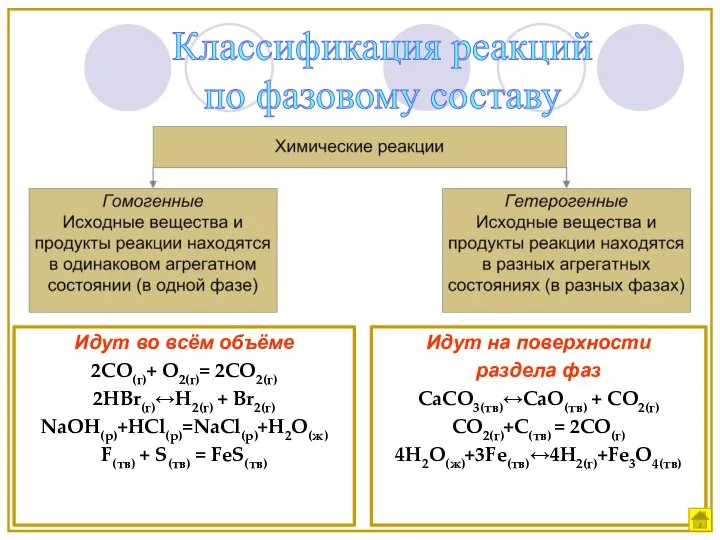
- 5. Идут во всём объёме 2СО(г)+ О2(г)= 2СО2(г) 2HBr(г)↔H2(г) + Br2(г) NaOH(р)+HCl(р)=NaCl(р)+H2O(ж) F(тв) + S(тв) = FeS(тв)
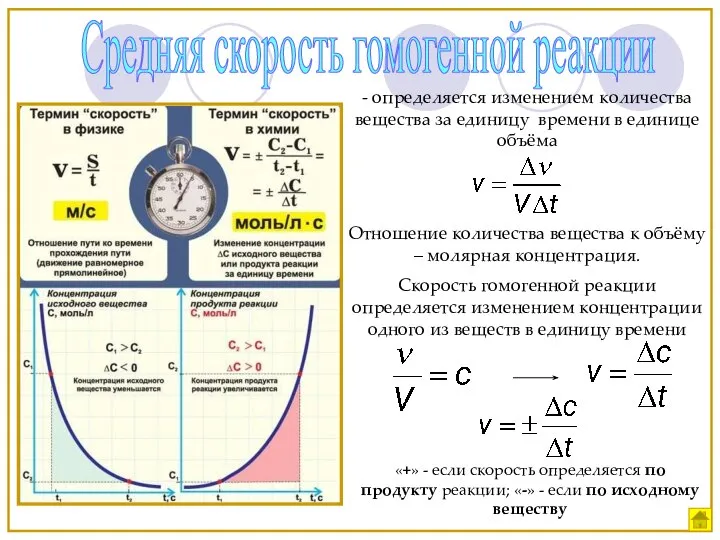
- 6. Средняя скорость гомогенной реакции - определяется изменением количества вещества за единицу времени в единице объёма Отношение
- 7. Средняя скорость гетерогенной реакции - определяется изменением количества вещества, вступившего в реакцию или образовавшегося в результате
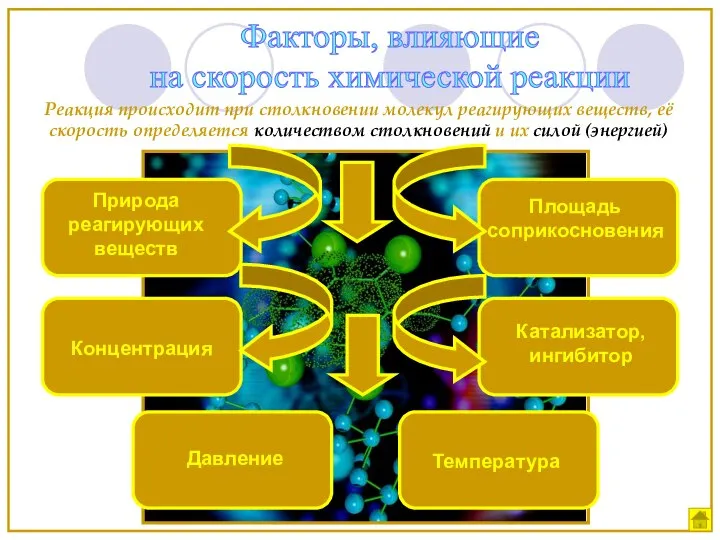
- 8. Факторы, влияющие на скорость химической реакции Природа реагирующих веществ Концентрация Температура Катализатор, ингибитор Площадь соприкосновения Реакция
- 9. Природа реагирующих веществ Реакционная активность веществ определяется: характером химических связей скорость больше у веществ с ионной
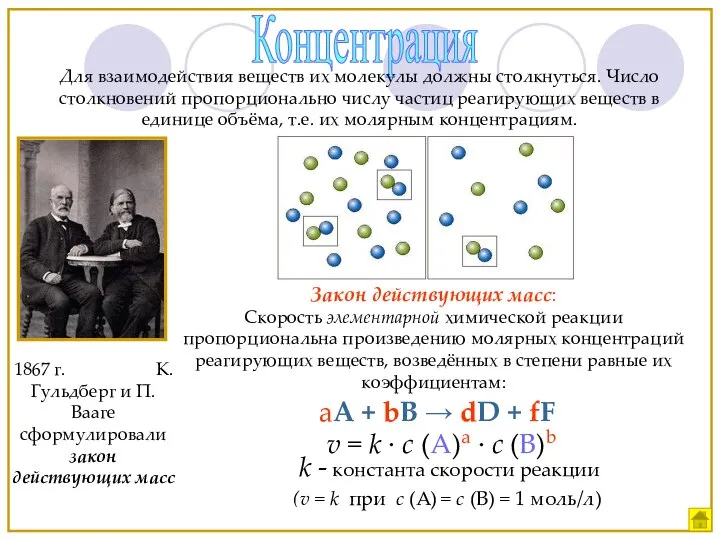
- 10. Концентрация Для взаимодействия веществ их молекулы должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в
- 11. Сванте Аррениус (1859-1927) Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не
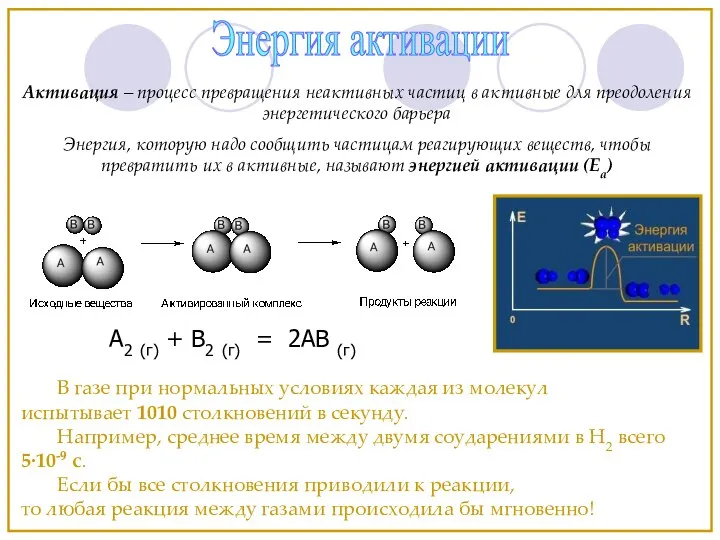
- 12. Энергия активации В газе при нормальных условиях каждая из молекул испытывает 1010 столкновений в секунду. Например,
- 13. Якоб Вант-Гофф (1852-1911) Температура повышает количество столкновений молекул. Правило Вант-Гоффа (сформулировано на основании экспериментального изучения реакций)
- 14. Катализаторы Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г. Вильгельм Оствальд 1909 г. – Нобелевская
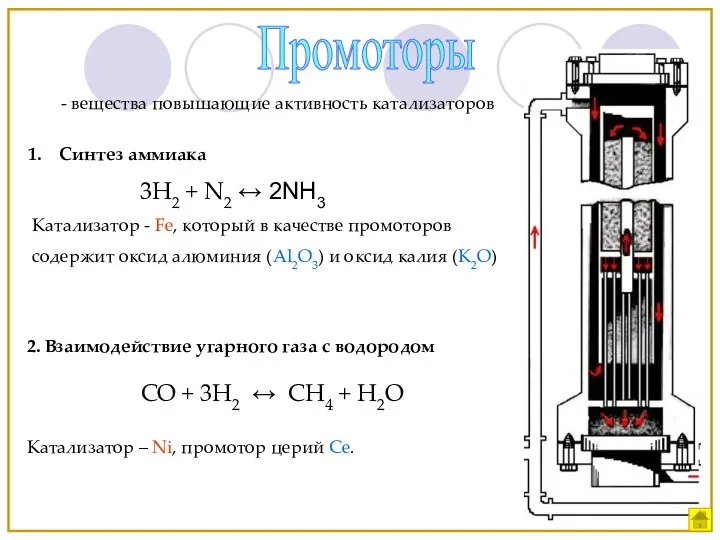
- 15. Промоторы - вещества повышающие активность катализаторов Синтез аммиака 3H2 + N2 ↔ 2NH3 Катализатор - Fe,
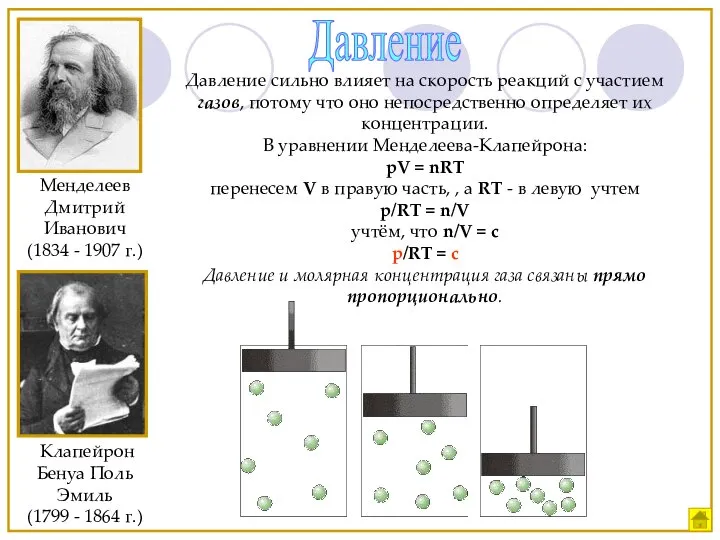
- 16. Давление Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их
- 18. Скачать презентацию






 Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики Физический процесс и химическая реакция.
Физический процесс и химическая реакция. Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Классы неорганических веществ
Классы неорганических веществ Строение газообразных, жидких, твердых тел
Строение газообразных, жидких, твердых тел Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии
Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии Кристалічні тіла
Кристалічні тіла Углерод. Металлы
Углерод. Металлы «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань  Этанол (этиловый спирт)
Этанол (этиловый спирт) Пиролиз. Паровой крекинг углеводородов
Пиролиз. Паровой крекинг углеводородов Кристаллография и основы кристаллохимии. Лекция 5
Кристаллография и основы кристаллохимии. Лекция 5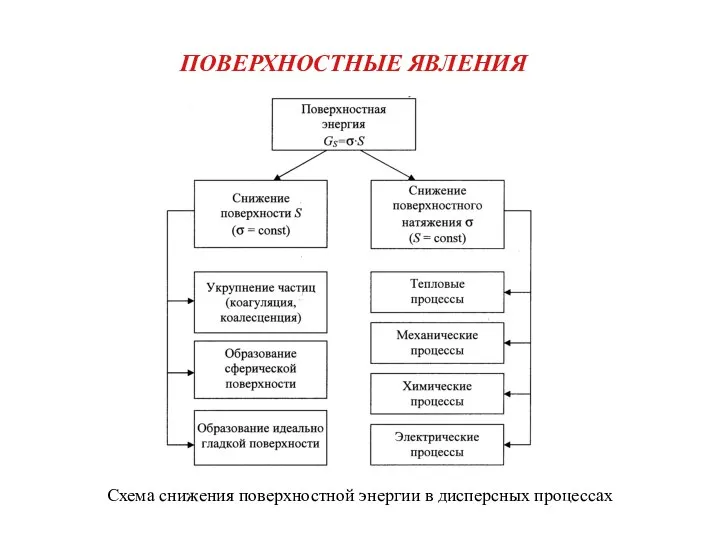 Поверхностные явления
Поверхностные явления Презентация по Химии "«Щелочные металлы»" - скачать смотреть
Презентация по Химии "«Щелочные металлы»" - скачать смотреть  Комплексные соединения
Комплексные соединения Биогенные p-элементы
Биогенные p-элементы Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Ферменты. Функции белков
Ферменты. Функции белков Химия биогенных элементов. Лекция 14
Химия биогенных элементов. Лекция 14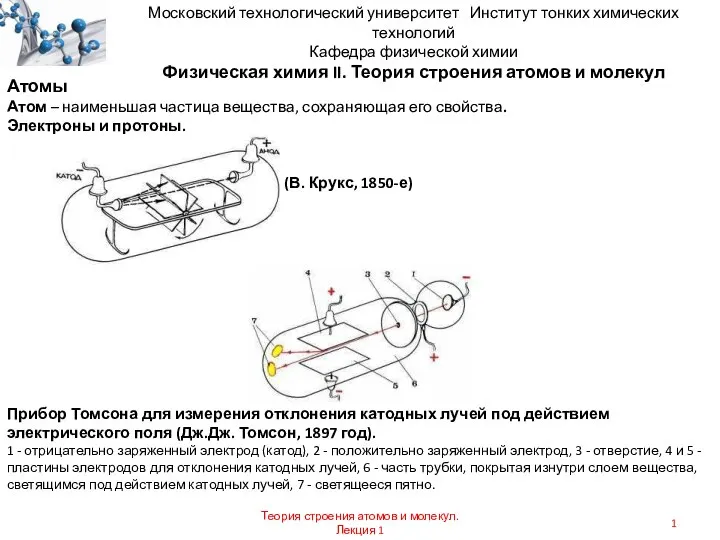 Теория строения атомов и молекул
Теория строения атомов и молекул Первоначальные химические понятия
Первоначальные химические понятия Белки. Строение аминокислот
Белки. Строение аминокислот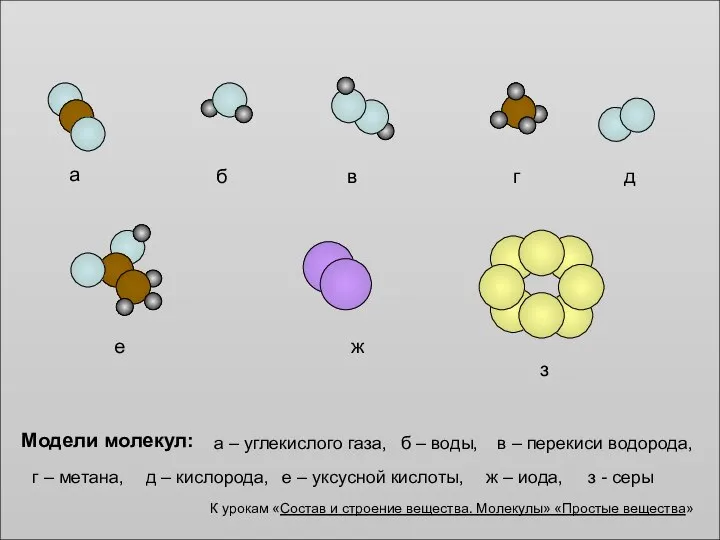 Состав и строение вещества. Молекулы
Состав и строение вещества. Молекулы Решение задач. Органическая химия
Решение задач. Органическая химия Обмен простых белков. Пути обмена аминокислот. (Тема 5)
Обмен простых белков. Пути обмена аминокислот. (Тема 5)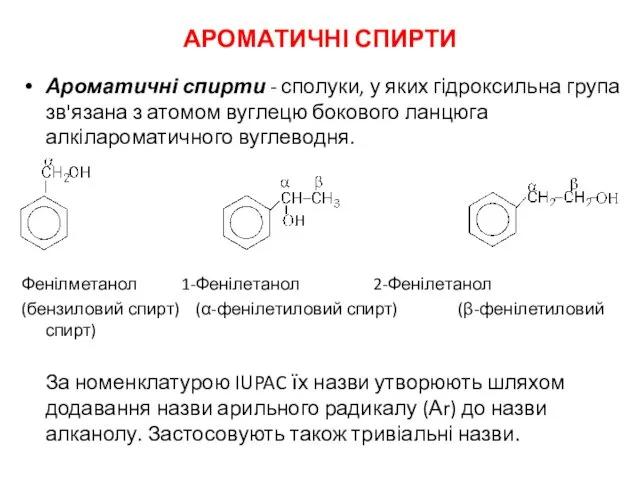 Ароматичні спирти
Ароматичні спирти Етанол (етиловий спирт, винний спирт)
Етанол (етиловий спирт, винний спирт) Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе