Содержание
- 2. Все алканы – бесцветные вещества, легче воды, плохо в ней растворяются. С1 – С4 С5 –
- 3. 1) реакции разложения; 2) реакции соединения; 3) реакции замещения; 4) реакции обмена. Типы химических реакций в
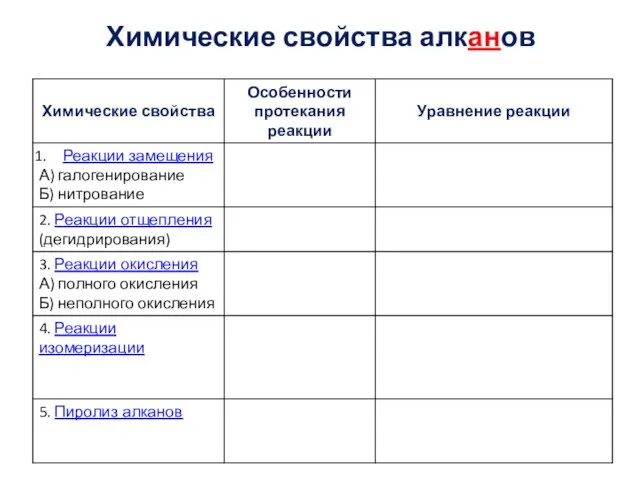
- 4. Химические свойства алканов Типы химических реакций в органической химии: 1) реакции замещения; 2) реакции отщепления; 3)
- 5. Химические свойства алканов
- 6. Химические свойства 1. Реакции замещения - это реакции алканов, идущих с разрывом С - Н связей.
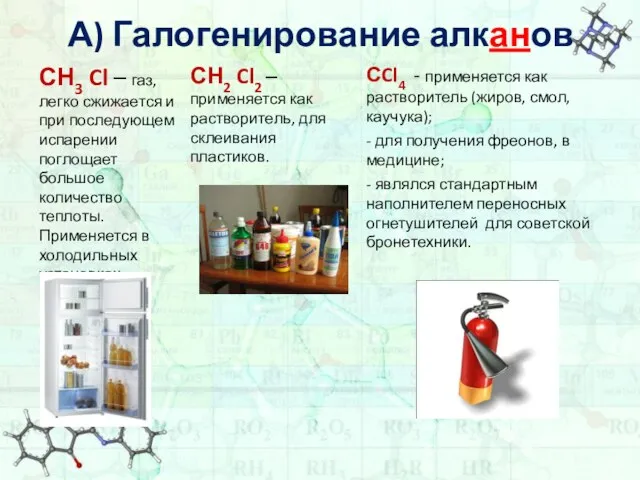
- 7. А) Галогенирование алканов 1) СН4 + Cl2 hv CH3Cl + HCl Хлорметан, или Хлористый метил 2)
- 8. А) Галогенирование алканов
- 9. Б) Нитрование (реакция Коновалова) При нагревании алканов до 140°С с разбавленной (10%-ной) азотной кислотой под давлением
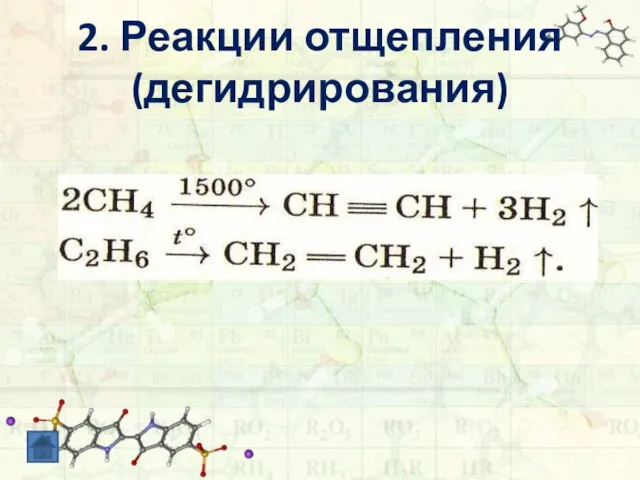
- 10. 2. Реакции отщепления (дегидрирования) - отщепление водорода; происходит при разных температурах (от 3000С), на разных катализаторах:
- 11. 2. Реакции отщепления (дегидрирования)
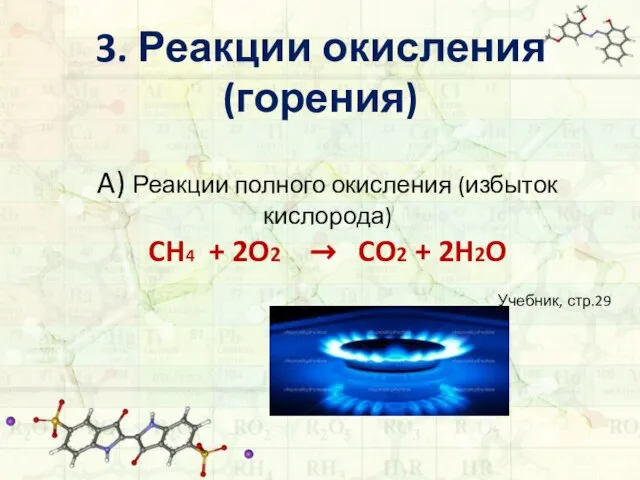
- 12. 3. Реакции окисления (горения) A) Реакции полного окисления (избыток кислорода) CH4 + 2O2 → CO2 +
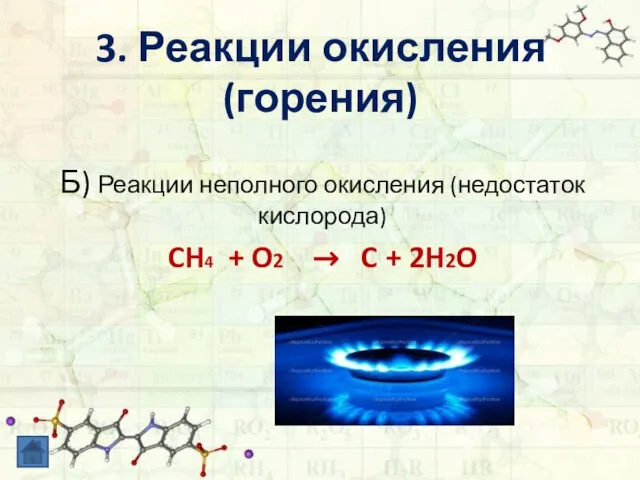
- 13. 3. Реакции окисления (горения) Б) Реакции неполного окисления (недостаток кислорода) CH4 + O2 → C +
- 14. 4. Реакции изомеризации CH3-CH2-CH2-CH3 AlCl3 CH3-CH-CH3 CH3 бутан 2-метил пропан Под влиянием катализаторов при нагревании углеводороды
- 16. Скачать презентацию








 Осадочные горные породы
Осадочные горные породы Презентация по Химии "Кристаллы вокруг нас" - скачать смотреть
Презентация по Химии "Кристаллы вокруг нас" - скачать смотреть  Серная кислота
Серная кислота Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Синтетические моющие средства.(СМС) Подготовила Живулько Елена.
Синтетические моющие средства.(СМС) Подготовила Живулько Елена. Бромды метил буының концентрациясын анықтау тәсілдемесі
Бромды метил буының концентрациясын анықтау тәсілдемесі The way to prepare gold clusters - Every atom makes a difference
The way to prepare gold clusters - Every atom makes a difference Алканы. Циклоалканы
Алканы. Циклоалканы Скорость химической реакции. Порядок и молекулярность реакции. Катализ
Скорость химической реакции. Порядок и молекулярность реакции. Катализ Чаи: знакомые и не знакомые
Чаи: знакомые и не знакомые Атомы, молекулы и ионы
Атомы, молекулы и ионы Важнейшие минералы
Важнейшие минералы Моделирование химико-технологических процессов. Лекция № 1-2
Моделирование химико-технологических процессов. Лекция № 1-2 Реакция поликонденсации фенолов с формальдегидами
Реакция поликонденсации фенолов с формальдегидами Аппараты основных химических производств
Аппараты основных химических производств Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Секвенирование Ion Chip. Технология CMOS и устройство чипа для секвенирования
Секвенирование Ion Chip. Технология CMOS и устройство чипа для секвенирования Несколько слов о химии
Несколько слов о химии Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Применение спиртов и простых эфиров
Применение спиртов и простых эфиров Огнеупорные материалы
Огнеупорные материалы Природний газ
Природний газ Процесс травления тонких линий
Процесс травления тонких линий Основные понятия и законы химии
Основные понятия и законы химии Дисперсные системы. Основные понятия
Дисперсные системы. Основные понятия Химия неметаллов
Химия неметаллов