Содержание
- 2. ФИЛОСОФСКИЙ КАМЕНЬ Алхимик Хенниг Бранд для своих экспериментов выбрал весьма необычное сырье – человеческую мочу. Причем
- 3. СОБАКА БАСКЕРВИЛЕЙ Знаменитый сыщик Шерлок Холмс на островке посреди трясины, где преступник прятал пса, обнаружил жестянку
- 4. Хеннинг Бранд,1669 г Роберт Бойль Фосфор, в переводе с греческого «phosphoros» означает «светоносец»
- 5. Михаил Васильевич Ломоносов Фосфор
- 6. Нахождение в природе Содержание в земной коре – 0,08%. В природе фосфор встречается только в виде
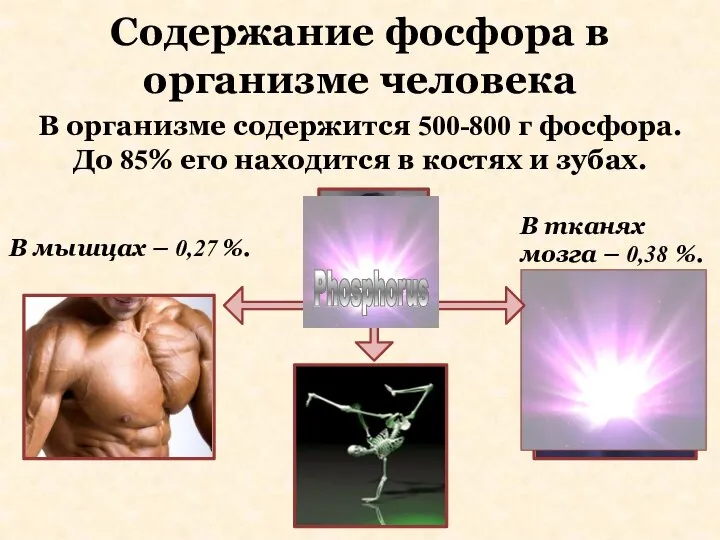
- 7. Содержание фосфора в организме человека В тканях мозга – 0,38 %. В мышцах – 0,27 %.
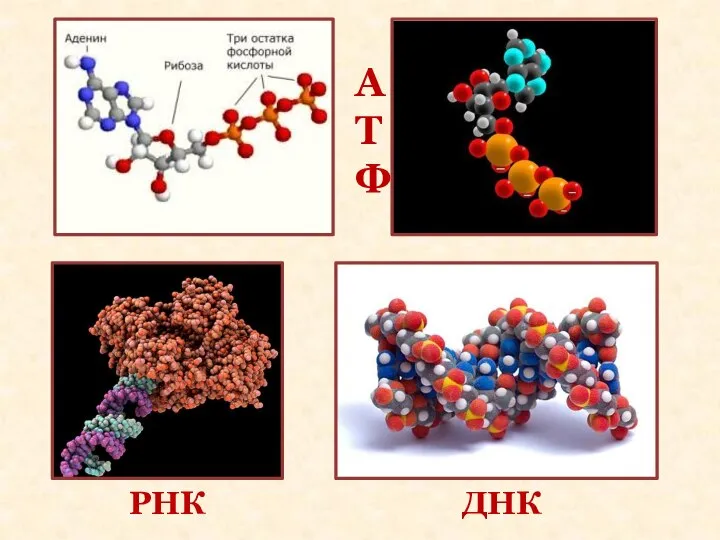
- 8. АТФ ДНК РНК
- 9. Знаете ли вы, что... В теле человека более 1,5 кг фосфора (1,4 кг в костях, 130
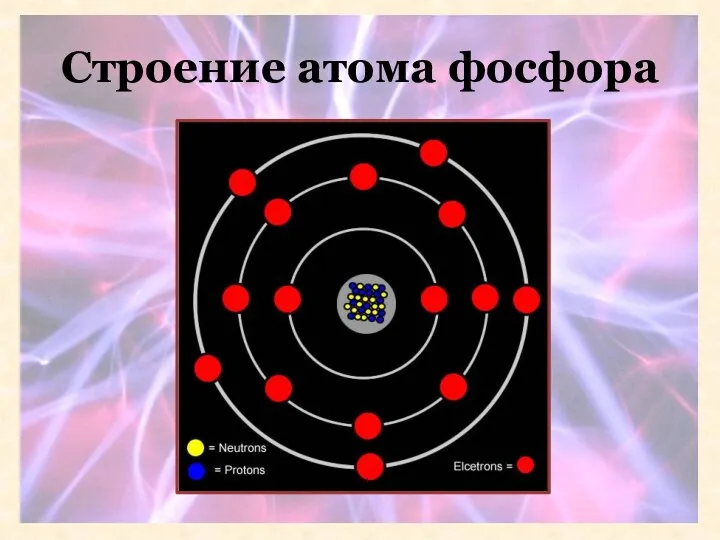
- 10. Строение атома фосфора
- 16. Белый фосфор Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическим веществом. Поэтому собака
- 17. Красный фосфор Не растворяется ни в воде, ни в сероуглероде. На воздухе окисляется медленно и не
- 18. Получение фосфора фосфат кальция Ca3(PO4)2 электропечь белый фосфор (желтый фосфор) 2Ca3(PO4)2 + 6SiO2 + 10C =
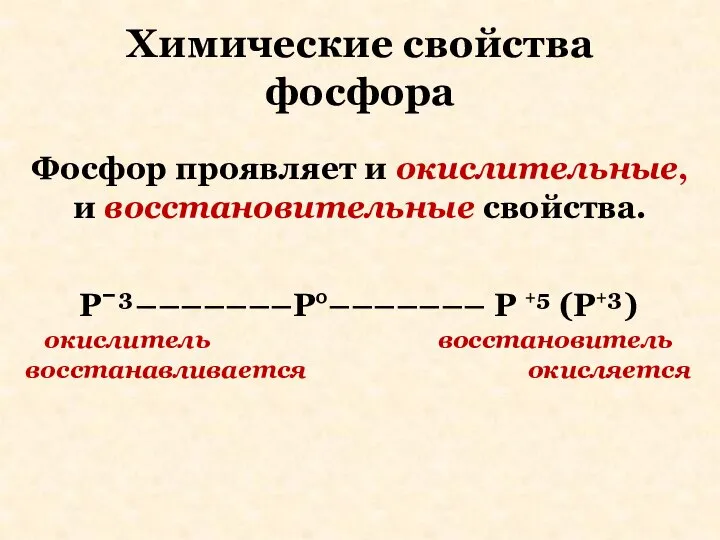
- 19. Химические свойства фосфора Фосфор проявляет и окислительные, и восстановительные свойства. Pˉ³–––––––P°––––––– P +⁵ (P+³) окислитель восстановитель
- 20. Взаимодействие с простыми веществами – неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с
- 21. 2. Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P = Mg3P2
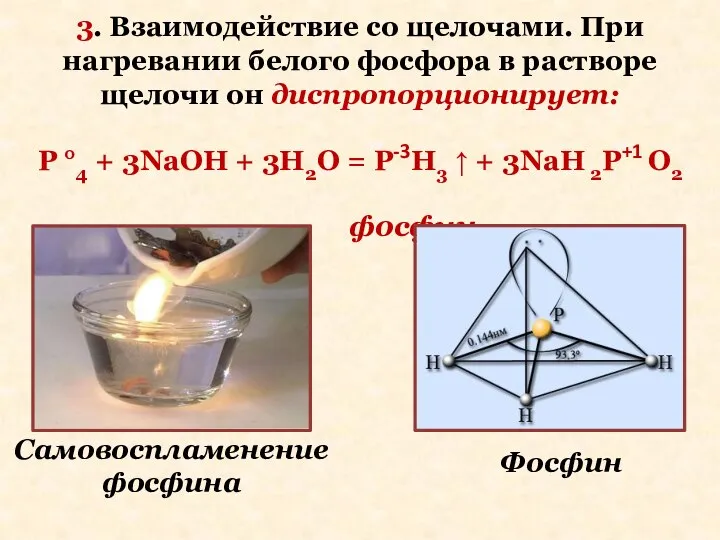
- 22. 3. Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует: P °4 +
- 23. Сильные окислители превращают фосфор в фосфорную кислоту: 3P° + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O;
- 24. Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6 P+5 KCLO3=5
- 25. Применение фосфора Р Р Р Простой суперфосфат, основным компонентом которого является дигидрофосфат кальция Ca(H2PO4)2 Ca3(PO4)2 +
- 26. Двойной суперфосфат Ca3(PO4)2 + 4H3PO4 = 3Ca(H2O4)2 Вместе с азотом фосфор входит в состав некоторых других
- 27. Оружие массового поражения
- 28. А. Е. Ферсман Мечтая раздобыть свой философский камень, Способный приоткрыть златые ворота, Алхимик Бранд увидел синий
- 30. Скачать презентацию





















 Металлы II, побочной подгруппы ПСХЭ
Металлы II, побочной подгруппы ПСХЭ Рідкі кристали
Рідкі кристали Метаморфогенные месторождения
Метаморфогенные месторождения Фармацевтические эмульсии
Фармацевтические эмульсии Массообменные процессы
Массообменные процессы Химические свойства металлов
Химические свойства металлов Эластомеры (резины)
Эластомеры (резины) Сіль амонію
Сіль амонію  Термодинамика. Законы термодинамики
Термодинамика. Законы термодинамики Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть
Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть  Липиды. Химические свойства
Липиды. Химические свойства Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Великие русские химики
Великие русские химики Аттестационная работа. Методическая разработка исследователького урока Строение вещества. Молекулы и атомы
Аттестационная работа. Методическая разработка исследователького урока Строение вещества. Молекулы и атомы Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Коррозия металлов в машиностроении.
Коррозия металлов в машиностроении. Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Химическая номенклатура
Химическая номенклатура Алкины. Пропин
Алкины. Пропин ВЕЩЕСТВА МОЛЕКУЛЯРНОГО СТРОЕНИЯ. ЗАКОН ПОСТОЯНСТВА СОСТАВА.
ВЕЩЕСТВА МОЛЕКУЛЯРНОГО СТРОЕНИЯ. ЗАКОН ПОСТОЯНСТВА СОСТАВА. Розчини електролітів
Розчини електролітів Нобелевская премия по химии
Нобелевская премия по химии Роль химии в жизни человека
Роль химии в жизни человека Полярография и измерение рН
Полярография и измерение рН Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10)
Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10) Cellulase. Introduction (source)
Cellulase. Introduction (source) Текстиль
Текстиль