Содержание
- 2. КЛАСИФІКАЦІЯ ВУГЛЕВОДІВ Вуглеводи діляться на дві великі групи: 1 - Моносахариди (монози)); 2 - Полісахариди (поліози).
- 3. У природі найбільш поширені два види моноз: пентози С5Н10О5 та гексози С6Н12О6. Найчастіше зустрічаються монози, що
- 4. Генетичний ряд альдоз D-ряду
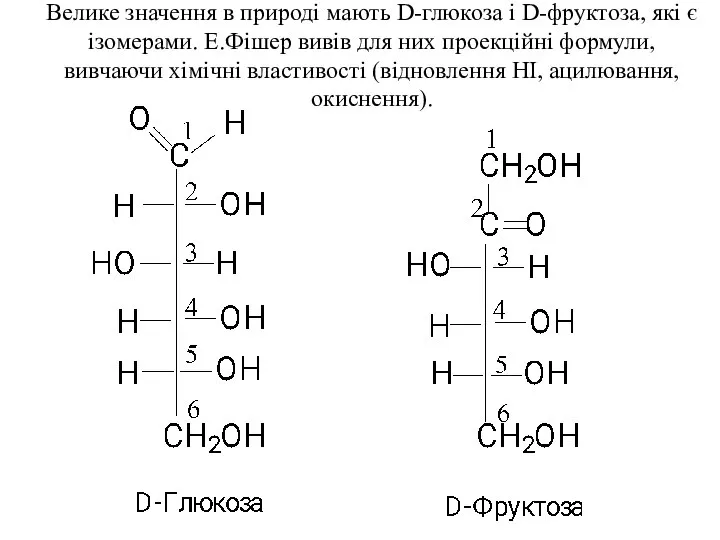
- 5. Велике значення в природі мають D-глюкоза і D-фруктоза, які є ізомерами. Е.Фішер вивів для них проекційні
- 6. В молекулі глюкози є 4 асимметричних атоми вуглецю, тому вона має 24=16 оптичних ізомерів. З них
- 7. В молекулах як глюкози, та і фруктози є по 5 гідроксильних груп. Було встановлено, що один
- 8. Причиною такої аномальної поведінки цих сполук є утворення циклічних або напівацетальних форм за рахунок взаємодії карбонільної
- 11. Таким чином, циклічна і відкрита форми є таутомерами. Напівацетальні форми як глюкози, так і фруктози утворюються
- 12. Утворений при циклізації напівацетальний гідроксил і є тим, що відрізняється за хімічними властивостями від чотирьох інших
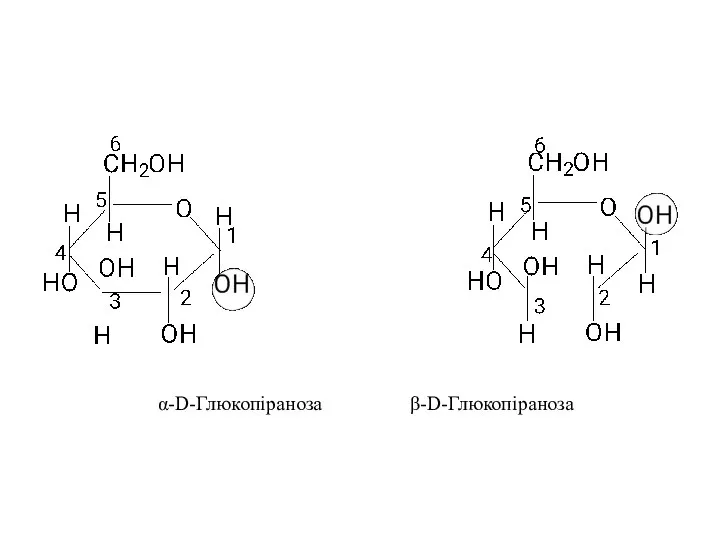
- 13. Просторову будову моносахаридів у циклічній формі зручно зображати перспективними формулами У.Хеуорса (1929). При побудові формули Хеуорса
- 14. α-D-Глюкопіраноза β-D-Глюкопіраноза
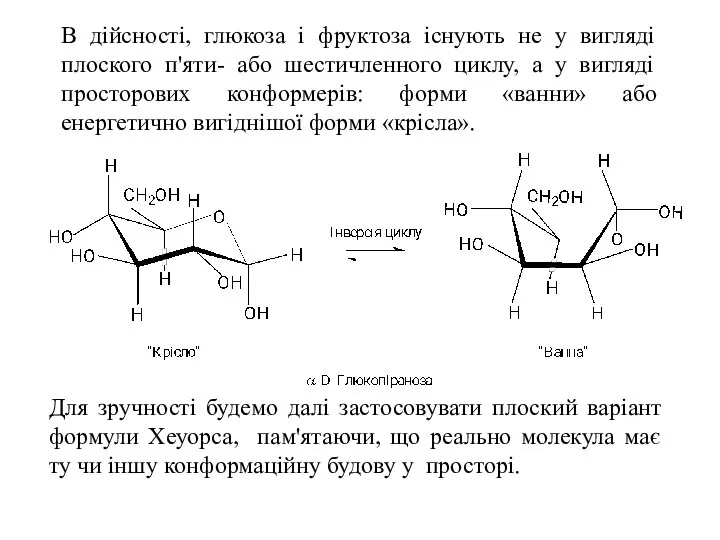
- 15. В дійсності, глюкоза і фруктоза існують не у вигляді плоского п'яти- або шестичленного циклу, а у
- 16. Утворені напівацеталі можуть мати α- і β-форми, які відрізняються положенням напівацтального гідроксилу відносно площини кільця і
- 17. За аналогією для фруктози можна написати фуранозну і піранозну формули Хеуорса α-D-Фруктофураноза β-D-Фруктофураноза
- 18. Для напівацетальних форм альдогексоз, число ізомерів зростає у два рази до 32 за рахунок появи аномерів
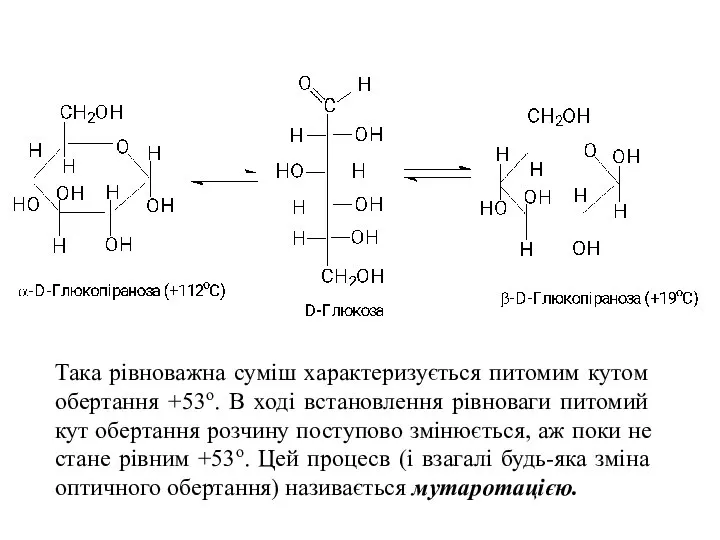
- 19. Така рівноважна суміш характеризується питомим кутом обертання +53о. В ході встановлення рівноваги питомий кут обертання розчину
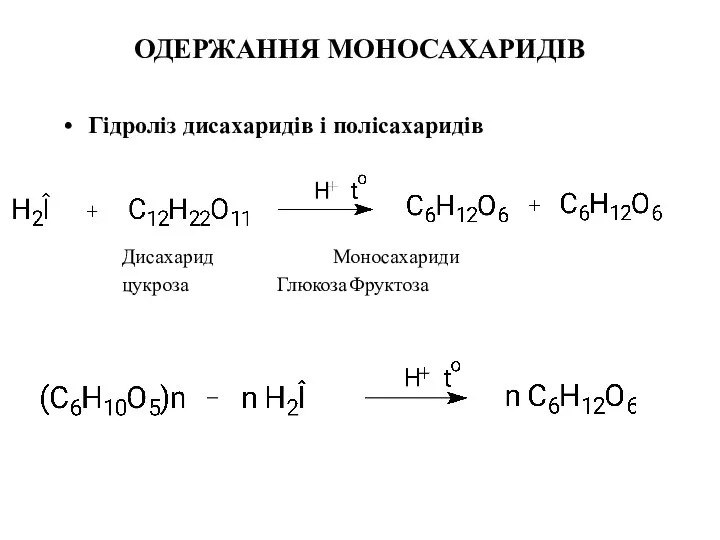
- 20. ОДЕРЖАННЯ МОНОСАХАРИДІВ Гідроліз дисахаридів і полісахаридів Дисахарид Моносахариди цукроза Глюкоза Фруктоза
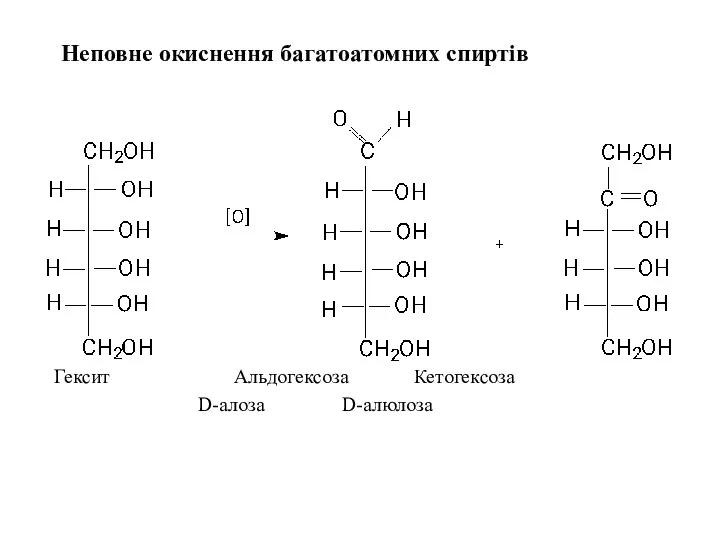
- 21. Неповне окиснення багатоатомних спиртів Гексит Альдогексоза Кетогексоза D-алоза D-алюлоза
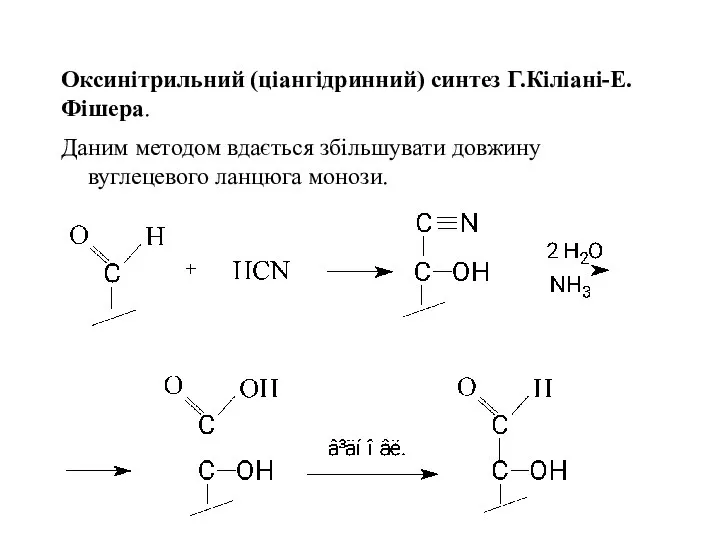
- 22. Оксинітрильний (ціангідринний) синтез Г.Кіліані-Е.Фішера. Даним методом вдається збільшувати довжину вуглецевого ланцюга монози.
- 23. Фотосинтез. В природі моносахариди утворюються внаслідок фотосинтезу в зелених рослинах
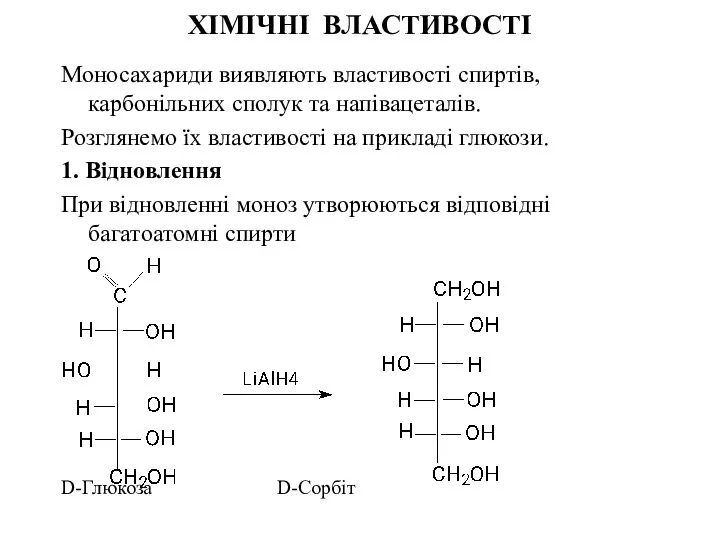
- 24. ХІМІЧНІ ВЛАСТИВОСТІ Моносахариди виявляють властивості спиртів, карбонільних сполук та напівацеталів. Розглянемо їх властивості на прикладі глюкози.
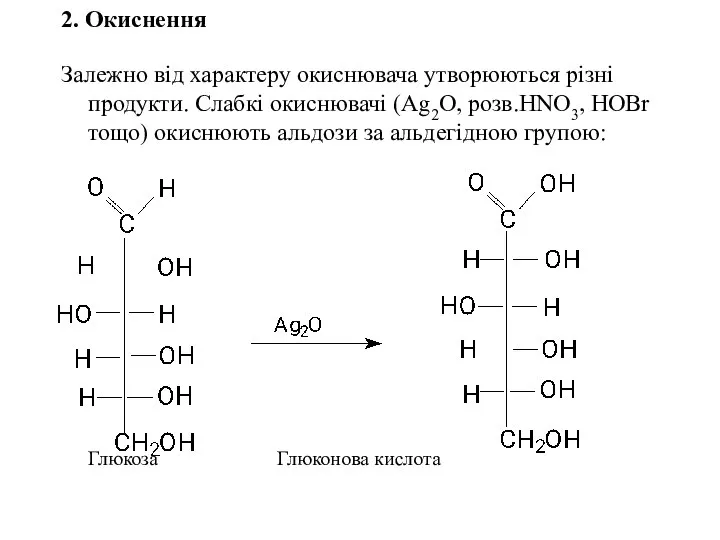
- 25. 2. Окиснення Залежно від характеру окиснювача утворюються різні продукти. Слабкі окиснювачі (Ag2O, розв.HNO3, HOBr тощо) окиснюють
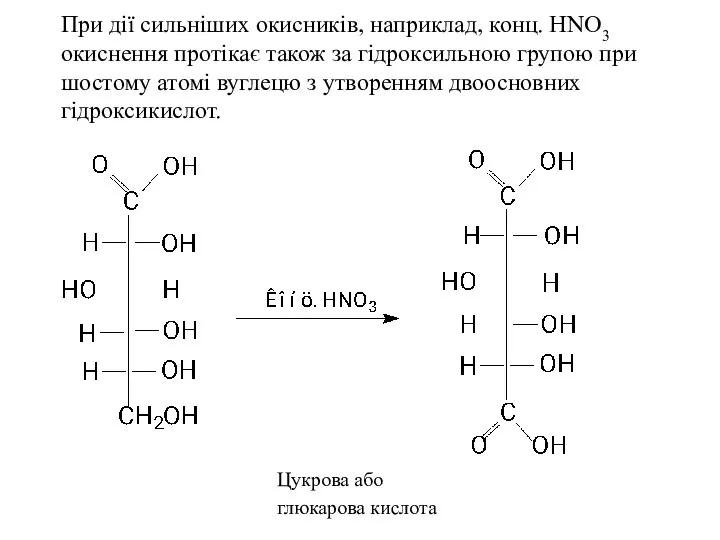
- 26. При дії сильніших окисників, наприклад, конц. HNO3 окиснення протікає також за гідроксильною групою при шостому атомі
- 27. 3. Дія лугів на моносахариди Луги за нормальних умов викликають ізомерні перетворення біля С1 і С2,
- 29. 4. Реакції алкілування одержання (повних і неповних етерів) Легко алкілується глікозидна НО-група з утворенням неповного етеру,
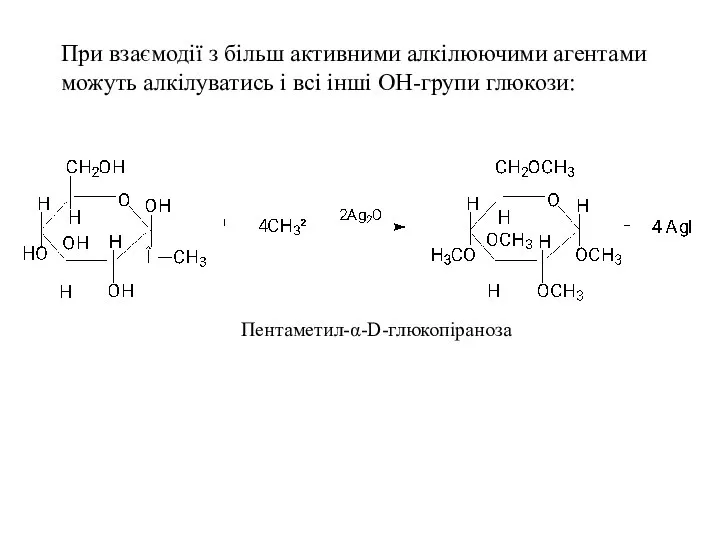
- 30. При взаємодії з більш активними алкілюючими агентами можуть алкілуватись і всі інші ОН-групи глюкози: Пентаметил-α-D-глюкопіраноза
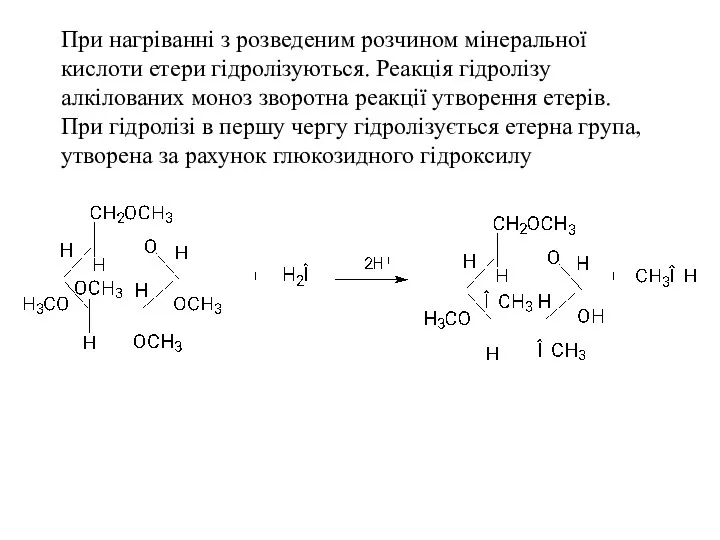
- 31. При нагріванні з розведеним розчином мінеральної кислоти етери гідролізуються. Реакція гідролізу алкілованих моноз зворотна реакції утворення
- 32. 5. Реакції ацилювання (утворення естерів) При взаємодії з ангідридами або хлорангідридами карбонових кислот утворюються естери глюкози.
- 33. 6. Бродіння 6.1. Спиртове. Для деяких гексоз характерне розщеплення молекул до спирту під дією ферментів (зимази).
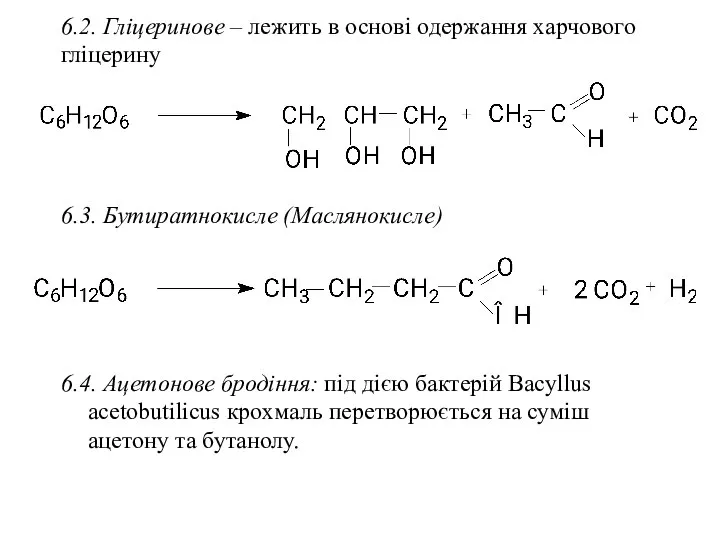
- 34. 6.2. Гліцеринове – лежить в основі одержання харчового гліцерину 6.3. Бутиратнокисле (Маслянокисле) 6.4. Ацетонове бродіння: під
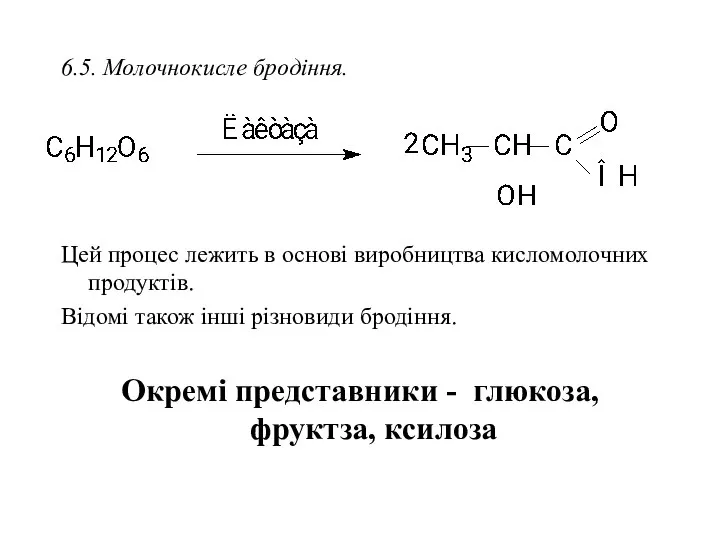
- 35. 6.5. Молочнокисле бродіння. Цей процес лежить в основі виробництва кисломолочних продуктів. Відомі також інші різновиди бродіння.
- 36. ДИСАХАРИДИ Сполуки, що складаються з двох залишків моносахаридів, з'єднаних між собою глікозидним зв’язком, називаються дисахаридами. Глікозидний
- 37. Молекула дисахариду може приєднувати молекулу води з утворенням двох молекул моносахариду. За своєю будовою дисахариди відносяться
- 38. Дисахариди бувають відновлюючі і невідновлюючі. Якщо для утворення глікозидного зв’язку використовується лише один глікозидний (напівацетальний) гідроксил,
- 39. Відновлюючі дисахариди Мальтоза (солодовий цукор) Глікозидний зв’язок в молекулі мальтози утворюється за участю гідроксилів при 1-му
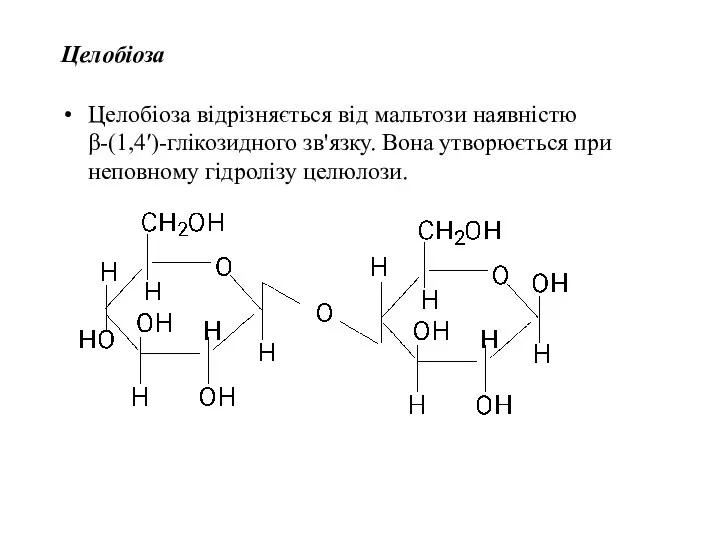
- 41. Целобіоза Целобіоза відрізняється від мальтози наявністю β-(1,4′)-глікозидного зв'язку. Вона утворюється при неповному гідролізу целюлози.
- 42. Невідновлюючі дисахариди Цукроза Цукроза є харчовим продуктом, який виділяється з цукрової тростини або буряка. Вміст цукру
- 43. Цукроза характеризується правим обертанням з питомим кутом +66о. В результаті гідролізу утворюється еквімолярна суміш глюкози (+53о)
- 44. ПОЛІСАХАРИДИ Полісахариди - високомолекулярні нецукроподібні вуглеводи. Вони являють собою продукти конденсації великого числа молекул за аналогією
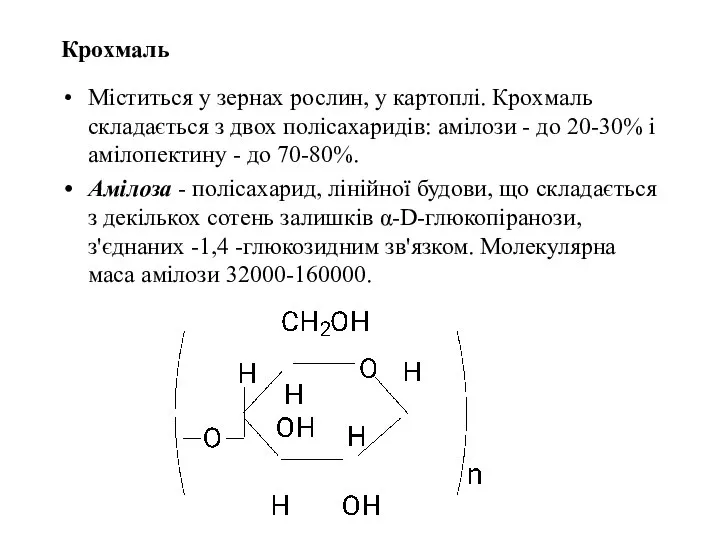
- 45. Крохмаль Міститься у зернах рослин, у картоплі. Крохмаль складається з двох полісахаридів: амілози - до 20-30%
- 46. Амілопектин – більш високомолекулярний полісахарид з розгалуженою структурою, молекулярної маси 100000-1000000. За аналогією з амілозою, залишки
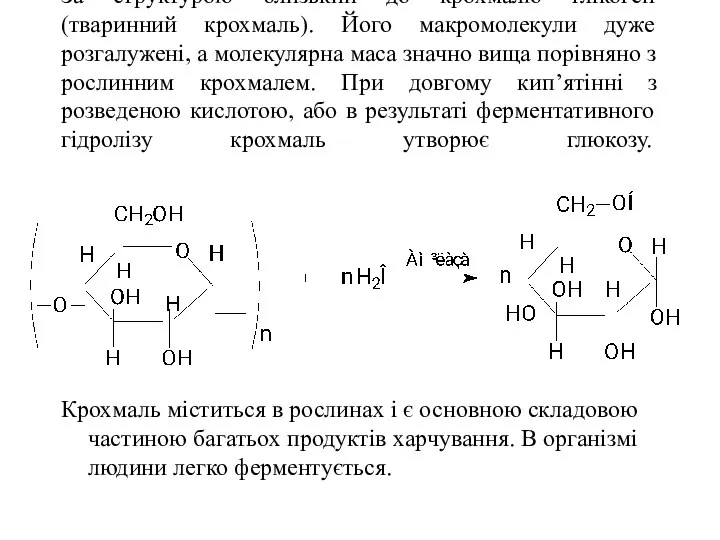
- 48. За структурою близький до крохмалю глікоген (тваринний крохмаль). Його макромолекули дуже розгалужені, а молекулярна маса значно
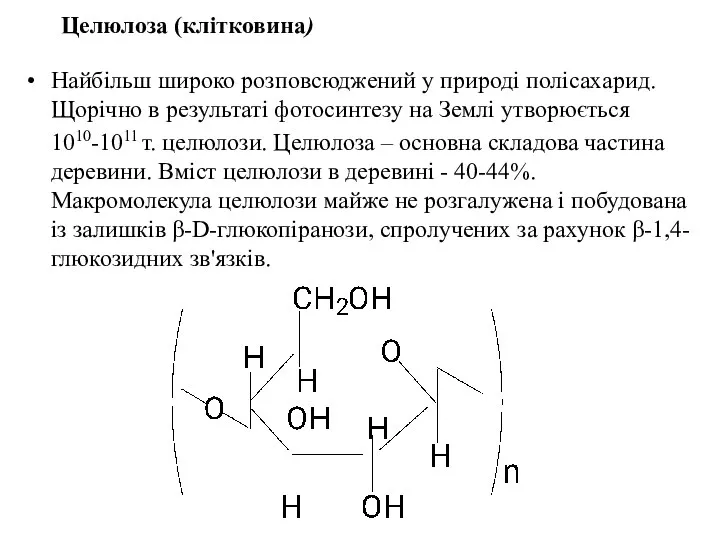
- 49. Целюлоза (клітковина) Найбільш широко розповсюджений у природі полісахарид. Щорічно в результаті фотосинтезу на Землі утворюється 1010-1011
- 50. Молекулярна маса целюлози 21000-50000. Особливості будови макромолекул целюлози є в тому, що всі НО-групи розміщені тільки
- 51. 1. Одержання віскозного волокна При обробці целюлози водним розчином лугу, а потім сірковуглецем (СS2) одержують ксантогенат
- 52. 2. Нітрування Целюлоза нітрується конц. НNO3. Реакція може протікати поступово із залученням однієї, двох або всіх
- 53. 3. Ацилювання Гідроксильні групи целюлози здатні ацилюватись ангідридами або галогенангідридами кислот. Фільєруванням ацетонового розчину триацетату целюлози
- 54. 4. Алкілування Целюлоза алкілується алкілгалогенідами або алкілсульфатами. Найпоширеніші метил-, етил- і бензилцелюлоза використовуються як основа лаків,
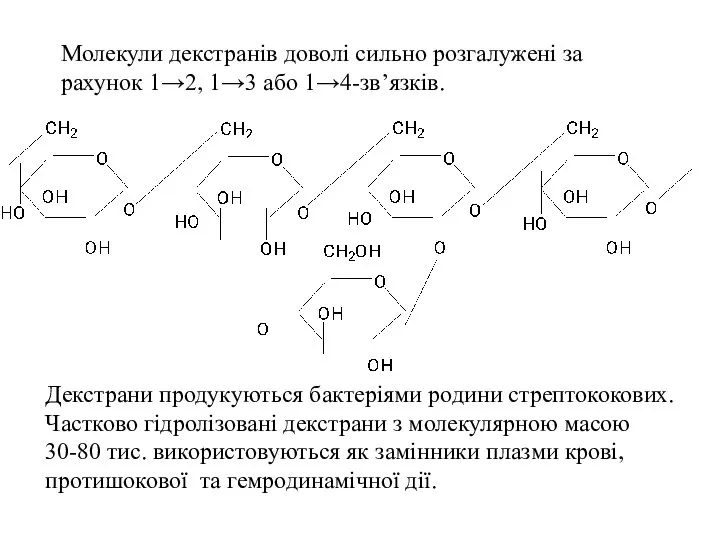
- 55. Декстрани Це полісахариди, макромолекули яких складається із залишків α-D-глюкопіранози, з’єднаних 1-6-глюкозидними зв’язками:
- 56. Молекули декстранів доволі сильно розгалужені за рахунок 1→2, 1→3 або 1→4-зв’язків. Декстрани продукуються бактеріями родини стрептококових.
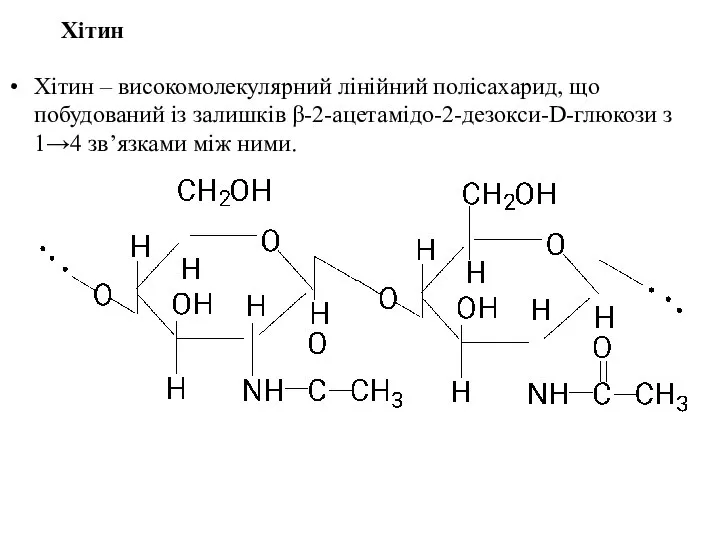
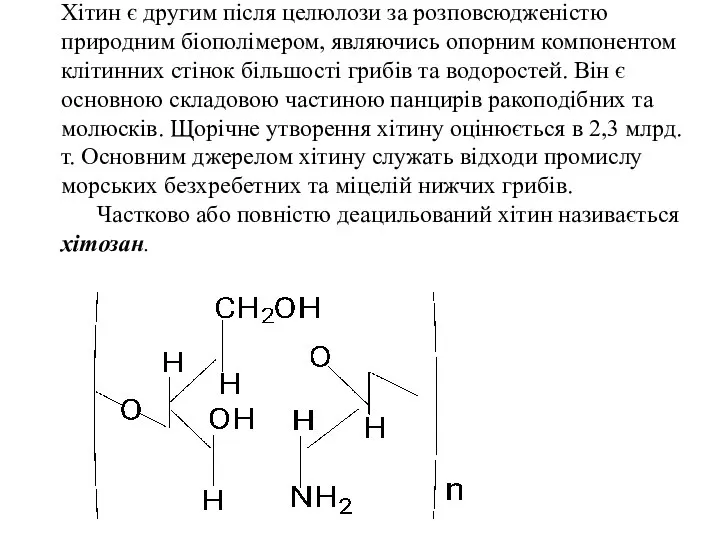
- 57. Хітин Хітин – високомолекулярний лінійний полісахарид, що побудований із залишків β-2-ацетамідо-2-дезокси-D-глюкози з 1→4 зв’язками між ними.
- 58. Хітин є другим після целюлози за розповсюдженістю природним біополімером, являючись опорним компонентом клітинних стінок більшості грибів
- 60. Скачать презентацию




































 Щелочные металлы
Щелочные металлы Химическая связь
Химическая связь Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов КАЛЬЦИЙ Ca 9 класс
КАЛЬЦИЙ Ca 9 класс Альдегиды и кетоны
Альдегиды и кетоны Основные классы неорганических соединений
Основные классы неорганических соединений Производные фенола: танины
Производные фенола: танины Основы молекулярной генетики. Генетические механизмы. Биосинтез белков и нуклеиновых кислот. (Лекция 3)
Основы молекулярной генетики. Генетические механизмы. Биосинтез белков и нуклеиновых кислот. (Лекция 3) Силикатная промышленность
Силикатная промышленность Химический КВН
Химический КВН «Волшебный» витамин или химические элементы в живой клетке
«Волшебный» витамин или химические элементы в живой клетке Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Неметаллы: атомы и простые вещества. Кислород, озон, воздух Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120
Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120  Щёлочноземельные металлы
Щёлочноземельные металлы Химические элементы космоса.
Химические элементы космоса. Алканы. Гомологический ряд
Алканы. Гомологический ряд Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Нітрати у харчових продуктах
Нітрати у харчових продуктах  Основные понятия химии
Основные понятия химии Альдегиды и кетоны
Альдегиды и кетоны Основы кристаллографии
Основы кристаллографии Ферменти
Ферменти Введение. Источники сырья для лекарственных веществ и препаратов. Понятие органический синтез. Полный органический синтез
Введение. Источники сырья для лекарственных веществ и препаратов. Понятие органический синтез. Полный органический синтез Переводной экзамен по химии «Качественные реакции в органической химии» Толмачевой Кати 11а
Переводной экзамен по химии «Качественные реакции в органической химии» Толмачевой Кати 11а Автомобильные бензины и дизельное топливо
Автомобильные бензины и дизельное топливо Ионно-координационная полимеризация
Ионно-координационная полимеризация Химические реактивы
Химические реактивы Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе.
Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе.