Содержание
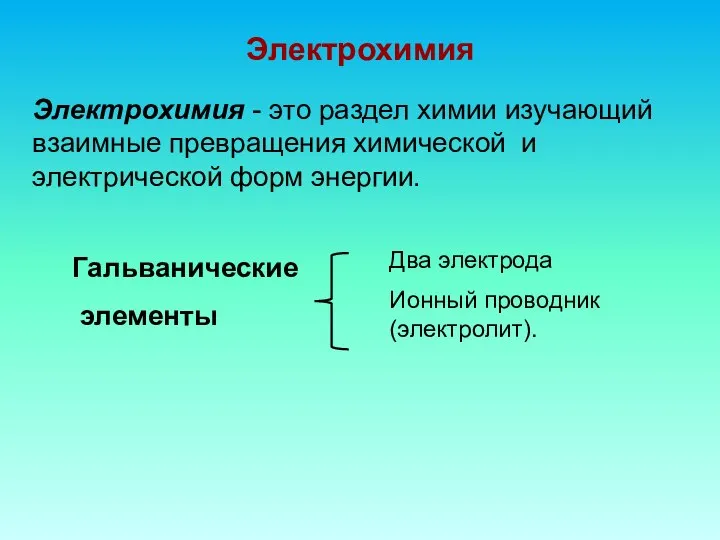
- 2. Гальванические элементы
- 3. Учебная цель: 10.2.3.4 использовать таблицу стандартных электродных потенциалов для прогнозирования возможности протекания химических реакций в водных
- 4. Электрохимия Электрохимия - это раздел химии изучающий взаимные превращения химической и электрической форм энергии. Гальванические элементы
- 5. Анод (положительно заряженный электрод) – на нем происходит окисление - отдача электронов Катод (отрицательно заряженный электрод)
- 6. Электрический потенциал - энергия, которую необходимо затратить (положительный потенциал) или которую можно получить (отрицательный потенциал) при
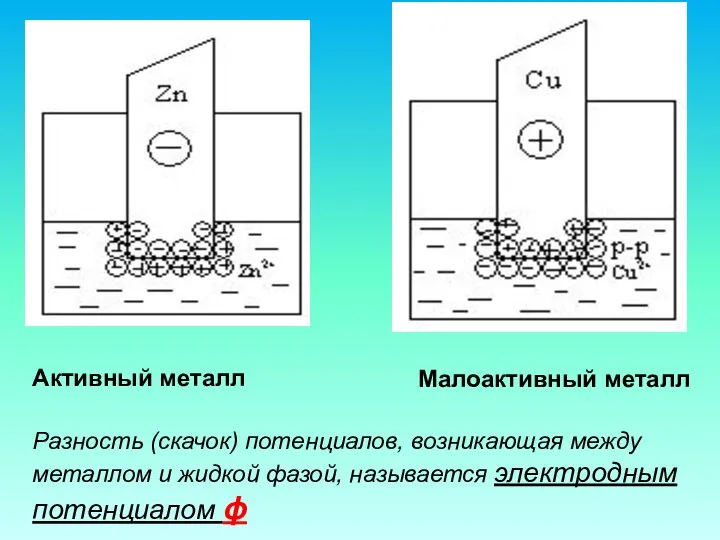
- 7. Малоактивный металл Активный металл Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой, называется электродным потенциалом
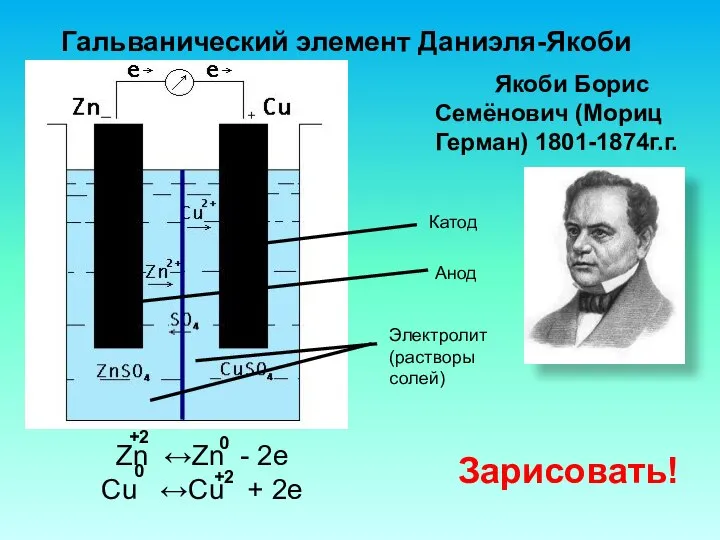
- 8. Гальванический элемент Даниэля-Якоби Якоби Борис Семёнович (Мориц Герман) 1801-1874г.г. Электролит (растворы солей) Анод Катод Зарисовать!
- 9. При работе ГЭ протекают процессы: - На аноде: Zn - 2e ↔Zn (окисление, цинк отдает электроны),
- 10. Объяснение схемы гальванического элемента Вертикальная линия - поверхность раздела между металлом и раствором, две линии —
- 11. Электродвижущая сила элемента (ЭДС) ЭДС элемента равна разности равновесных электродных потенциалов катода и анода. Е =
- 12. Электрод Реакция Е0 , В Na+/Na0 Na+ + ē → Na0 – 2,71 Mg2+/Mg0 Mg2+ +
- 13. Аккумуляторы - источники тока, в которых химическая энергия превращается в электрическую энергию, а электрическая энергия снова
- 14. Пример задачи Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в
- 15. Решение: 1. Схема данного гальванического элемента: (-) Mg׀ Mg+2 ׀ ׀ Zn+2 ׀ Zn (+) Вертикальная
- 16. 2. Магний имеет меньший потенциал (-2,37 В) и является анодом, на нем идет окисление: Mg –
- 17. 3. Уравнение окислительно-восстановительной реакции, характеризующеe работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1)
- 19. Скачать презентацию













 Липидтер. Сабынданатын және сабынданбайтын липидтер
Липидтер. Сабынданатын және сабынданбайтын липидтер Нефть. Состав и свойства
Нефть. Состав и свойства Классификация химических реакций
Классификация химических реакций Атоми і хімічні елементи. Молекули, їх рух. Дифузія
Атоми і хімічні елементи. Молекули, їх рух. Дифузія Игра - викторина
Игра - викторина Алкины
Алкины II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Кислоты
Кислоты Нуклеиновые кислоты
Нуклеиновые кислоты Основные характеристики химического равновесия:
Основные характеристики химического равновесия: Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа
Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Электролиз раствора CuSO4.
Электролиз раствора CuSO4. Ацетилен
Ацетилен Полимеры: польза или вред? Выполнила: Ученица 10 «А» класса Архипова Аятэ
Полимеры: польза или вред? Выполнила: Ученица 10 «А» класса Архипова Аятэ Phase formation rules for high entropy alloys
Phase formation rules for high entropy alloys Презентация Строение атомного ядра
Презентация Строение атомного ядра  Липиды: функции и обмен
Липиды: функции и обмен Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23)
Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23) Оксиды углерода
Оксиды углерода Роль хімії у розв`язанні екологічної проблеми Підготувала: учениця 11-А класу Житомирського міського колегіму Рачинська Мари
Роль хімії у розв`язанні екологічної проблеми Підготувала: учениця 11-А класу Житомирського міського колегіму Рачинська Мари Химическая кинетика, химическое равновесие и катализ
Химическая кинетика, химическое равновесие и катализ Презентация по Химии "Аминокислоты белки аминокислоты" - скачать смотреть
Презентация по Химии "Аминокислоты белки аминокислоты" - скачать смотреть  Ковалентная химическая связь. 11 класс
Ковалентная химическая связь. 11 класс Биохимия соединительной ткани
Биохимия соединительной ткани Мышьяк (лат. аrsenicum)
Мышьяк (лат. аrsenicum) Петрография
Петрография Презентация по Химии "Соли в медицине" - скачать смотреть
Презентация по Химии "Соли в медицине" - скачать смотреть