Содержание
- 2. Что читать? Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Ахметов Н. С. Общая
- 3. Геометрия Геометрическое (пространственное) строение – это взаимное расположение атомов в многоатомной частице, характеризуемое длинами и валентными
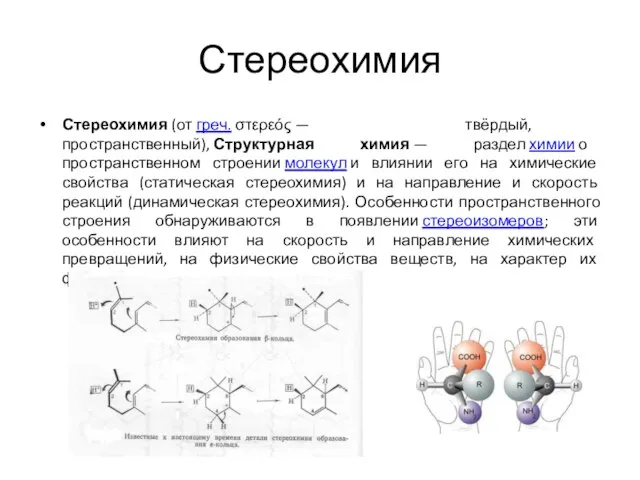
- 4. Стереохимия Стереохимия (от греч. στερεός — твёрдый, пространственный), Структурная химия — раздел химии о пространственном строении
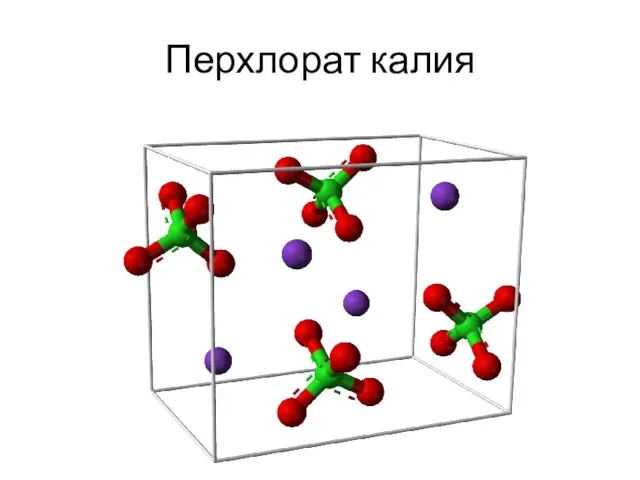
- 5. Перхлорат калия
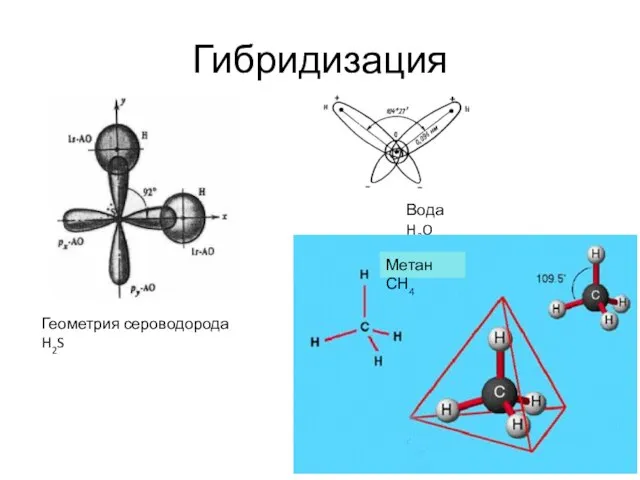
- 6. Гибридизация Геометрия сероводорода H2S Вода H2O Метан СН4
- 7. Гибридизация Гибридизацией атомных орбиталей (ГАО) называют «перемешивание» близких по энергии АО. Причина в образовании максимально возможного
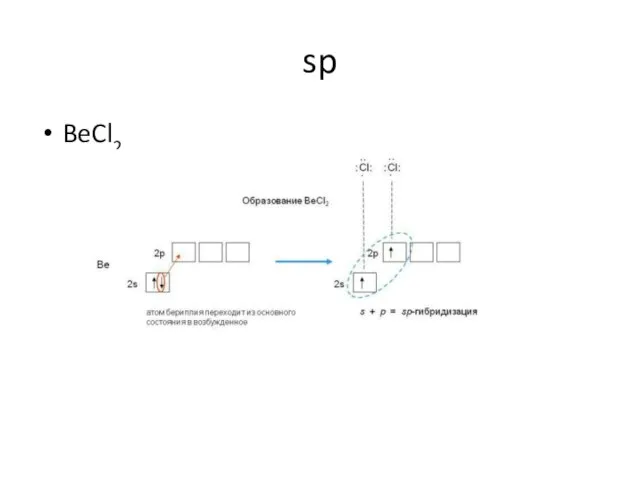
- 8. sp BeCl2
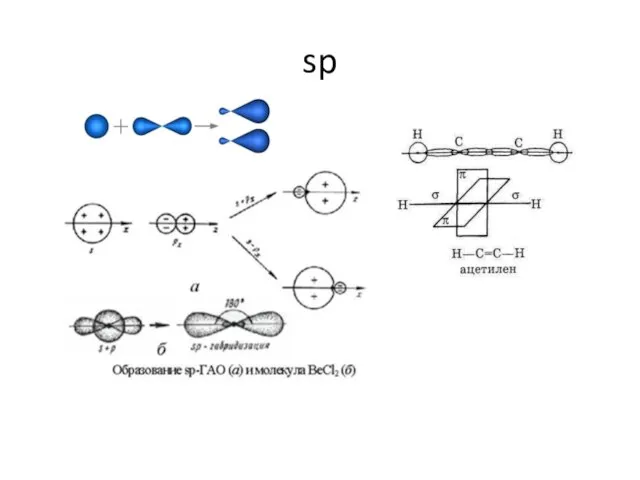
- 9. sp
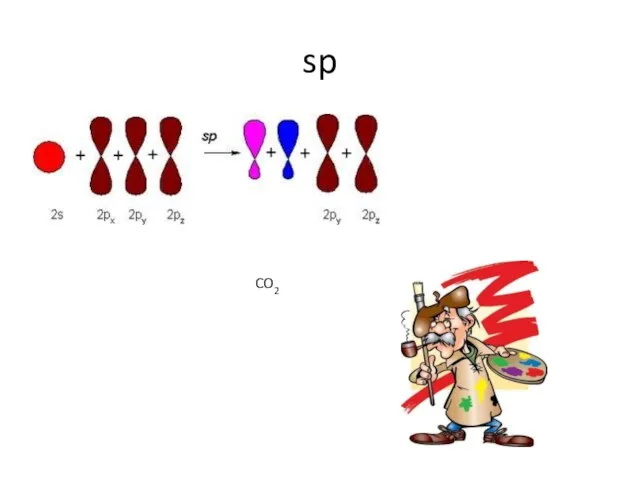
- 10. sp CO2
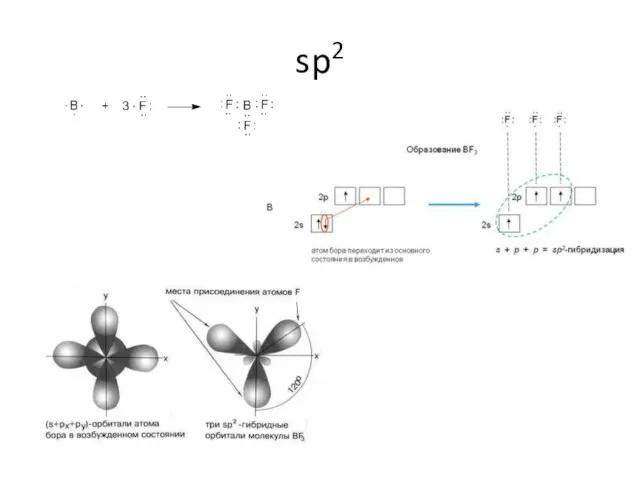
- 11. sp2
- 12. sp2
- 13. sp2
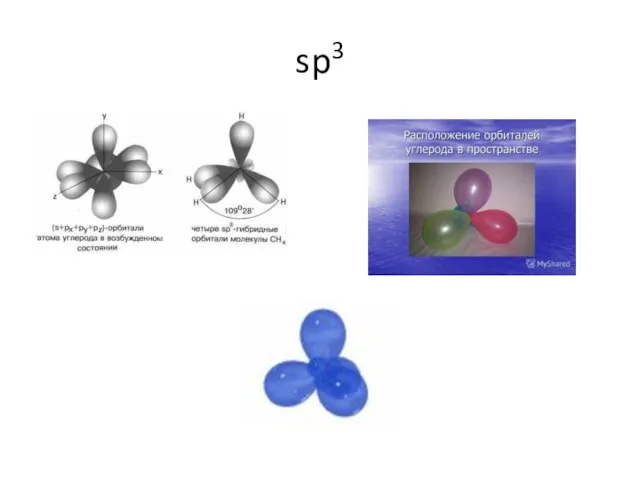
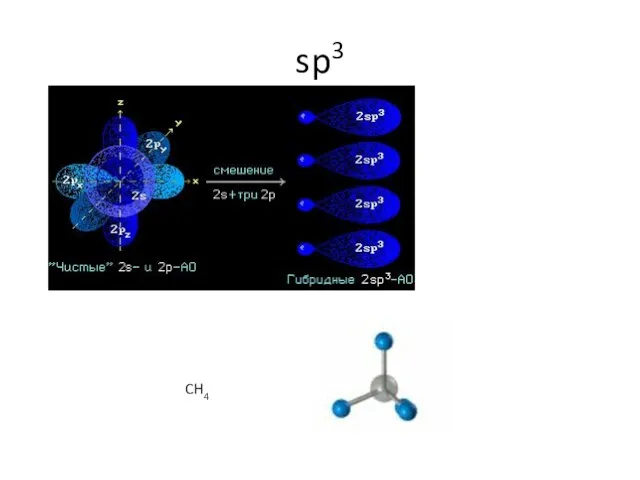
- 14. sp3
- 15. sp3 CH4
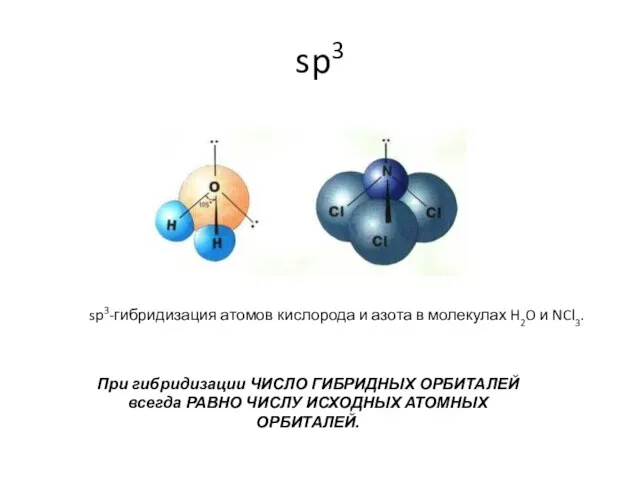
- 16. sp3 sp3-гибридизация атомов кислорода и азота в молекулах H2O и NCl3. При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ
- 17. dsp2 Тип гибридизации dsp2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона [Ni(CN)4]2-
- 18. dsp3 Устойчивый диамагнитный комплекс пентацианоникколат(II)-ион [Ni(CN)5]3- имеет форму квадратной пирамиды:
- 19. d2sp3 Октаэдрический комплекс никеля(II) [Ni(H2O)6]2+, хотя и парамагнитен, но достаточно устойчив. Его образование обусловленоsp3d2-гибридизацией атомных орбиталей
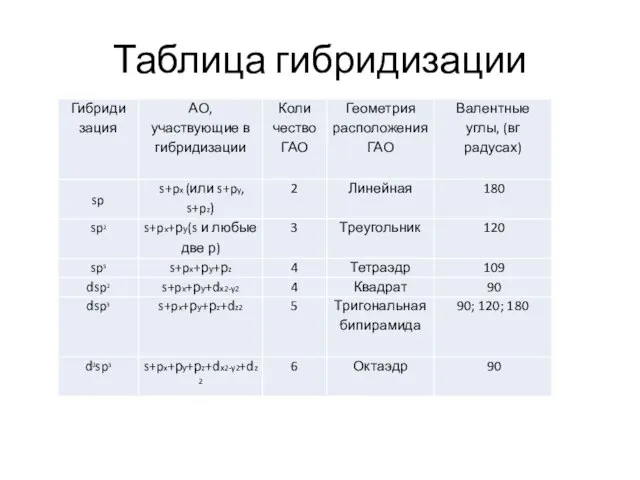
- 20. Таблица гибридизации
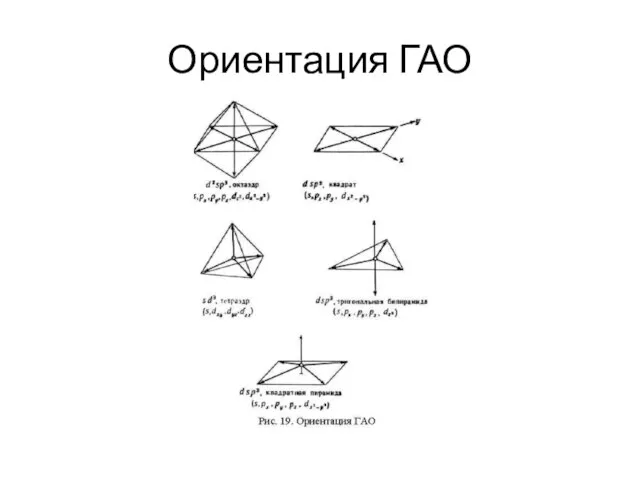
- 21. Ориентация ГАО
- 22. Метод Гиллеспи (1953) Роналд Джеймс Гиллеспи родился 21 августа 1924 года, Лондон
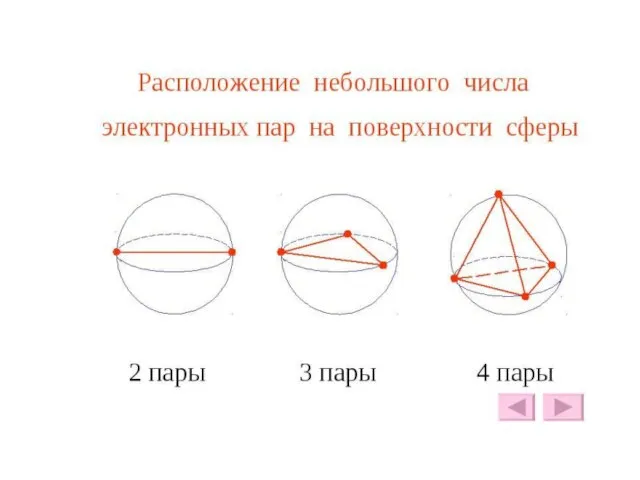
- 23. НП, СП НП-НП – очень не выгодное соседство (90о) НП- СП – не выгодное соседство (90о)
- 26. AB
- 27. AB2Ex
- 28. AB3Ex
- 29. AB4Ex
- 30. AB5Ex
- 31. AB6Ex
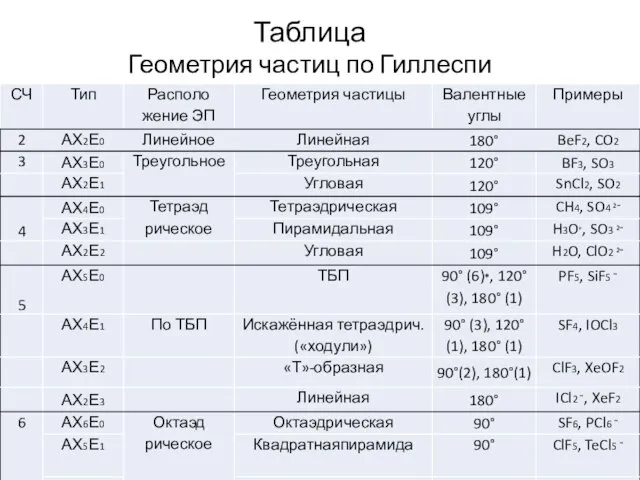
- 32. Таблица Геометрия частиц по Гиллеспи
- 34. Алгоритм Алгоритм определения геометрии частицы по методу Гиллеспи (рассмотрим на примере SО2): Исходя из электронных конфигураций
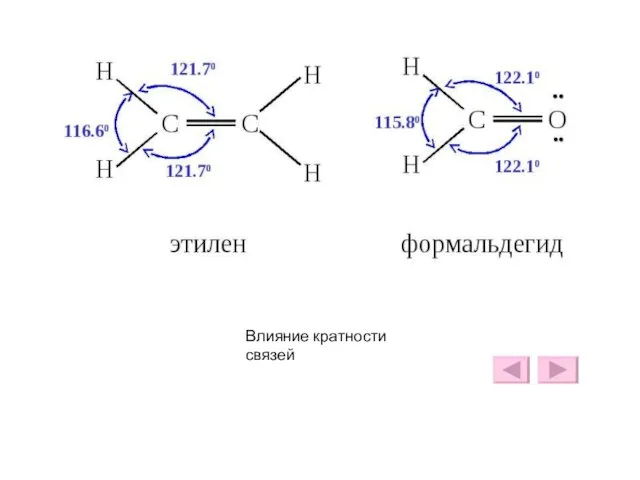
- 35. Влияние кратности связей
- 36. Пример 1
- 37. Пример 2
- 38. Пример 3
- 39. Мостиковые атомы
- 40. Пример
- 41. Силикаты
- 42. Полярность молекул
- 44. Скачать презентацию





![dsp3 Устойчивый диамагнитный комплекс пентацианоникколат(II)-ион [Ni(CN)5]3- имеет форму квадратной пирамиды:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/515653/slide-17.jpg)
![d2sp3 Октаэдрический комплекс никеля(II) [Ni(H2O)6]2+, хотя и парамагнитен, но достаточно устойчив.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/515653/slide-18.jpg)


















 Квест с Гарри Поттером
Квест с Гарри Поттером Мило. Мийні засоби
Мило. Мийні засоби Презентация по Химии "Первоначальные химические понятия" - скачать смотреть
Презентация по Химии "Первоначальные химические понятия" - скачать смотреть  Структура периодической системы элементов
Структура периодической системы элементов Теория создание стекла, оптические кристаллы
Теория создание стекла, оптические кристаллы Композиты. Полимерные композиционные материалы
Композиты. Полимерные композиционные материалы Альдегиды
Альдегиды Металлические сплавы
Металлические сплавы Минералы
Минералы Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Гормоны. Виды и классификация гормонов
Гормоны. Виды и классификация гормонов Хлор
Хлор Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Нефть. Свойства нефти
Нефть. Свойства нефти Алкины
Алкины Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Технология производства химических волокон. Свойства химических волокон. 7 класс
Технология производства химических волокон. Свойства химических волокон. 7 класс Біохімічний склад кормів - первинний показник їх технологічної й продуктивної можливості
Біохімічний склад кормів - первинний показник їх технологічної й продуктивної можливості Физико-химические методы анализа
Физико-химические методы анализа Введение в органическую химию
Введение в органическую химию Возможные роли АФК в старении
Возможные роли АФК в старении Химические свойства оксидов
Химические свойства оксидов Амины. Номенклатура аминов
Амины. Номенклатура аминов Vodík
Vodík History of radioactivity
History of radioactivity История появления новогодней открытки
История появления новогодней открытки