Содержание
- 2. Учебные пособия Основные: Козлов В.Д. Введение в геохимию. Издательство ИрГТУ, 2005, 2013. Для дополнительного изучения: Сауков
- 3. Цели и задачи курса Дать представление:
- 4. Геохимия как наука В переводе с греческого термин геохимия означает науку о химии Земли. Впервые этот
- 5. Предпосылки возникновения Открытие периодического закона Д.И.Менделеевым; Синтез минералов и моделирование природных условий минералообразования (В.И.Вернандский, В.М.Гольдшмидт); Создание
- 6. Основоположники геохимии Кларк Франк Уиглсуорт (1847-1931) Американский ученый-химик, заведующий химической лаборатории геологической службы США. Первым начал
- 7. Основоположники геохимии Вернадский Владимир Иванович (1863-1945) Выдающийся русский ученый. Создал генетическую минералогию. Создал геохимию как науку,
- 8. Основоположники геохимии Ферсман Александр Евгеньевич (1883-1945) Выдающийся советский ученый. Выделил главные факторы контролирующие поведение химических элементов
- 9. Основоположники геохимии Гольдшмидт Виктор Мориц (1888-1947) Выдающийся норвежский ученый. Основоположник кристаллохимического и физико-химического направления в геохимии.
- 10. цели и задачи геохимии «…Главная задача геохимии – изучение количественного состава планеты…». Кларк Ф.У. «…Важная задача
- 11. Определение состава геологических оболочек Земли и слагающих ее геологических объектов. Изучение причин и закономерностей миграции атомов
- 12. Разделы геохимии Для изучения различных оболочек Земли и протекающих в них процессах выделяются: Атмогеохимия – изучает
- 13. Образование и распространенность химических элементов «…Геохимия изучает историю химических элементов – атомов в земной коре и
- 14. Гипотеза большого взрыва Согласно гипотезе, зарождение всей Вселенной было связано с Большим Взрывом (БВ), 12,5-14 миллиардов
- 15. Пылево-газовая туманность Потенциальные источники вещества для образования звездных систем
- 16. Вселенная Вселенная состоит из множества галактик, триллионов отдельных звезд. Первоначальный радиус Вселенной оценивается в 15 млн.
- 17. Строение атомных ядер Согласно современным представлениям квантовой физики атом имеет «гелиоцентрическое» строение. В центре атома расположено
- 18. Открытие Г. Мозли В 1913г. английский физик Г. Мозли ввел термин атомный номер химического элемента. Заряды
- 19. Изотопы В ядре атома протоны и нейтроны связаны соотношением: A = Z + N А –
- 20. Изотопы Следовательно, изотопы одного элемента, обладая одинаковыми зарядом ядра, различаются их атомными весами. 15О - 8
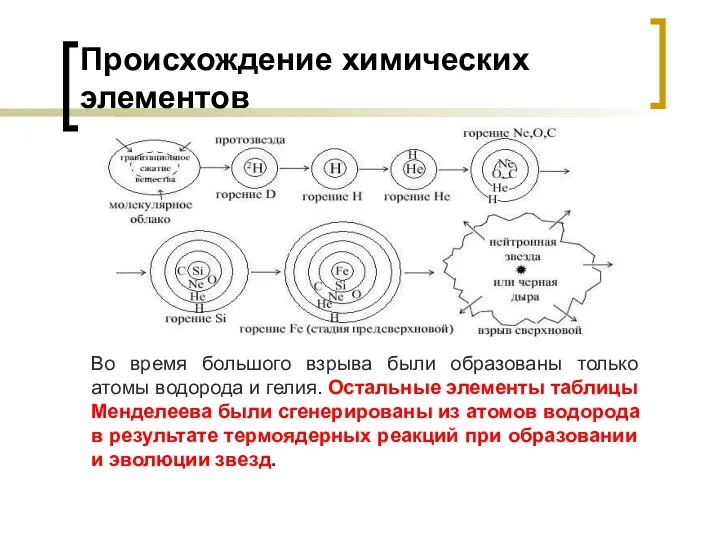
- 21. Происхождение химических элементов Во время большого взрыва были образованы только атомы водорода и гелия. Остальные элементы
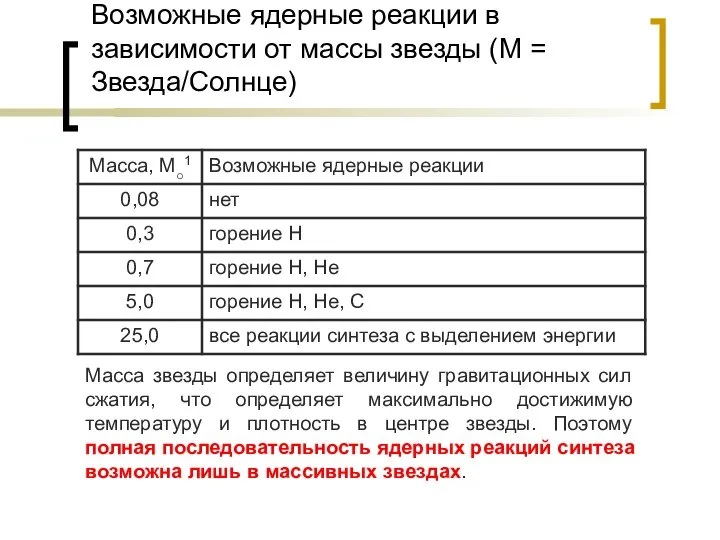
- 22. Возможные ядерные реакции в зависимости от массы звезды (М = Звезда/Солнце) Масса звезды определяет величину гравитационных
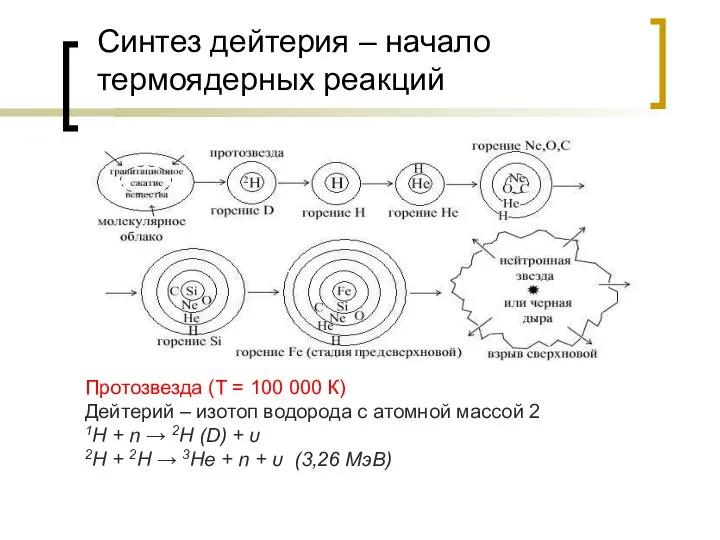
- 23. Синтез дейтерия – начало термоядерных реакций Протозвезда (Т = 100 000 К) Дейтерий – изотоп водорода
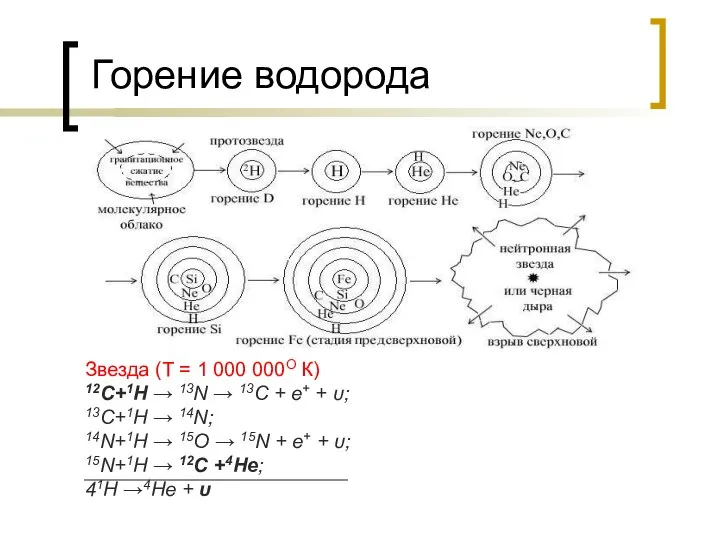
- 24. Горение водорода Звезда (Т = 1 000 000О К) 12C+1H → 13N → 13C + e+
- 25. Дефект массы Реальная масса изотопов всегда несколько меньше, чем если их составлять из атомов водорода. Эта
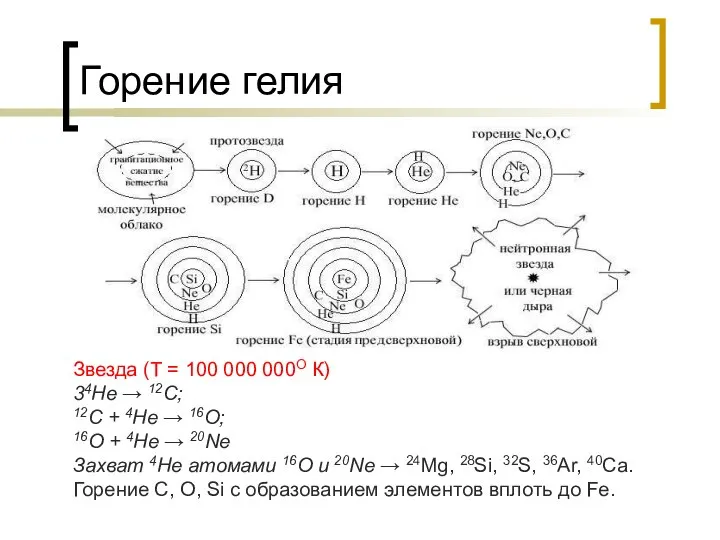
- 26. Горение гелия Звезда (Т = 100 000 000О К) 34He → 12C; 12C + 4He →
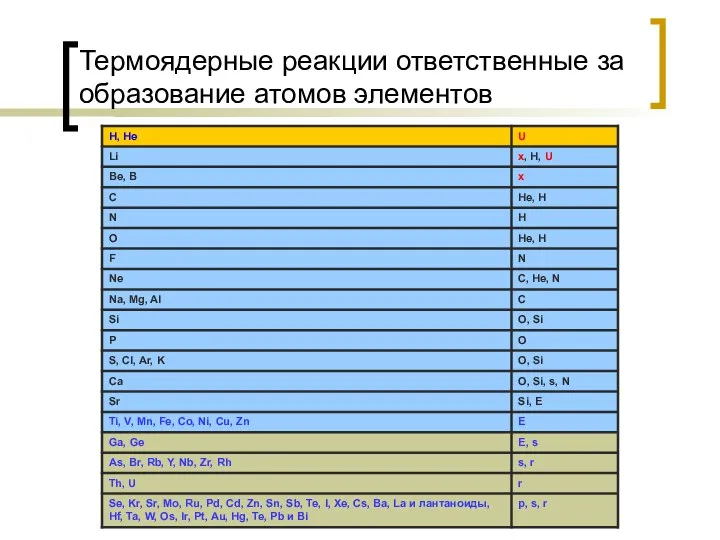
- 27. Термоядерные реакции ответственные за образование атомов элементов
- 29. Скачать презентацию




















 Автоматизация производства жидкой углекислоты
Автоматизация производства жидкой углекислоты Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment
Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment Дисперсные системы
Дисперсные системы Презентация по Химии "Неорганические кислоты" - скачать смотреть
Презентация по Химии "Неорганические кислоты" - скачать смотреть  Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Влияние условий на скорость химической реакции
Влияние условий на скорость химической реакции Оксиды Na
Оксиды Na Презентация по Химии "Формы Выделения минералов" - скачать смотреть
Презентация по Химии "Формы Выделения минералов" - скачать смотреть  Современные средства поражений Их краткая характеристика Поражающие факторы
Современные средства поражений Их краткая характеристика Поражающие факторы  Обобщение и систематизация знаний по теме Спирты и фенолы
Обобщение и систематизация знаний по теме Спирты и фенолы Коррозия, как источник загрязнения окружающей среды
Коррозия, как источник загрязнения окружающей среды Хімічні формули
Хімічні формули Исследование состава и свойств молока
Исследование состава и свойств молока Минералдар және олардың агрегаттарының морфологиясы. Минералдарды жүйелеуінің негізі
Минералдар және олардың агрегаттарының морфологиясы. Минералдарды жүйелеуінің негізі Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон Д.И. Менделеева (лекция 3) Тесты для самопроверки
Тесты для самопроверки Индикаторный метод титрования
Индикаторный метод титрования Побутові хімікати
Побутові хімікати Углерод и его соединения
Углерод и его соединения Вуглеводи
Вуглеводи Газоанализаторы. Измерительный прибор для определения качественного и количественного состава смесей газов
Газоанализаторы. Измерительный прибор для определения качественного и количественного состава смесей газов Предмет органической химии. Основные понятия. Лекция 1
Предмет органической химии. Основные понятия. Лекция 1 Химические свойства солей
Химические свойства солей Презентация по Химии "Ковалентная неполярная связь" - скачать смотреть
Презентация по Химии "Ковалентная неполярная связь" - скачать смотреть  Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Лекарственные средства, производные пиримидина, производные барбитуровой кислоты. (Тема 4)
Лекарственные средства, производные пиримидина, производные барбитуровой кислоты. (Тема 4) Презентация по Химии "Презентация Золото" - скачать смотреть
Презентация по Химии "Презентация Золото" - скачать смотреть  Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ