Содержание
- 2. Гидролиз по аниону Na2SiO3 + H2O → Молекулярный вид: Гидролиз по катиону не идет: Гидролиз по
- 3. Гидролиз по катиону CuSO4 + H2O → Молекулярный вид: Гидролиз по аниону не идет: Гидролиз по
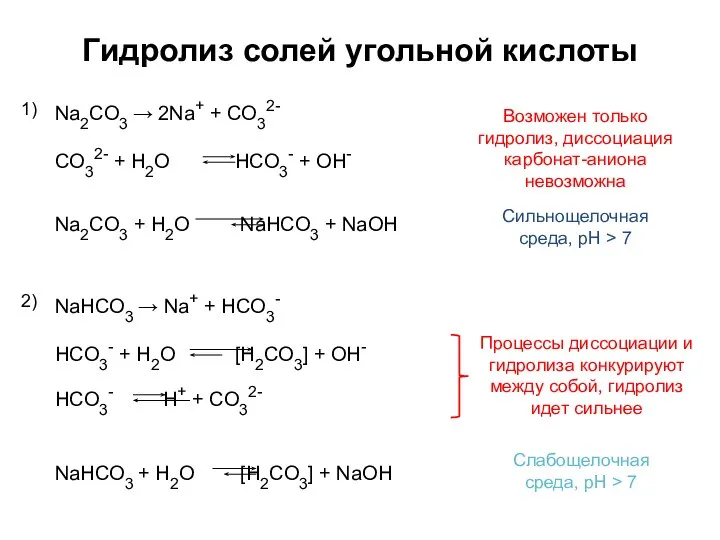
- 4. Гидролиз солей угольной кислоты Na2СO3 → 2Na+ + СO32- 1) Сильнощелочная среда, pH > 7 NaHСO3
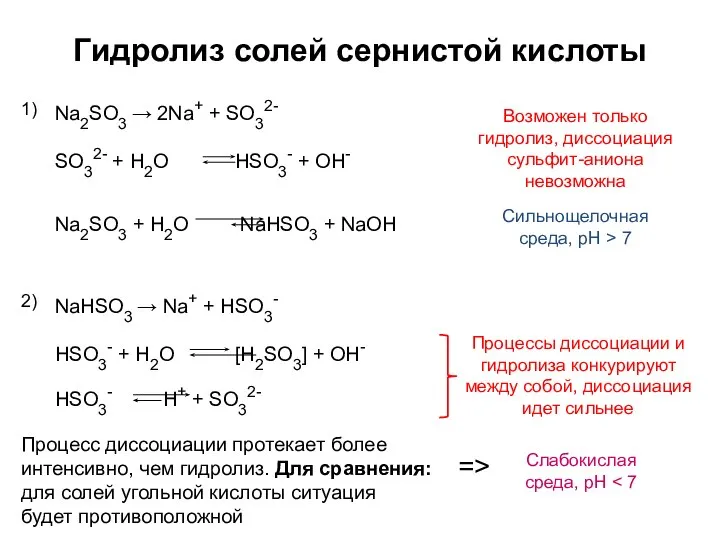
- 5. Гидролиз солей сернистой кислоты Na2SO3 → 2Na+ + SO32- 1) Сильнощелочная среда, pH > 7 NaHSO3
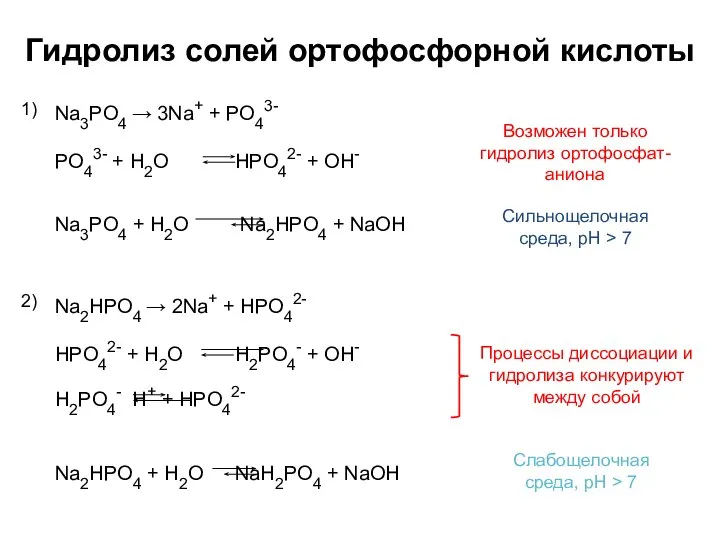
- 6. Гидролиз солей ортофосфорной кислоты Na3PO4 → 3Na+ + PO43- 1) Сильнощелочная среда, pH > 7 Na2HPO4
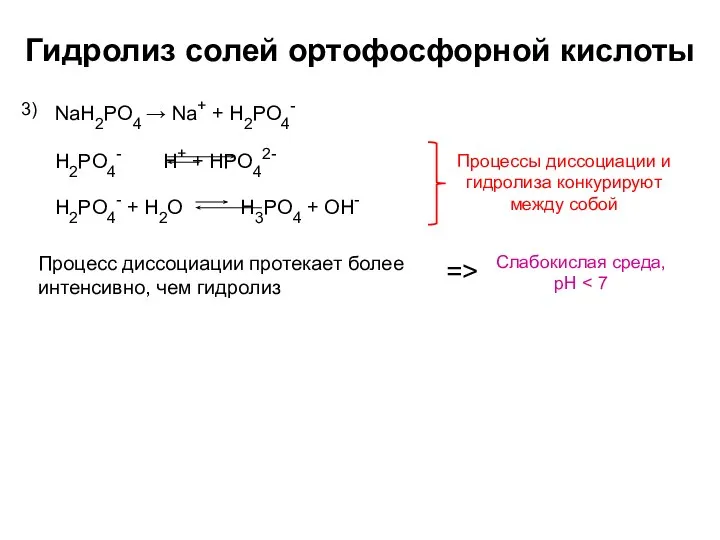
- 7. Гидролиз солей ортофосфорной кислоты NaH2PO4 → Na+ + H2PO4- 3) Слабокислая среда, pH Процесс диссоциации протекает
- 8. Необратимый гидролиз Необратимый гидролиз протекает в пяти случаях: 2) Когда протекает ОВР сопропорционирования водорода H+1 из
- 9. Гидролиз по одному иону при нагревании 1) При нагревании растворов солей, гидролизующихся по одному иону, гидролиз
- 10. Гидролиз гидридов металлов 2) При гидролизе гидридов металлов образуется молекулярный водород и соединение металла, устойчивое в
- 11. Гидролиз «солей» очень слабых кислот 3) Гидролизуются солеообразные соединения, образованные кислотами, гораздо более слабыми, чем вода
- 12. Гидролиз «солей» очень слабых кислот 3) Гидролизуются солеообразные соединения, образованные кислотами, гораздо более слабыми, чем вода
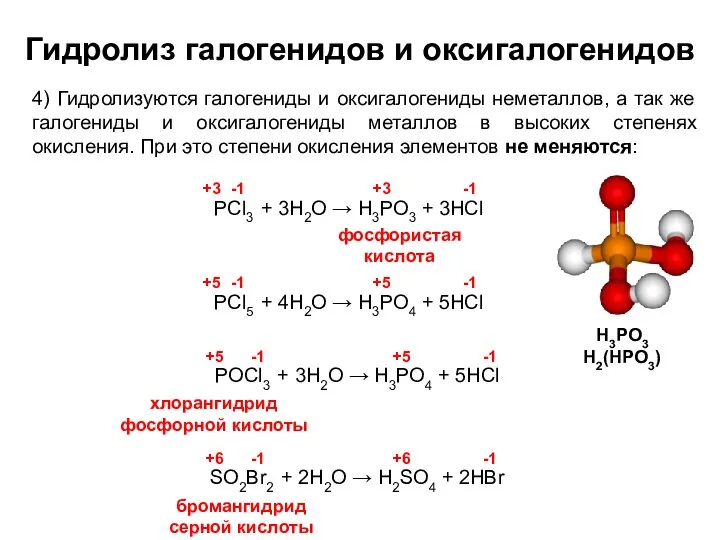
- 13. Гидролиз галогенидов и оксигалогенидов 4) Гидролизуются галогениды и оксигалогениды неметаллов, а так же галогениды и оксигалогениды
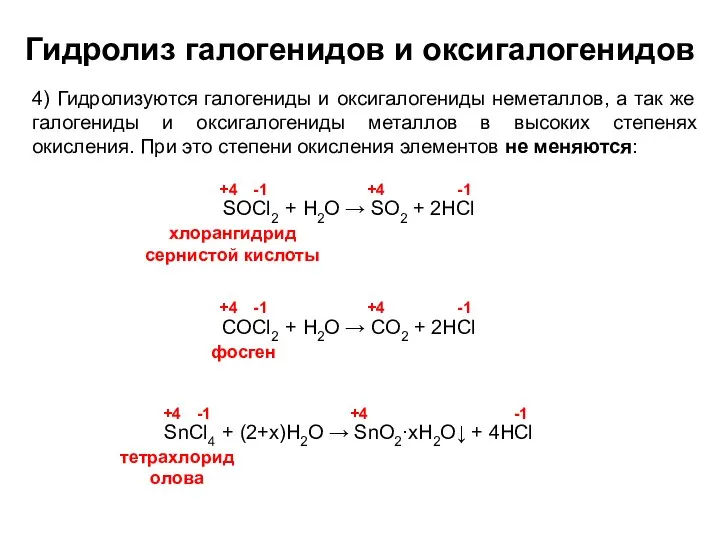
- 14. Гидролиз галогенидов и оксигалогенидов 4) Гидролизуются галогениды и оксигалогениды неметаллов, а так же галогениды и оксигалогениды
- 15. Двойной гидролиз K2S + AlCl3 + H2O → 3K2S + 2AlCl3 + 6H2O → 2Al(OH)3↓ +
- 16. Двойной гидролиз – особый случай CuCl2 + Na2CO3 + H2O → Катионы гидроксомеди (II) связываются карбонат-анионами
- 17. Двойной гидролиз – особый случай CuCl2 + Na2CO3 + H2O → 2CuCl2 + 2Na2CO3 + H2O
- 18. Двойной гидролиз – определение итоговой среды раствора CH3COONH4 Kа(CH3COOH) = 1,75·10-5 Kb(NH3·H2O) = 6,3·10-5
- 19. «Неорганический сад» Выпадают продукты совместного гидролиза солей по катиону по силикат-аниону
- 20. «Неорганический сад»
- 21. Сравнение силы кислот и оснований Чем сильнее кислота, тем его сопряженное основание слабее. Сильная кислота –
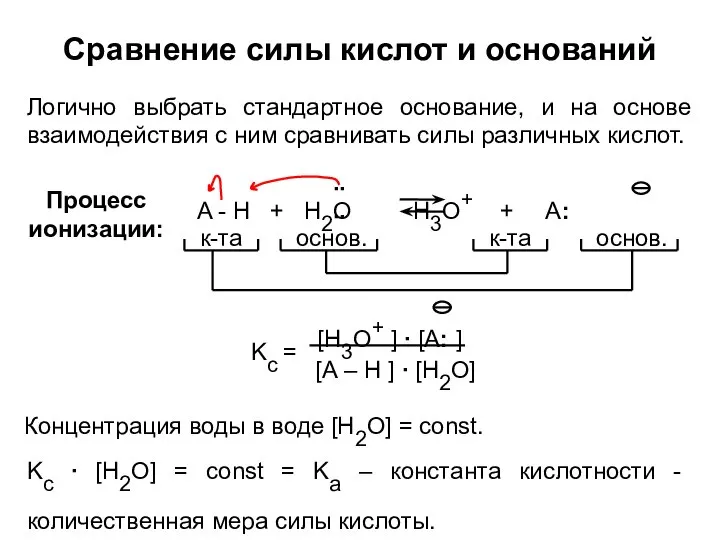
- 22. Сравнение силы кислот и оснований Логично выбрать стандартное основание, и на основе взаимодействия с ним сравнивать
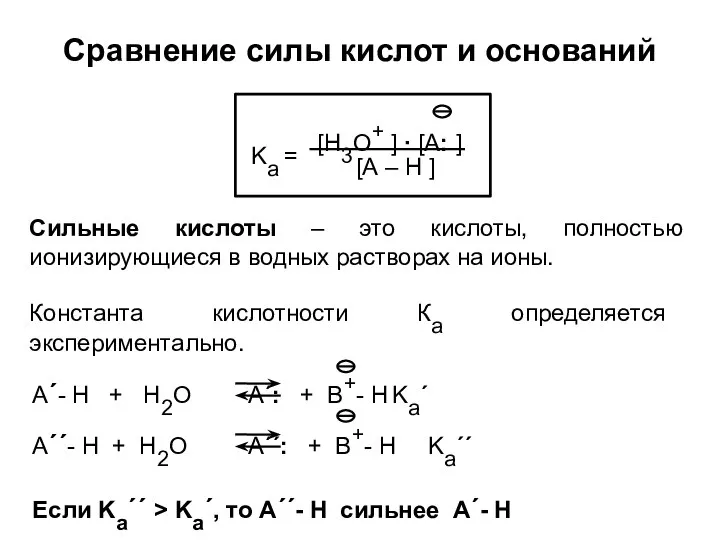
- 23. Сравнение силы кислот и оснований Сильные кислоты – это кислоты, полностью ионизирующиеся в водных растворах на
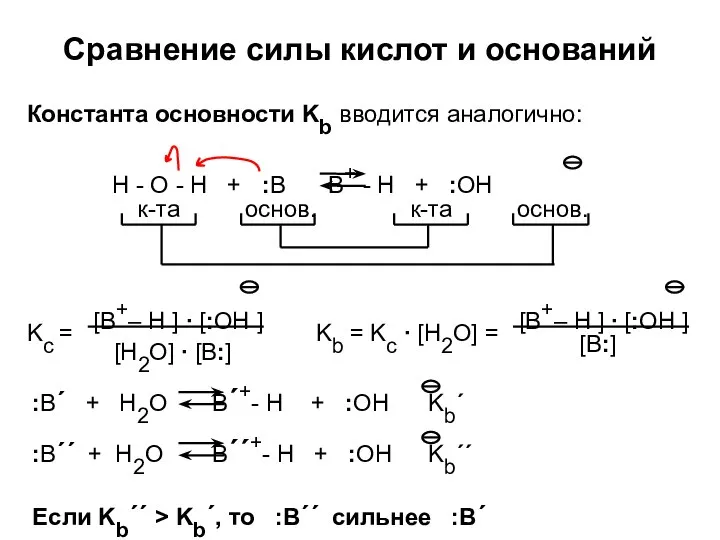
- 24. Сравнение силы кислот и оснований Константа основности Kb вводится аналогично: Если Kb´´ > Kb´, то :B´´
- 25. Двойной гидролиз – определение итоговой среды раствора CH3COONH4 Kа(CH3COOH) = 1,75·10-5 Kb(NH3·H2O) = 6,3·10-5 Среда слабощелочная,
- 27. Скачать презентацию















 Основы легирования стали. Классификация и маркировка легированных сталей
Основы легирования стали. Классификация и маркировка легированных сталей Презентация по Химии "ВУГЛЕВОДИ" - скачать смотреть бесплатно
Презентация по Химии "ВУГЛЕВОДИ" - скачать смотреть бесплатно Применение аммиака и солей аммония
Применение аммиака и солей аммония Амины
Амины Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Использование ядерных излучений для получения химической информации. (Лекция 10)
Использование ядерных излучений для получения химической информации. (Лекция 10) Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Идентификация органических веществ
Идентификация органических веществ Нуклеиновые кислоты
Нуклеиновые кислоты Строение атома
Строение атома Стекло, его происхождение и значение в жизни человека
Стекло, его происхождение и значение в жизни человека Главные отличительные черты алмаза
Главные отличительные черты алмаза Установка пиролиза широкой фракции, легких углеводородов
Установка пиролиза широкой фракции, легких углеводородов Эффект Вавилова — Черенкова
Эффект Вавилова — Черенкова Щелочные металлы
Щелочные металлы Химические реакции полимеров
Химические реакции полимеров Химия и организм человека
Химия и организм человека Анодные реакции коррозионного процесса
Анодные реакции коррозионного процесса Химия гетероциклических соединений
Химия гетероциклических соединений Алкадиены - углеводороды
Алкадиены - углеводороды Голод не тётка?
Голод не тётка? Механизм действия гидрофильных и липофильных гормонов. (Лекция 11)
Механизм действия гидрофильных и липофильных гормонов. (Лекция 11) Современные проблемы химии. Межфакультетский курс для студентов
Современные проблемы химии. Межфакультетский курс для студентов Современные методы поиска химической информации
Современные методы поиска химической информации Химия биогенных элементов. Лекция 14
Химия биогенных элементов. Лекция 14 Презентация по химии Химия в повседневной жизни человека
Презентация по химии Химия в повседневной жизни человека  Проверка подчинения растворов закону Бугера-Ламберта-Бера
Проверка подчинения растворов закону Бугера-Ламберта-Бера Жартылый өткізгіштікке ие химиялық элементтер
Жартылый өткізгіштікке ие химиялық элементтер