Содержание
- 2. Общие понятия Гидролиз (от греч. hydro – «вода» и lisis – «разложение», «распад») – реакция обменного
- 3. ☼ ☼ Гидролиз органических веществ 16.01.2019 используют для установления строения сложных веществ используют для получения веществ
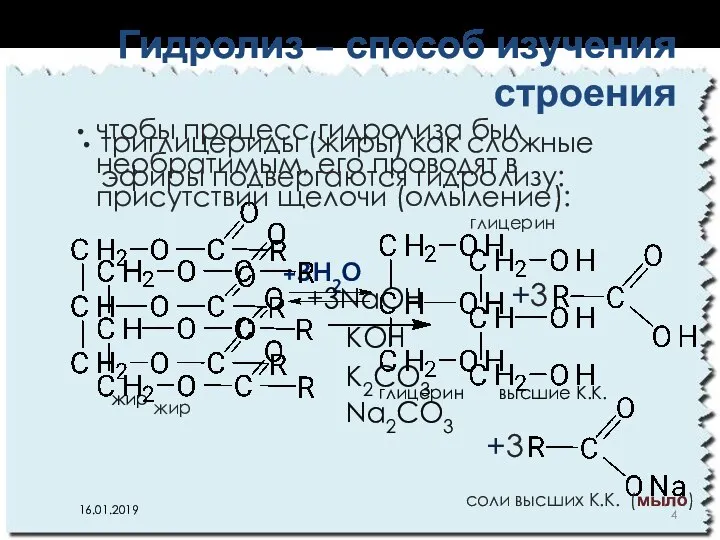
- 4. триглицериды (жиры) как сложные эфиры подвергаются гидролизу: Гидролиз – способ изучения строения глицерин высшие К.К. жир
- 5. Гидролиз – способ изучения строения гидролиз белков под действием растворов кислот – метод исследования их состава;
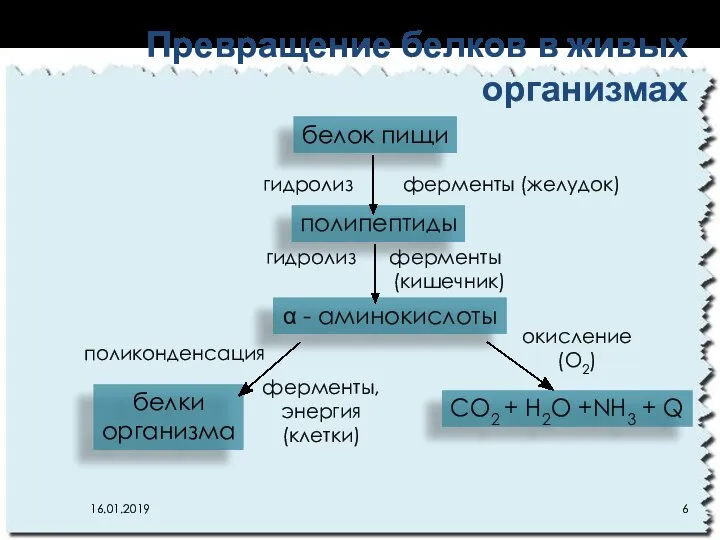
- 6. Превращение белков в живых организмах белок пищи полипептиды α - аминокислоты CO2 + H2O +NH3 +
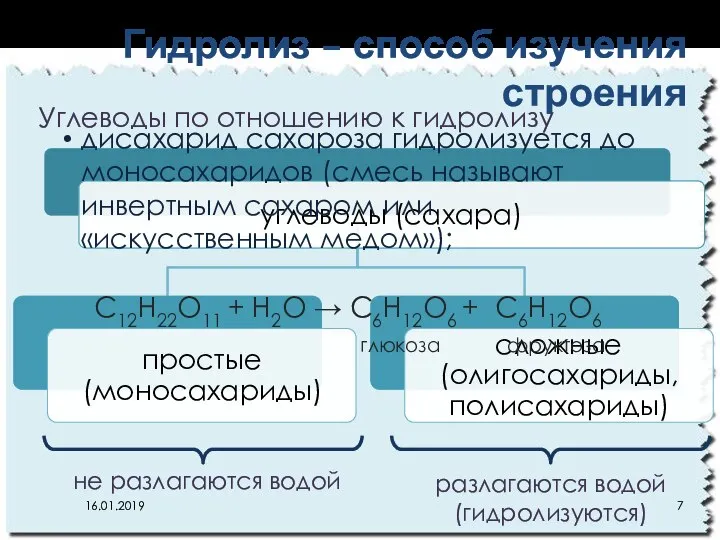
- 7. Гидролиз – способ изучения строения С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 глюкоза фруктоза 16.01.2019 не
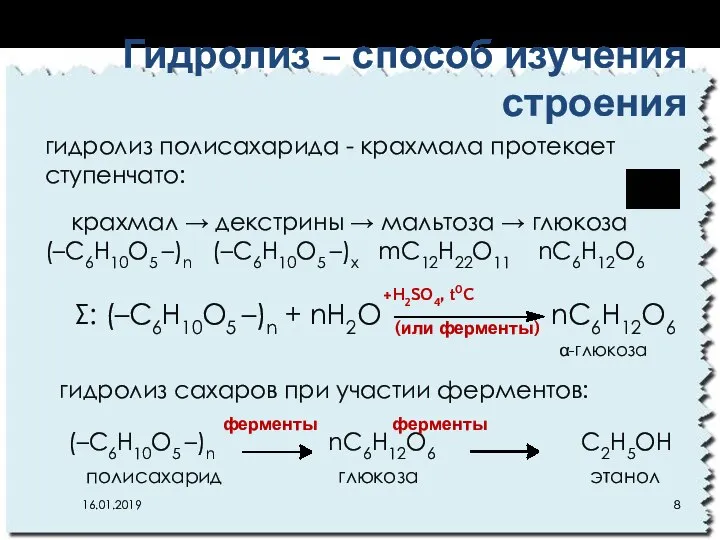
- 8. Σ: (–C6H10O5 –)n + nH2O nC6H12O6 гидролиз полисахарида - крахмала протекает ступенчато: крахмал → декстрины →
- 9. (–C6H10O5 –)n + nH2O nC6H12O6 целлюлоза, в отличие от крахмала не подвергается ферментативному гидролизу гидролиз целлюлозы
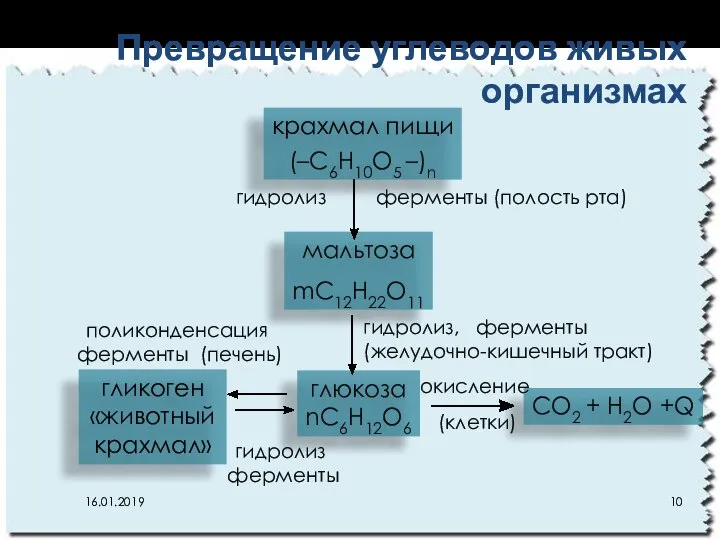
- 10. Превращение углеводов живых организмах крахмал пищи (–C6H10O5 –)n мальтоза mC12H22O11 глюкоза nC6H12O6 CO2 + H2O +Q
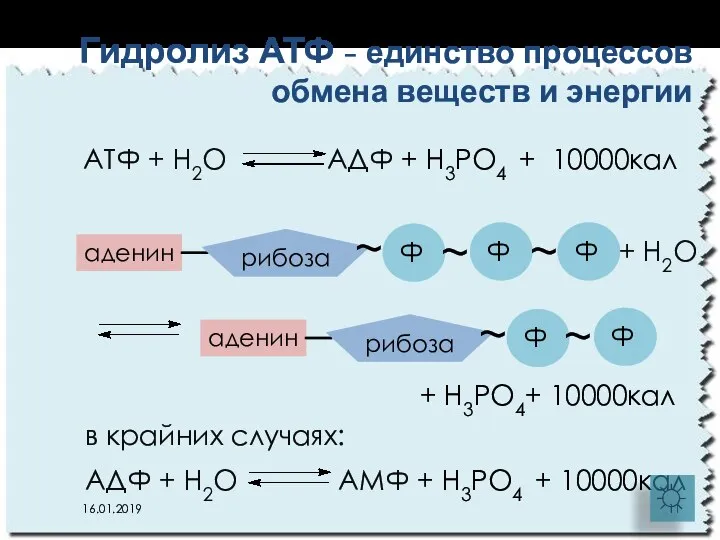
- 11. АТФ + Н2О АДФ + Н3РО4 + 10000кал Гидролиз АТФ - единство процессов обмена веществ и
- 12. Гидролиз бинарных соединений гидролиз карбидов (лабораторный способ) 16.01.2019 C Ca III C CaC2 + 2HOH →
- 13. объясняет прочерки в таблице растворимости: используется для получения водорода в полевых условиях: применяется для борьбы с
- 14. Гидролиз солей сильные и слабые электролиты (определение, представители классов неорганических соединений); соли (определение в свете ТЭД,
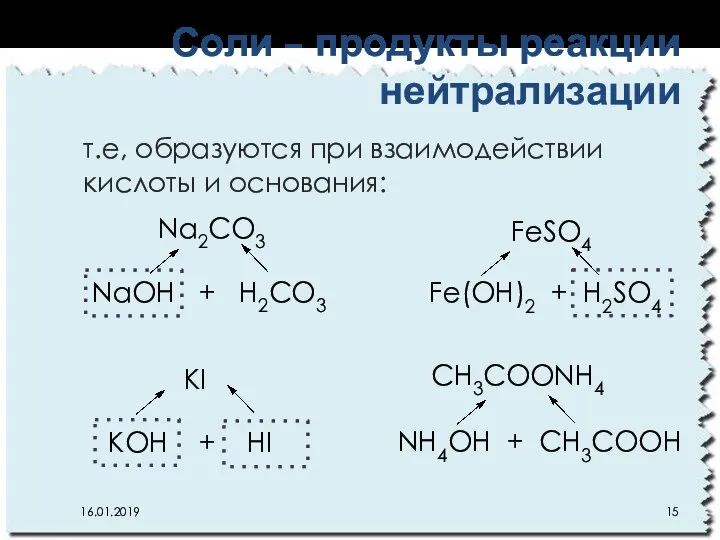
- 15. т.е, образуются при взаимодействии кислоты и основания: Соли – продукты реакции нейтрализации 16.01.2019 Na2CO3 NaОН +
- 16. только растворимые в воде соли, образованные разными по силе кислотой и основанием; реакция среды водного раствора
- 17. Реакции, происходящие в растворах солей рассмотрим 4 типа солей: образованных сильным основанием и слабой кислотой; образованных
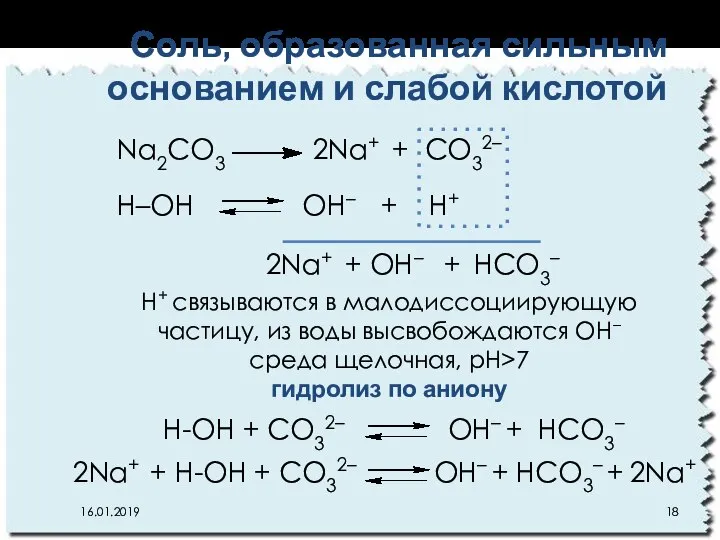
- 18. Соль, образованная сильным основанием и слабой кислотой 16.01.2019 Na2CO3 2Na+ + CO32– Н–ОН OН– + Н+
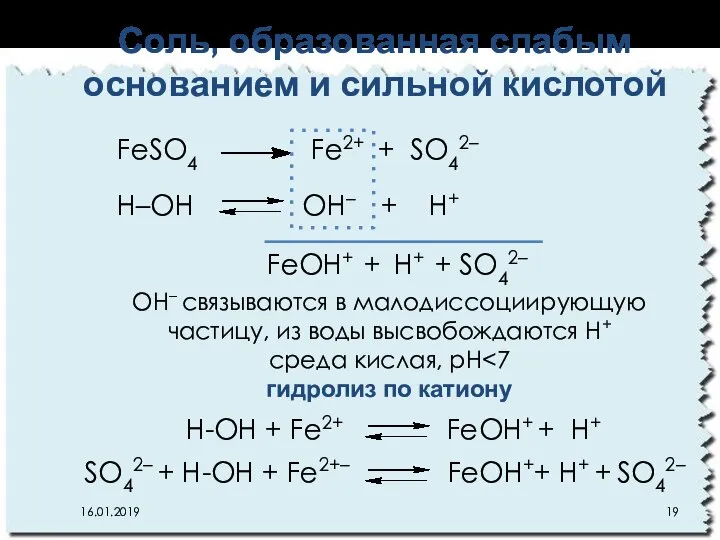
- 19. Соль, образованная слабым основанием и сильной кислотой 16.01.2019 FeSO4 Fe2+ + SO42– Н–ОН OН– + Н+
- 20. Соль, образованная сильным основанием и сильной кислотой 16.01.2019 BaCl2 Ba2+ + 2Cl– Н–ОН OН– + Н+
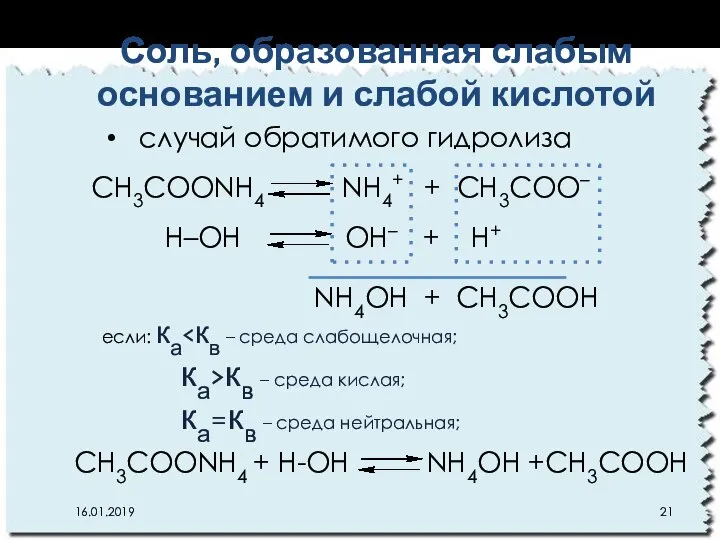
- 21. CН3СOОNH4 NН4+ + CН3СOО– Н–ОН OН– + Н+ NH4OН + CН3СOОН если: ка ка>кв – среда
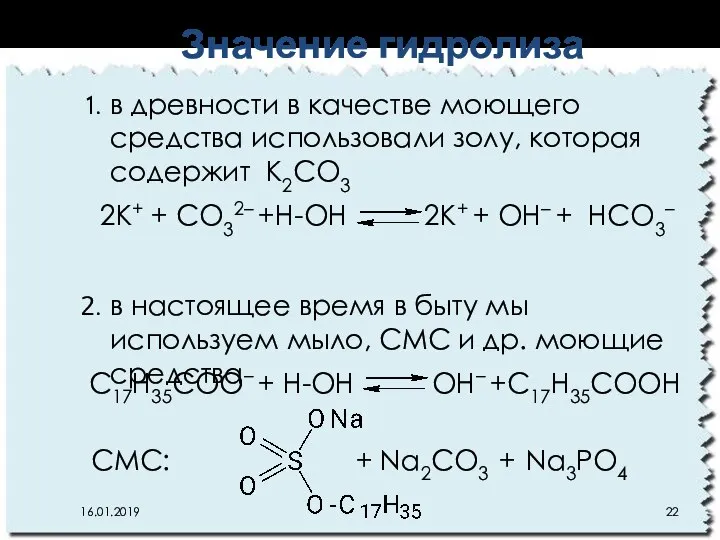
- 22. в древности в качестве моющего средства использовали золу, которая содержит К2CO3 в настоящее время в быту
- 23. NН4+ + H2O NН3•H2O + Н+ в фотографическом проявителе содержатся соли, создающие щелочную среду: К2CO3, Na2CO3,
- 24. в составе крови содержатся NaНCO3, Na2НРO4; их роль заключается в поддержании определенной реакции среды: при избытке
- 25. Домашнее задание 16.01.2019
- 26. Исследуйте индикаторами растворы данных солей 16.01.2019
- 28. Скачать презентацию














 I закон термодинамики, его применение для расчёта тепловых эффектов
I закон термодинамики, его применение для расчёта тепловых эффектов Основные законы в химии
Основные законы в химии Алкины
Алкины Cоляная кислота и ее соли
Cоляная кислота и ее соли Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Неметаллы: атомы и простые вещества. Кислород, озон, воздух Получение соды
Получение соды Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Склад і властивості нафти
Склад і властивості нафти Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Энергетика химических реакций
Энергетика химических реакций Производные пролина (каптоприл, эналаприл) и фенилаланина (мелфалан). Требования к качеству и методы анализа
Производные пролина (каптоприл, эналаприл) и фенилаланина (мелфалан). Требования к качеству и методы анализа Proteins. Functions, structure, classification
Proteins. Functions, structure, classification Общие свойства металлов
Общие свойства металлов Оксиды неметаллов и металлов
Оксиды неметаллов и металлов Физико-химический процесс элелктролиз. (11 класс)
Физико-химический процесс элелктролиз. (11 класс) Оксиды азота.
Оксиды азота. Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Презентация по Химии "История спичек" - скачать смотреть
Презентация по Химии "История спичек" - скачать смотреть  Строение атома
Строение атома Информационно-поисковый исследовательский проект: «Влияние пищевых добавок на здоровье человека».
Информационно-поисковый исследовательский проект: «Влияние пищевых добавок на здоровье человека». Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Азолы. Азолы, содержащие два гетероатома
Азолы. Азолы, содержащие два гетероатома Выполнили: обучающиеся 10 класса Плотникова А. и Вартанян О. МОУ «Новопоселеновская СОШ»
Выполнили: обучающиеся 10 класса Плотникова А. и Вартанян О. МОУ «Новопоселеновская СОШ» Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Углеводы. Урок обобщения и систематизации знаний
Углеводы. Урок обобщения и систематизации знаний