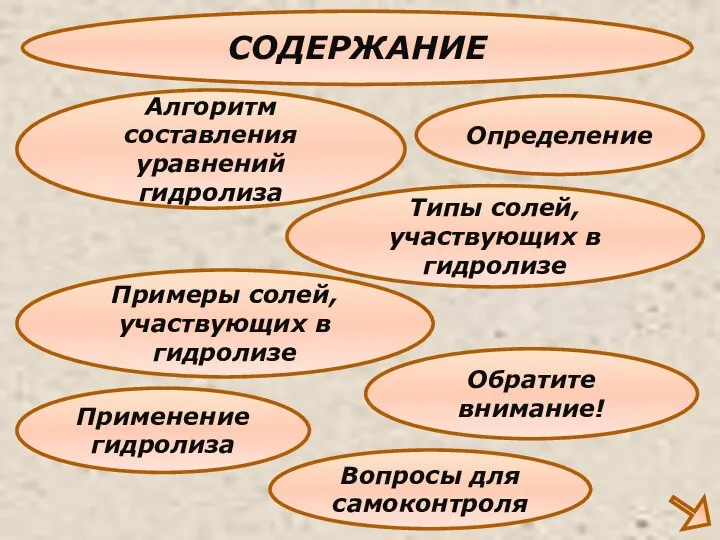
Содержание
- 2. Гидролиз солей «Три пути ведут к знанию: путь размышления – это путь самый благородный; путь подражания
- 3. СОДЕРЖАНИЕ Определение Типы солей,участвующих в гидролизе Алгоритм составления уравнений гидролиза Применение гидролиза Примеры солей,участвующих в гидролизе
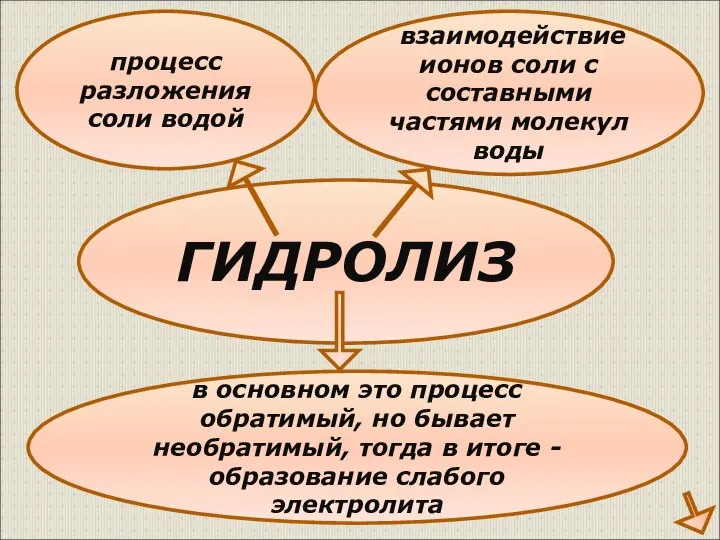
- 4. ГИДРОЛИЗ процесс разложения соли водой взаимодействие ионов соли с составными частями молекул воды в основном это
- 5. Новые понятия Гидролиз – реакция обмена между растворимыми солями и водой Сильные основания – сильные электролиты
- 6. Соль образована сильным основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована
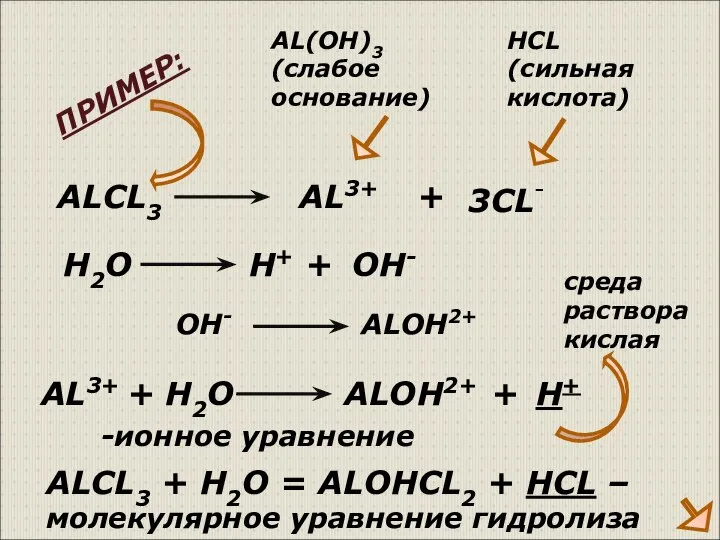
- 7. ALCL3 AL3+ + 3CL- AL(OH)3 (слабое основание) HCL (сильная кислота) AL3+ + H2O H+ OH- ALOH2+
- 8. О Б Р А Т И Т Е В Н И М А Н И Е:
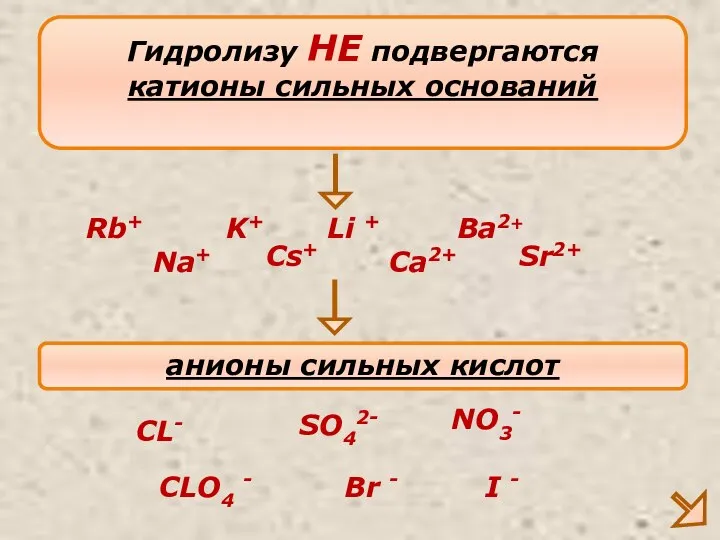
- 9. Гидролизу НЕ подвергаются катионы сильных оснований Na+ K+ Ca2+ анионы сильных кислот CL- SO42- NO3- Ba2+
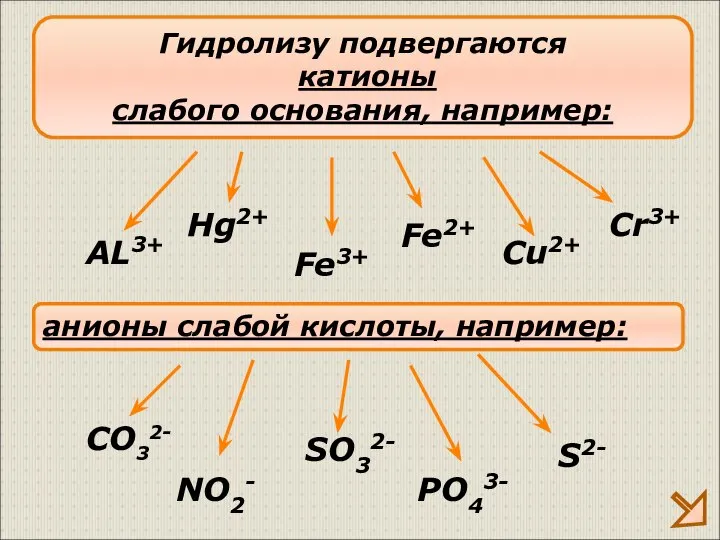
- 10. Гидролизу подвергаются катионы слабого основания, например: AL3+ Fe3+ Cu2+ анионы слабой кислоты, например: CO32- SO32- S2-
- 11. Классификация солей Задание1. Разделите предложенные формулы солей на четыре типа, объясните свой выбор: BaCl2, ZnSO4, CuCl2,
- 12. Алгоритм составления уравнений гидролиза Проверить растворимость соли. Определить состав соли, т.е. указать, каким по силе основанием
- 13. П Р И М Е Р Ы С О Л Е Й, П О Д В
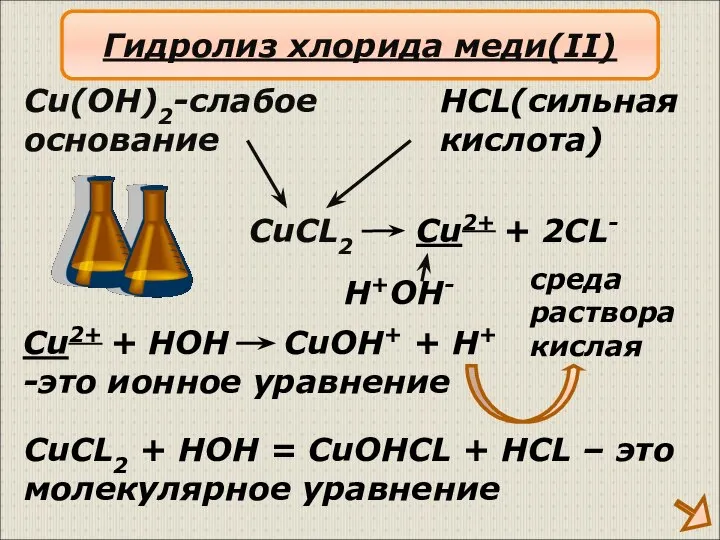
- 14. CuCL2 Cu(OH)2-слабое основание HCL(сильная кислота) Cu2+ + 2CL- H+OH- Cu2+ + HOH CuOH+ + H+ -это
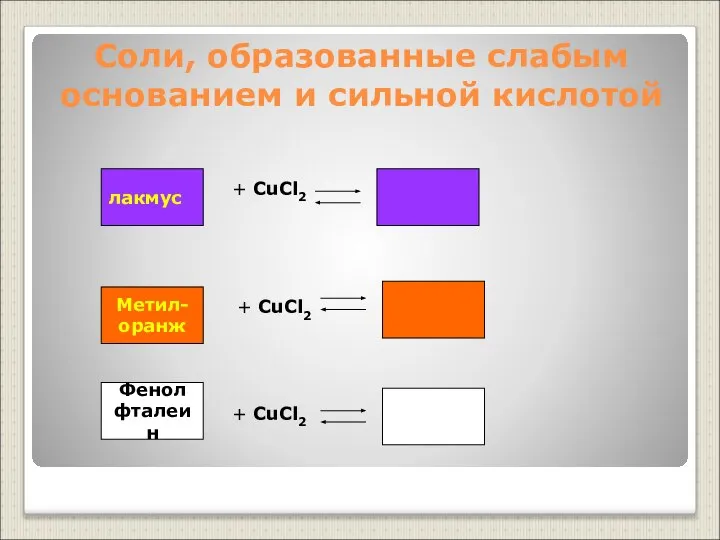
- 15. Соли, образованные слабым основанием и сильной кислотой Фенол фталеин + CuCl2 + CuCl2 + CuCl2 лакмус
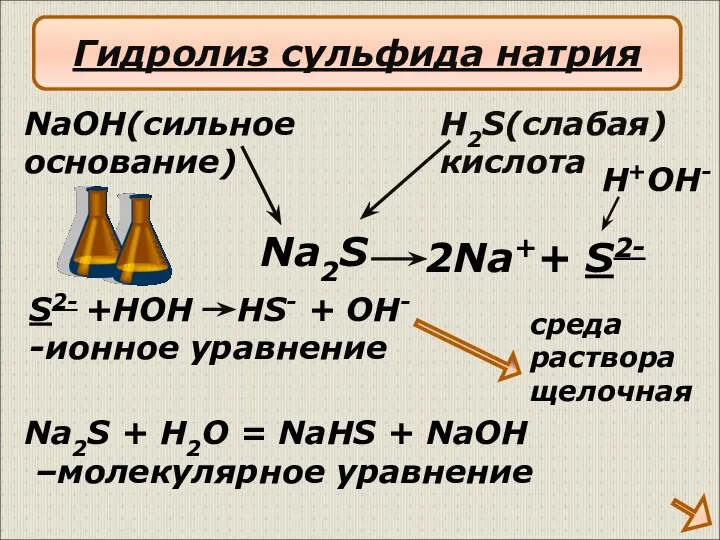
- 16. 2Na++ S2- NaOH(сильное основание) H2S(слабая) кислота S2- +HOH HS- + OH- -ионное уравнение Na2S + H2O
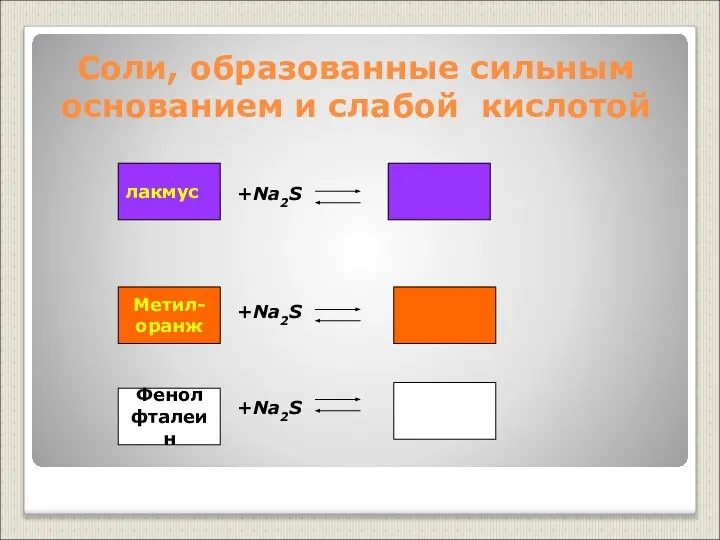
- 17. Соли, образованные сильным основанием и слабой кислотой +Na2S +Na2S +Na2S лакмус Метил- оранж Фенол фталеин
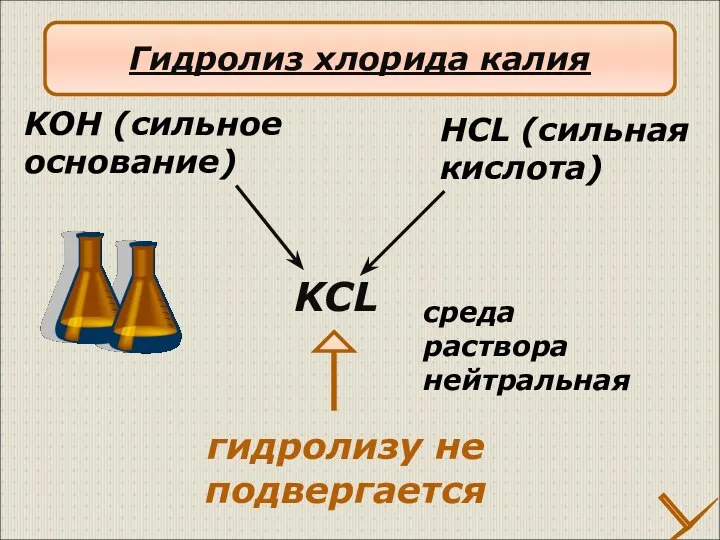
- 18. KCL HCL (сильная кислота) KOH (сильное основание) гидролизу не подвергается среда раствора нейтральная Гидролиз хлорида калия
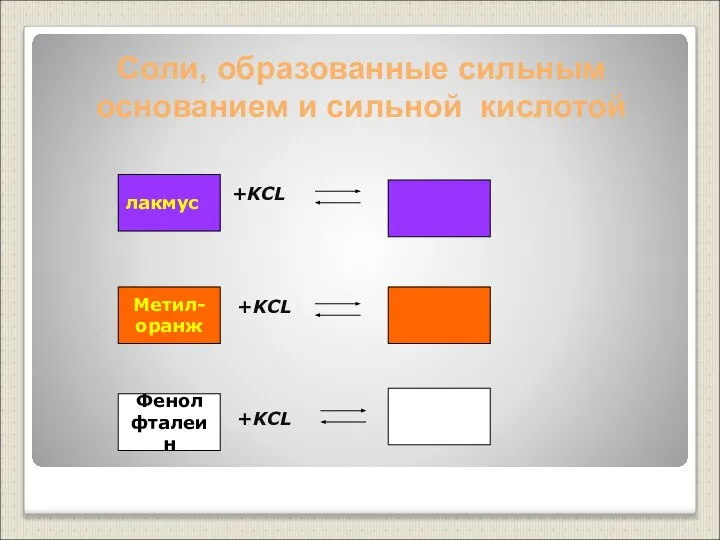
- 19. Соли, образованные сильным основанием и сильной кислотой +KCL +KCL +KCL лакмус Метил- оранж Фенол фталеин
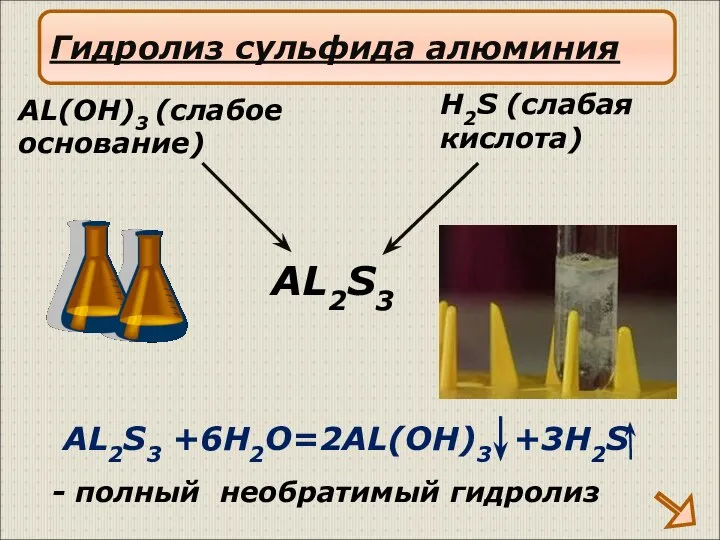
- 20. AL2S3 +6H2O=2AL(OH)3 +3H2S AL2S3 H2S (слабая кислота) AL(OH)3 (слабое основание) Гидролиз сульфида алюминия - полный необратимый
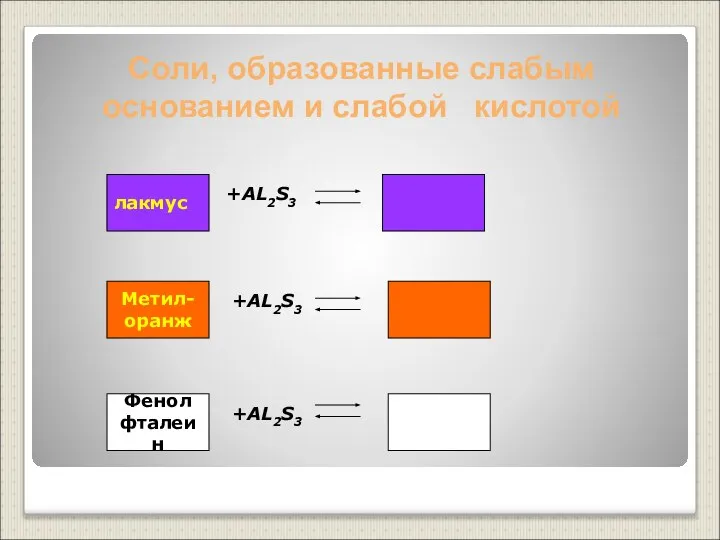
- 21. Соли, образованные слабым основанием и слабой кислотой +AL2S3 +AL2S3 +AL2S3 лакмус Метил- оранж Фенол фталеин
- 22. стирка мытье посуды умывание с мылом Роль гидролиза в повседневной жизни человека
- 23. Для умывания, стирки, мытья посуды нужны синтетические моющие средства, в основе которых содержатся в основном соли
- 24. А ТЕПЕРЬ ВОПРОСЫ….
- 25. Нейтральную среду имеет водный раствор: 1)нитрита натрия 2)силиката калия 3)хлорида железа (II) 4)нитрата калия Найди верный
- 26. В водном растворе какой соли фенолфталеин окрашен в малиновый цвет? 1)CaCl2 2)KNO3 3)FeSO4 4)Na2CO3 Найди верный
- 27. Одинаковую реакцию среды имеют растворы карбоната натрия и 1) нитрата натрия 2) силиката натрия 3) сульфата
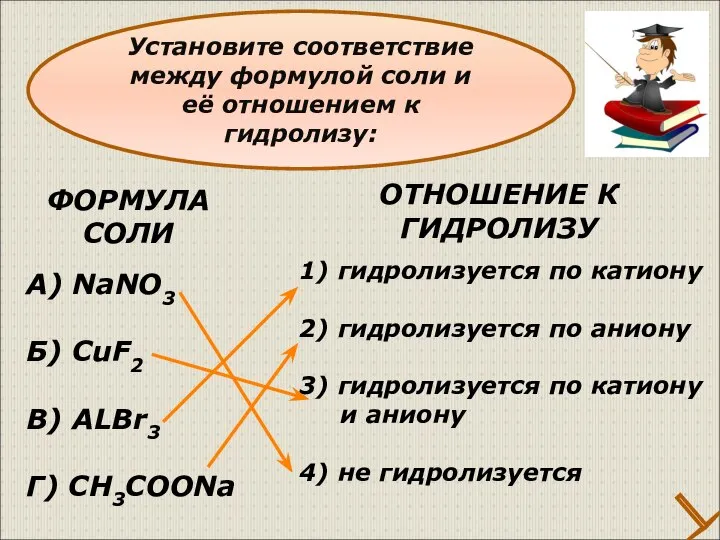
- 28. ФОРМУЛА СОЛИ А) NaNO3 Б) CuF2 В) ALBr3 Г) CH3COONa 1) гидролизуется по катиону 2) гидролизуется
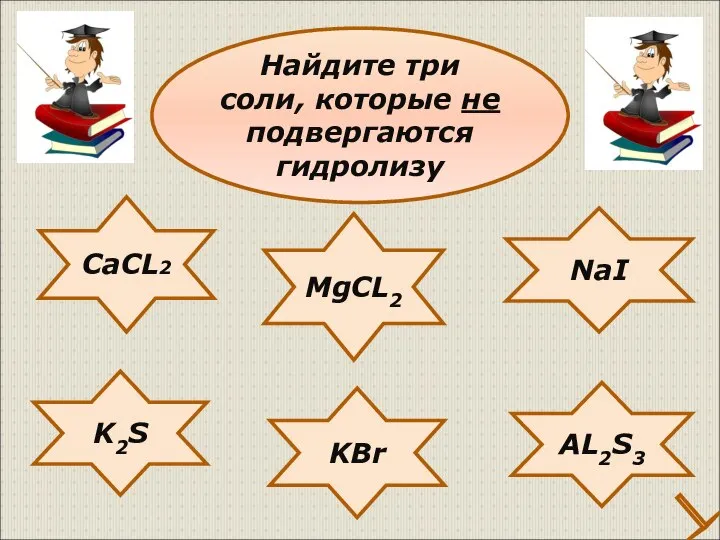
- 29. CaCL2 NaI K2S KBr AL2S3 MgCL2 Найдите три соли, которые не подвергаются гидролизу
- 30. Гидролиз нитрата алюминия идет по катиону Гидролиз сульфата бария идет по аниону Гидролиз щелочей не возможен
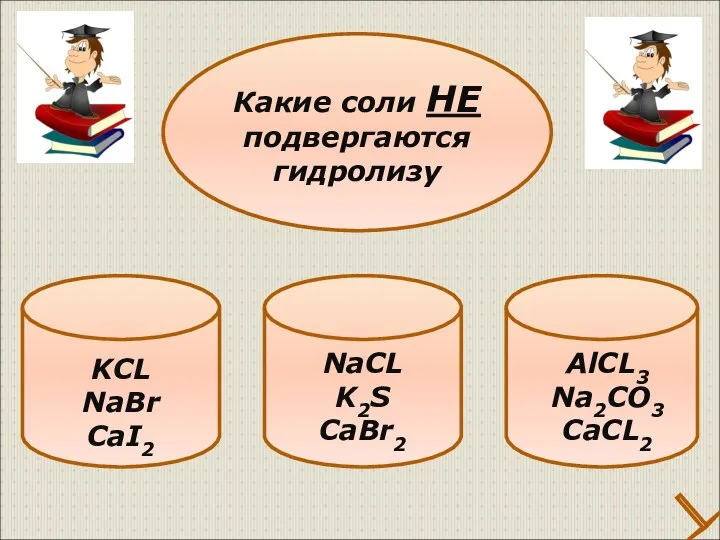
- 31. KCL NaBr CaI2 Какие соли НЕ подвергаются гидролизу NaCL K2S CaBr2 AlCL3 Na2CO3 CaCL2
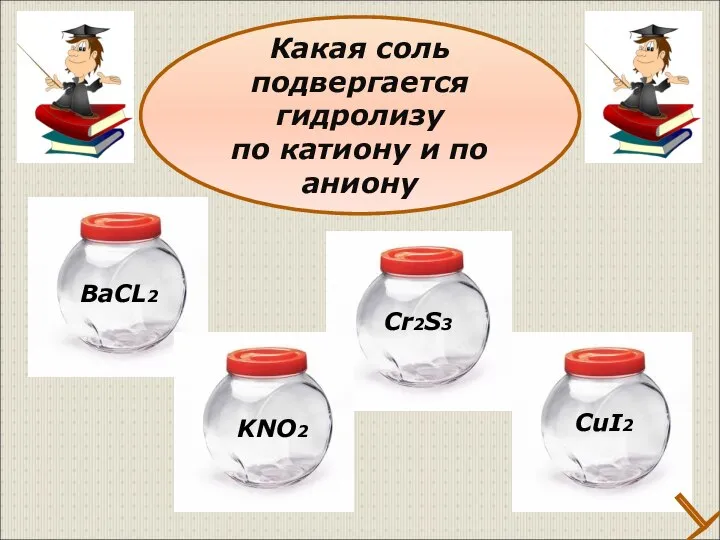
- 32. Какая соль подвергается гидролизу по катиону и по аниону ВаCL2 KNO2 Cr2S3 CuI2
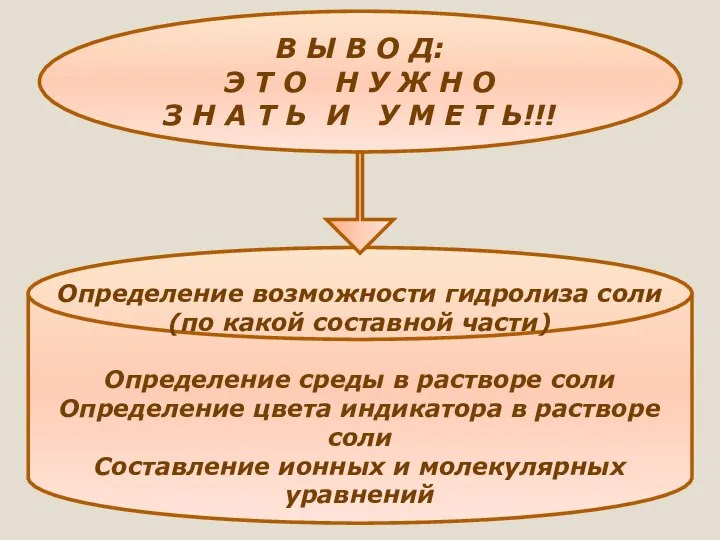
- 33. В Ы В О Д: Э Т О Н У Ж Н О З Н А
- 34. Домашнее задание § 1.12 Упр 7 стр 47
- 36. Скачать презентацию












 Состав нефти, свойства, практическое значение
Состав нефти, свойства, практическое значение Классы дисперсных систем (аэрозоли, порошки, суспензии, эмульсии). Мицеллярные коллоидные системы. Лекция 5
Классы дисперсных систем (аэрозоли, порошки, суспензии, эмульсии). Мицеллярные коллоидные системы. Лекция 5 Галогены
Галогены Аморфные материалы
Аморфные материалы Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Русские ученые-химики
Русские ученые-химики Липиды. Классификация липидов
Липиды. Классификация липидов Решение задач. Алкины
Решение задач. Алкины Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Способы защиты от коррозии
Способы защиты от коррозии Дикарбоновые кислоты
Дикарбоновые кислоты История возникновения химии
История возникновения химии Лекция 3. Химическое равновесие
Лекция 3. Химическое равновесие Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы Металлы
Металлы Юные химики
Юные химики Требования к безопасности пластиковой упаковки
Требования к безопасности пластиковой упаковки Кремнийорганикалық қосылыстар
Кремнийорганикалық қосылыстар Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы»
Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы» Виникнення процесу горіння. Пожежовибухонебезпечні горючі суміші. Концентраційні межі поширення полум’я. (Розділ 2.3.4)
Виникнення процесу горіння. Пожежовибухонебезпечні горючі суміші. Концентраційні межі поширення полум’я. (Розділ 2.3.4) Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Презентация по Химии "Галогены" - скачать смотреть
Презентация по Химии "Галогены" - скачать смотреть  Бутлеровтың құрылыс теориясы
Бутлеровтың құрылыс теориясы Тема: «Алкины»
Тема: «Алкины» Виды топлива и их характеристика
Виды топлива и их характеристика Разработка полимерсодержащих композиционных сорбентов и их применение в молекулярной биотехнологии
Разработка полимерсодержащих композиционных сорбентов и их применение в молекулярной биотехнологии Классификация химических реакций
Классификация химических реакций Презентация по Химии "Химия нефти" - скачать смотреть бесплатно
Презентация по Химии "Химия нефти" - скачать смотреть бесплатно