Содержание
- 2. План 3.1. Кинетическое и термодинамическое описание химического равновесия 3.2. Смещение химического равновесия (принцип Ле Шателье). 3.3.
- 3. 3.1 Обратимыми называются химические реакции и физико-химические процессы, самопроизвольно протекающие как в прямом, так и в
- 4. аА + вВ ⇄ сС + dD N2 + 3 H2 ⇄ 2 NH3 NH4Cl +
- 5. К.Л.Бертолле (1748-1822) Изучая реак-ции выпаде-ния осадков из растворов, Бертолле первым при-шел к выводу об обратимос-ти химических
- 6. Участвуя в Египетском походе французской армии как научный консультант Наполеона, Бертолле обнаружил отложения Na2CO3 на берегу
- 7. Пределом протекания обратимых процессов является состояние химического равновесия
- 8. Химическое равновесие - это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны
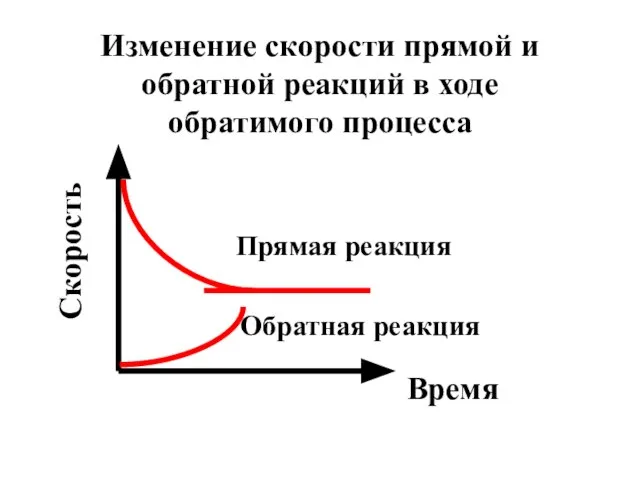
- 9. Изменение скорости прямой и обратной реакций в ходе обратимого процесса Время Скорость Прямая реакция Обратная реакция
- 10. Признаком химического равновесия является постоянство во времени концентраций всех веществ, участвующих в процессе.
- 11. Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
- 12. Кинетические кривые обратимой реакции а А ⇄ bВ [Ā] B A [B] Время моль/л
- 13. Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих
- 14. υпр = kпр[A]a [B]b υобр = kобр[C]c [D]d k - константа скорости В состоянии равновесия
- 15. υпр = υобр, следовательно Так как kпр_ = [C]c [D]d kобр [A]a [B]b
- 16. kпр kобр = Кc где Kс – концентрационная константа равновесия
- 17. [C]c [D]d [A]a [B]b Kc = Закон действующих масс для обратимой реакции
- 18. [HbO2] Кс = ----------- = 1300 [Hb][O2] Например: Hb + O2 ⇄ HbO2
- 19. Если в химической реакции участвуют газообразные, жидкие и твердые вещества, то для расчета Кс используют только
- 20. Например: CO2(г) + 2 NH3(г) ⇄H2O (г) + CO(NH2)2 (к) ___[H2O]___ [CO2]×[NH3]2 Kc =
- 21. Для описания обратимых газофазных реакций используют константу химического равновесия, обозначаемую Kp:
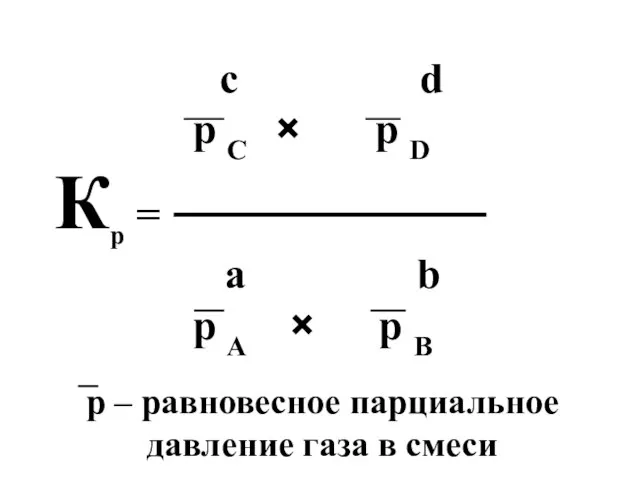
- 22. с d р С × р D Кр = а b р А × р В
- 23. Соотношение Kс и Кр описывается уравнением: Кс = Кр (RT) (а+b-c-d)
- 24. Если К >> 1 → равновесие смещено вправо, υпр > υобр; Если К
- 25. В основе термодинамического описания обратимого процесса лежит уравнение изотермы химической реакции
- 26. В состоянии химического равновесия Δ G = 0, а концентрации веществ А, В, С, D являются
- 27. - G0 /RT K = e Термодинамический расчет константы равновесия: K зависит только от температуры и
- 28. 3.2 Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса, так как характеризуется минимальным запасом
- 29. Энергетическая диаграмма обратимой реакции Δ G=0 Δ G Δ G' G, кДж Координата реакции Любой обратимый
- 30. В 1884 г. французский физико-химик и металлург Ле Шателье сформулировал общий закон смещения химического равовесия Анри
- 31. Принцип Ле Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменив температуру,
- 32. В любом случае равновесие будет смещаться до тех пор, пока не наступит новое положение равновесия, которое
- 33. A)повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры - в сторону экзотермической реакции Частные
- 34. Hb + O2 ⇄ HbO2, Δ rН = - 10 кДж При повышении температуры равновесие смешается
- 35. Б) при повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления
- 36. Изменение давления не влияет на смещение химического равновесия, если: В реакции не участвуют газы; Реакция протекает
- 37. Венозная кровь поступает в легкие, где испытывает повышенное давлении О2. В результате равновесие смещается вправо (кровь
- 38. B) при увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая
- 39. Смещение равновесия in vivo Hb + O2 ⇄ HbO2 При увеличении содержания гемоглобина в крови равновесие
- 40. 3.3 Важнейшей биосредой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического
- 41. Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия).
- 42. Диссоциация воды Вода – слабый электролит, диссоциацию которого можно представить схемой: H2O ⇄ H+ + OH-
- 43. При комнатной температуре из 5 млн. молекул воды на ионы диссоциирует только одна
- 44. Поскольку [H2O]>>[H+] ([OH-]), то можно считать, что [H2O] = const
- 45. [H+]×[OH-] ---------------------------------------------------- [H2O] Kc = Кс [H2O] = [H+][OH-]
- 46. Kс [H2O] = Kw Kw - ионное произведение воды, константа равновесия, описывающая обратимую диссоциацию воды. Кw
- 47. [H+] = Kw -------- [OH-] [OH-] = Kw --------- [H+] Для воды и водных растворов:
- 48. Диссоциация слабых кислот CH3COOH⇄ CH3COO- + H+ [H+]×[CH3COO-] ________________________________ [ CH3COOH] Ka = Ka - константа
- 49. Диссоциация слабых оснований NH4OH ⇄ NH4+ + OH- NH4+ ]×[ OH- ] [NH4OH] Kb = Kb-константа
- 50. Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах
- 51. Гидролиз (гидролитическое разложение) – это реакция разложения сложных веществ на более простые под воздействием воды
- 52. Гидролиз солей - это реакция ионного обмена между составными частями соли и воды, протекающая с изменением
- 53. Гидролиз соли, образованной слабым основанием и сильной кислотой NH4Cl+ H2O ⇄ NH4OH + HCl NH4+ +
- 54. [NH4OH]×[H+] __________________________________ [NH4+] Кг = = [NH4OH]×Kw ________________________________ [NH4+]×[OH-] Kw ___________ Kb = = Кг –
- 55. Гидролиз соли, образованной слабой кислотой и сильным основанием CH3COONa + H2O ⇄ CH3COOH + NaOH CH3COO-
- 56. Гидролиз соли, образованной слабым основанием и слабой кислотой CH3COONH4 + H2O ⇄ NH4OH + CH3COOH Кг
- 57. Способность соли к гидролизу характеризуется при помощи степени гидролиза (h): h = Количество гидролизуемой соли _______________________________________________________________________________________________
- 58. h = √ Кг / CM Чем больше константа гидролиза, тем сильнее гидролизуется соль.
- 59. Гидролиз солей - один из факторов, регулирующих кислотность внутренней среды организма.
- 61. Скачать презентацию


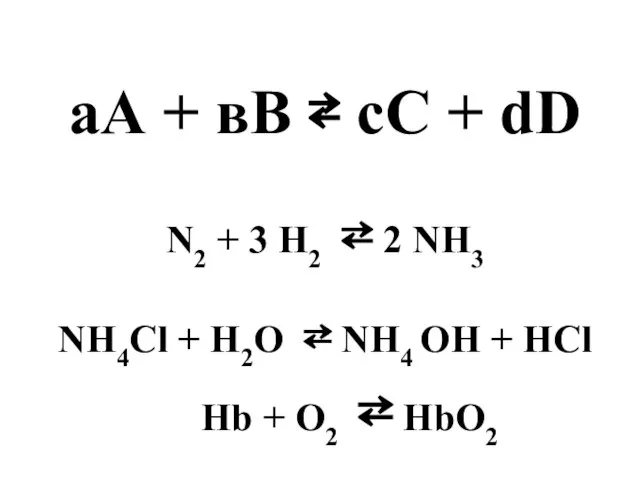





![Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-10.jpg)
![Кинетические кривые обратимой реакции а А ⇄ bВ [Ā] B A [B] Время моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-11.jpg)

![υпр = kпр[A]a [B]b υобр = kобр[C]c [D]d k - константа скорости В состоянии равновесия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-13.jpg)
![υпр = υобр, следовательно Так как kпр_ = [C]c [D]d kобр [A]a [B]b](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-14.jpg)

![[C]c [D]d [A]a [B]b Kc = Закон действующих масс для обратимой реакции](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-16.jpg)
![[HbO2] Кс = ----------- = 1300 [Hb][O2] Например: Hb + O2 ⇄ HbO2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-17.jpg)

![Например: CO2(г) + 2 NH3(г) ⇄H2O (г) + CO(NH2)2 (к) ___[H2O]___ [CO2]×[NH3]2 Kc =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-19.jpg)






















![Поскольку [H2O]>>[H+] ([OH-]), то можно считать, что [H2O] = const](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-43.jpg)
![[H+]×[OH-] ---------------------------------------------------- [H2O] Kc = Кс [H2O] = [H+][OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-44.jpg)
![Kс [H2O] = Kw Kw - ионное произведение воды, константа равновесия,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-45.jpg)
![[H+] = Kw -------- [OH-] [OH-] = Kw --------- [H+] Для воды и водных растворов:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-46.jpg)
![Диссоциация слабых кислот CH3COOH⇄ CH3COO- + H+ [H+]×[CH3COO-] ________________________________ [ CH3COOH]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-47.jpg)
![Диссоциация слабых оснований NH4OH ⇄ NH4+ + OH- NH4+ ]×[ OH-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-48.jpg)




![[NH4OH]×[H+] __________________________________ [NH4+] Кг = = [NH4OH]×Kw ________________________________ [NH4+]×[OH-] Kw ___________](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/539132/slide-53.jpg)





 Биосинтез белков в живой клетке Продолжить формирование знаний об основных процессах метаболизма; охарактеризовать два этапа би
Биосинтез белков в живой клетке Продолжить формирование знаний об основных процессах метаболизма; охарактеризовать два этапа би Хлориды. Получение
Хлориды. Получение Экстракция
Экстракция Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы Обмен нуклеотидов
Обмен нуклеотидов Ферум. Залізо. Будова атома, фізичні і хімічні властивості
Ферум. Залізо. Будова атома, фізичні і хімічні властивості Синтетикалық талшықтар
Синтетикалық талшықтар Активна реакція водних розчинів
Активна реакція водних розчинів Интересные свойства редких металлов
Интересные свойства редких металлов Види аналізів – мікрохімічний, люмінесцентний, хімічний
Види аналізів – мікрохімічний, люмінесцентний, хімічний Железо и его соединения
Железо и его соединения Презентация по дисциплине «Химия» на тему: «Сложные эфиры» Автор: Садыгова Елена, студентка группы Т-1 Руководитель: Лебединск
Презентация по дисциплине «Химия» на тему: «Сложные эфиры» Автор: Садыгова Елена, студентка группы Т-1 Руководитель: Лебединск Защита населения от воздействия аварийно химически опасных веществ
Защита населения от воздействия аварийно химически опасных веществ Биологически важные поли- и гетерофункциональные соединения
Биологически важные поли- и гетерофункциональные соединения Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами
Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами Сверхразветвленные полимеры: типы, получение, применение
Сверхразветвленные полимеры: типы, получение, применение Энергетика химических процессов
Энергетика химических процессов Золото и его применение
Золото и его применение Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Моделирование процесса приготовления раствора уксусной кислоты различной концентрации
Моделирование процесса приготовления раствора уксусной кислоты различной концентрации Тема урока: Силикатная промышленность
Тема урока: Силикатная промышленность Твердотільний ямр
Твердотільний ямр Масс-спектры спиртов и фенолов
Масс-спектры спиртов и фенолов Автор: Джанаралиев Зелемхан Амурович 11-А класс Мишурова Юлия Юрьевна 9-А класс Учитель: Волкорез Елена Ильинич
Автор: Джанаралиев Зелемхан Амурович 11-А класс Мишурова Юлия Юрьевна 9-А класс Учитель: Волкорез Елена Ильинич Системы электрохимической защиты объектов трубопроводного транспорта. Нормативы
Системы электрохимической защиты объектов трубопроводного транспорта. Нормативы Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Номенклатура органических соединений. Алканы
Номенклатура органических соединений. Алканы