Содержание
- 3. По условиям проведения реакции подразделяются на : Изотермические – протекают при постоянной температуре Не изотермические –температура
- 4. По фазному состоянию реагентов реакции делят на… Гомогенные Гетерогенные
- 5. По механизму проведения: Простые обратимые Простые необратимые Параллельные реакции Последовательные реакции
- 6. По тепловому эффекту: Экзотермические (с выделением тепла) Эндотермические (с поглощением тепла)
- 7. По применению катализаторов разделяют на : Каталические Некаталические
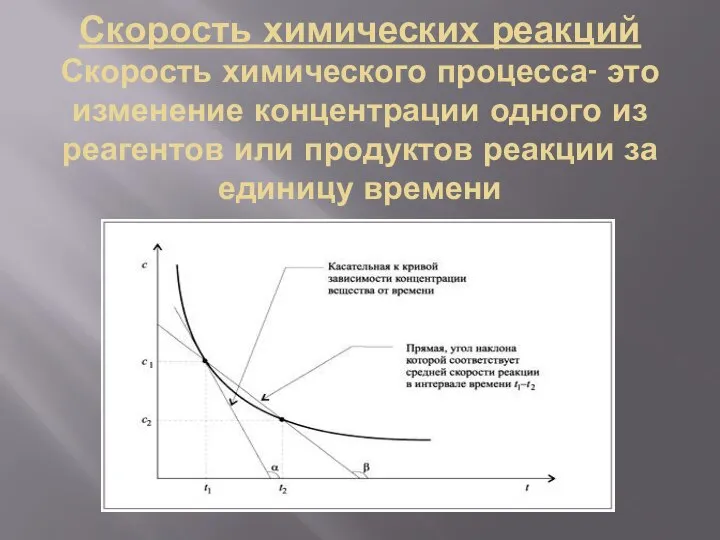
- 8. Скорость химических реакций Скорость химического процесса- это изменение концентрации одного из реагентов или продуктов реакции за
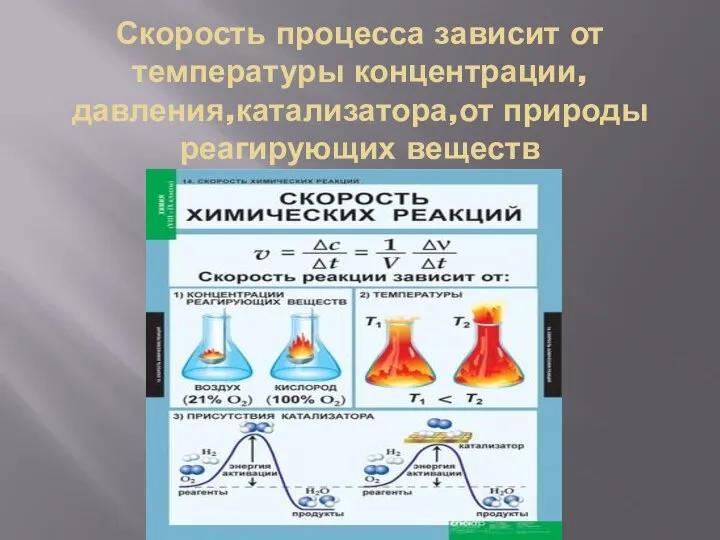
- 9. Скорость процесса зависит от температуры концентрации, давления,катализатора,от природы реагирующих веществ
- 10. Скорость химической реакции Скорость химической реакции пропорционально концентрациям вещества участвующих в реакции При повышении давления в
- 12. Скачать презентацию







 Понятие о качественных реакциях. 9 класс
Понятие о качественных реакциях. 9 класс Металлы. Общая характеристика
Металлы. Общая характеристика Полимеры. Пластмассы
Полимеры. Пластмассы Реакции щелочных металлов (Группа 1) – Li, Na, K
Реакции щелочных металлов (Группа 1) – Li, Na, K Строение атома. (8 класс)
Строение атома. (8 класс) Альдегидная функциональная группа
Альдегидная функциональная группа Кальцит
Кальцит Озон. Аллотропия кислорода
Озон. Аллотропия кислорода Инновационный проект производства фуллеренов
Инновационный проект производства фуллеренов Cromatografia de gaze
Cromatografia de gaze Державна система забезпечення якості лікарських засобів в Україні
Державна система забезпечення якості лікарських засобів в Україні Обмен липидов
Обмен липидов Химический элементы в нашей жизни
Химический элементы в нашей жизни Алканы. Задания
Алканы. Задания Миф о холоде. Задача 7
Миф о холоде. Задача 7 Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты) Структурно-механiчнi (реологiчнi) властивостi харчових мас
Структурно-механiчнi (реологiчнi) властивостi харчових мас Повторительное обобщение по неорганической химии, подготовка к ГИА
Повторительное обобщение по неорганической химии, подготовка к ГИА Химия – наука о веществах, их свойствах и превращениях Урок №1
Химия – наука о веществах, их свойствах и превращениях Урок №1 Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Підготувал Презентация Белки и аминокислоты
Презентация Белки и аминокислоты  Виртуальный урок по химии тема: Химические реакции Практическое занятие Подготовил: Учитель химии МОУ «МЛ №1
Виртуальный урок по химии тема: Химические реакции Практическое занятие Подготовил: Учитель химии МОУ «МЛ №1 Аргентум (Срібло)
Аргентум (Срібло) Комплексные соединения
Комплексные соединения Технология промышленных газов
Технология промышленных газов Презентация по химии «Соли. Названия и классификация солей»
Презентация по химии «Соли. Названия и классификация солей»  Количество вещества
Количество вещества Растворы. Общие свойства растворов
Растворы. Общие свойства растворов