Содержание
- 2. Гидролиз солей. Гидролиз – это реакция обменного разложения веществ водой.
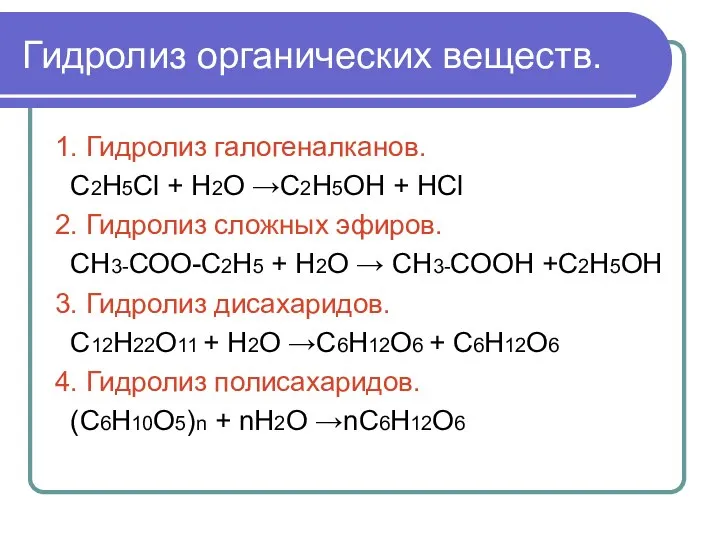
- 3. Гидролиз органических веществ. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. Гидролиз сложных эфиров.
- 4. Гидролиз неорганических веществ. Гидролизу подвергаются растворы солей. Следовательно, водные растворы солей имеют разные значения рН и
- 5. Классификация солей. Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от силы
- 6. Классификация солей. 3. Соли, образованные слабой кислотой и слабым основанием (NH4CN, Cu(CH3COO)2). 4. Соли, образованные сильной
- 7. Соли, образованные сильным основанием и слабой кислотой. NaCN + Н2О ↔ NaOH + HCN NaCN ↔Na+
- 8. Соли, образованные сильным основанием и слабой кислотой. Гидролиз по аниону: Обратимый процесс. Химическое равновесие смещено влево.
- 9. Соли, образованные сильной кислотой и слабым основанием. NH4Cl + H2O ↔ NH3·H2О + НСl NH4Cl ↔
- 10. Соли, образованные сильной кислотой и слабым основанием. Гидролиз по катиону: Обратимый процесс. Химическое равновесие смещено влево.
- 11. Соли, образованные слабой кислотой и слабым основанием. NH4СН3СОО + H2O ↔ СН3СООН + NH3 · H2О
- 12. Соли, образованные слабой кислотой и слабым основанием. Гидролиз по катиону и по аниону. Химическое равновесие смещено
- 13. Соли, образованные сильной кислотой и сильным основанием. КСl + H2O ↔ КСl ↔ К + +
- 14. Гидролиз солей. Гидролиз можно усилить: Добавить воды. Нагреть раствор (увеличится диссоциация воды). Связать один из продуктов
- 16. Скачать презентацию












 Углеводороды
Углеводороды Презентация по Химии "«Краткий очерк историиразвития химии»" - скачать смотреть
Презентация по Химии "«Краткий очерк историиразвития химии»" - скачать смотреть  Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Купрум. Знаходження в періодичній системі
Купрум. Знаходження в періодичній системі Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Химиотерапия и антибиотики. Бактериофаги. (Занятие 9)
Химиотерапия и антибиотики. Бактериофаги. (Занятие 9) ИГРЫ С ПЕРЧАТКАМИ Часто в химических лабораториях игривые экспериментаторы используют не по назначению латексные перчатки. Напр
ИГРЫ С ПЕРЧАТКАМИ Часто в химических лабораториях игривые экспериментаторы используют не по назначению латексные перчатки. Напр Наноматериалы. Каталитические свойства
Наноматериалы. Каталитические свойства Белки. Определение
Белки. Определение Характеристики раствора Вкус Цвет Что растворено (раствор сахара, соли, спирта, уксусной кислоты и т.д.) Что является растворител
Характеристики раствора Вкус Цвет Что растворено (раствор сахара, соли, спирта, уксусной кислоты и т.д.) Что является растворител Задания С 3 для подготовки к ГИА -9 по химии
Задания С 3 для подготовки к ГИА -9 по химии Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна
Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна  Алюминий. Интересные факты
Алюминий. Интересные факты Строение, свойства, биологическая роль нуклеотидов. (Лекция 5)
Строение, свойства, биологическая роль нуклеотидов. (Лекция 5) Презентация по Химии "Вода как растворитель" - скачать смотреть
Презентация по Химии "Вода как растворитель" - скачать смотреть  Природный газ и нефть
Природный газ и нефть Цинк
Цинк Atomic number, Mass number and Isotopes
Atomic number, Mass number and Isotopes Биогенді аминдер
Биогенді аминдер Язык химии
Язык химии Классификация химических реакциях
Классификация химических реакциях Поліаміди
Поліаміди Липиды
Липиды Периодический закон. Периодическая система элементов. (Лекция 2)
Периодический закон. Периодическая система элементов. (Лекция 2) Судың құрамы және физикалық қасиеттері
Судың құрамы және физикалық қасиеттері VIIА группа: галогены
VIIА группа: галогены Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии
Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот