Содержание
- 2. АЛКАНЫ Алканы – ациклические насыщенные (предельные) углеводороды общей формулы СnH2n+2 Гомологический ряд - ряд родственных соединений
- 3. СТРОЕНИЕ АЛКАНОВ ,
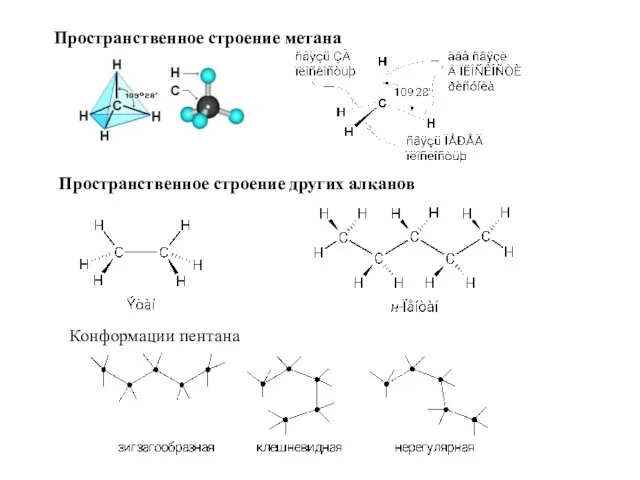
- 4. Пространственное строение метана Пространственное строение других алканов Конформации пентана
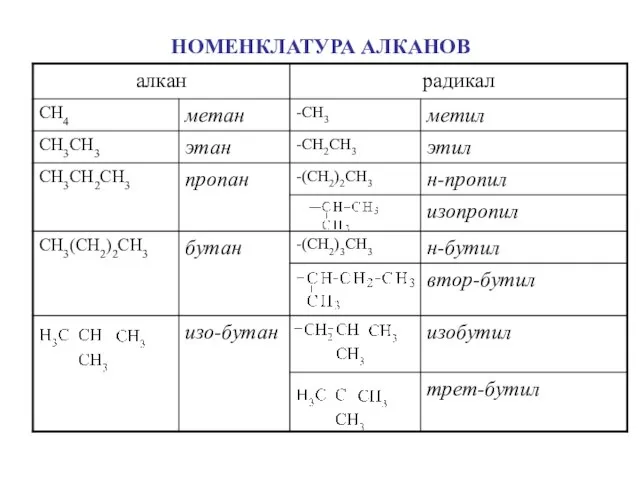
- 5. НОМЕНКЛАТУРА АЛКАНОВ Правилами ИЮПАК для простейших алканов приняты исторически сложившиеся (тривиальные) названия: СН4 – метан, СН3СH3
- 6. НОМЕНКЛАТУРА АЛКАНОВ
- 7. Порядок построения названия разветвленного алкана: 1. Выбирают главную углеродную цепь, которая должна быть самой длинной и
- 8. ИЗОМЕРИЯ АЛКАНОВ Структурная изомерия – изомерия углеродного скелета C5H12 3 изомера, C8H18 18 изомеров, C10H22 75
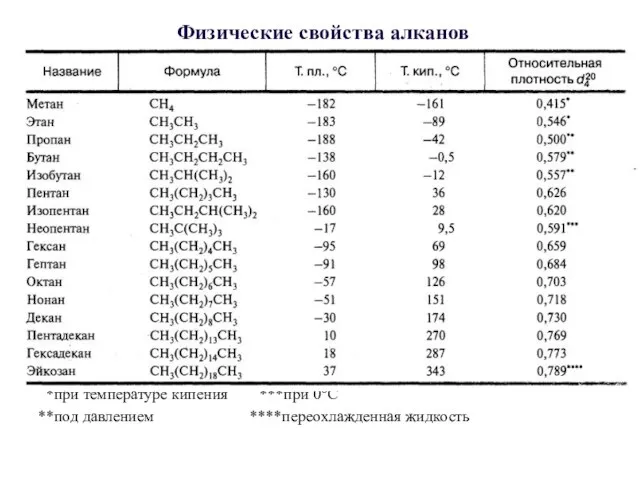
- 9. Физические свойства алканов *при температуре кипения ***при 0°С **под давлением ****переохлажденная жидкость
- 10. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ Реакции алканов подразделяются на следующие типы: реакции разложения (крекинг алканов) и реакции изомеризации
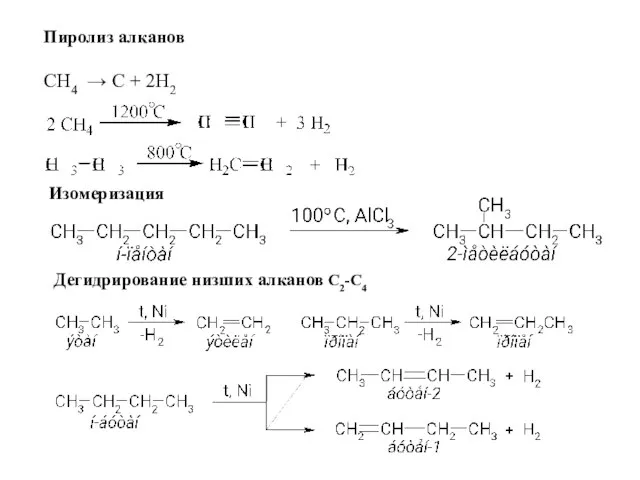
- 11. Пиролиз алканов СН4 → C + 2H2 Изомеризация Дегидрирование низших алканов С2-С4
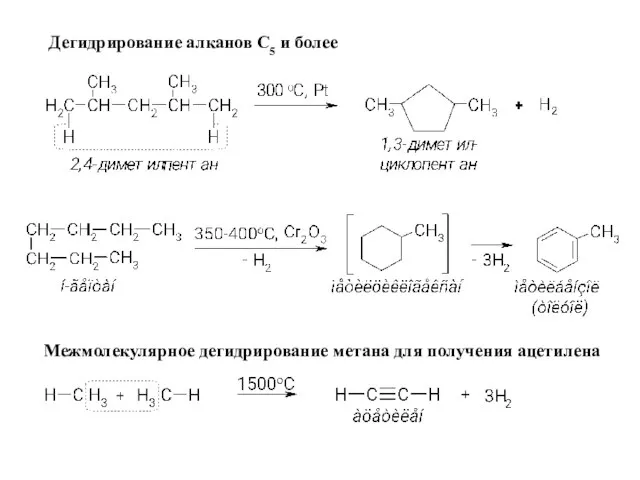
- 12. Дегидрирование алканов С5 и более Межмолекулярное дегидрирование метана для получения ацетилена
- 13. Окисление Уравнение реакции горения алканов в общем виде: CnH2n+2 + (3n + 1)/2 O2 ⎯→ n
- 14. РЕАКЦИИ ЗАМЕЩЕНИЯ Галогенирование алканов Активность галогенов в этой реакции уменьшается в ряду: F > Cl >
- 15. Стадия I: зарождение (инициирование) цепи Стадия II: развитие (рост) цепи Стадия III: обрыв цепи Механизм радикального
- 16. Нитрование алканов Реакция Коновалова Парофазное нитрование алканов (Хесс) Реакции сульфохлорирования (I) и сульфоокисления (II) алканов С12-С18
- 17. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ 1. Крекинг нефти 2. Метод Бергиуса (гидрогенизация бурых углей) 3. Метод Фишера-Тропша Синтин
- 18. 5. Гидрирование алкенов и алкинов над катализаторами (Pt, Pd, Ni): H2 2H2 CnH2n ⎯⎯→ CnH2n+2 ←⎯⎯
- 20. Скачать презентацию












 Что такое полупроводники
Что такое полупроводники Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Металлы. Общая характеристика
Металлы. Общая характеристика Ионный обмен или сорбция
Ионный обмен или сорбция Ковалентная неполярная химическая связь.
Ковалентная неполярная химическая связь.  Биоэлементы. Соотношение химических элементов в клетке
Биоэлементы. Соотношение химических элементов в клетке Нефть и газ. Химический состав и свойства
Нефть и газ. Химический состав и свойства Химическая термодинамика. Лекция 2
Химическая термодинамика. Лекция 2 Бензол и его свойства
Бензол и его свойства Ароматические углеводороды
Ароматические углеводороды Элементы группы VII B
Элементы группы VII B Коллигативные свойства растворов
Коллигативные свойства растворов Презентация по Химии "Раціональне використання добрив та проблеми охорони природи" - скачать смотреть бесплатно
Презентация по Химии "Раціональне використання добрив та проблеми охорони природи" - скачать смотреть бесплатно Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть
Презентация по Химии "Водородные соединения неметаллов" - скачать смотреть  Биохимические и физико-химические процессы при производстве молочных продуктов
Биохимические и физико-химические процессы при производстве молочных продуктов Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния
Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния Дослідження на тему: Повітря Христинівщини За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Повітря Христинівщини За проектом “Екологічна ситуація у рідному місті” Химическая кинетика и катализ
Химическая кинетика и катализ Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Химическое равновесие
Химическое равновесие Диаграмма состояния системы железо-углерод. Фазовые превращения сплавов железа
Диаграмма состояния системы железо-углерод. Фазовые превращения сплавов железа Электролитическая диссоциация
Электролитическая диссоциация