Содержание
- 2. Гидроксиды NaOH, KOH, NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr, H2SO3, H2CO3,
- 3. * Громова О.И Электролиты сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; слабые: ,
- 4. * Громова О.И Изменение цвета различных индикаторов при действии растворов кислот и щелочей
- 5. * Громова О.И Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от
- 6. * Громова О.И 1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 2. Соли, образованные
- 7. * Громова О.И Гидролизом называется взаимодействие веществ с водой, при котором составные части вещества соединяются с
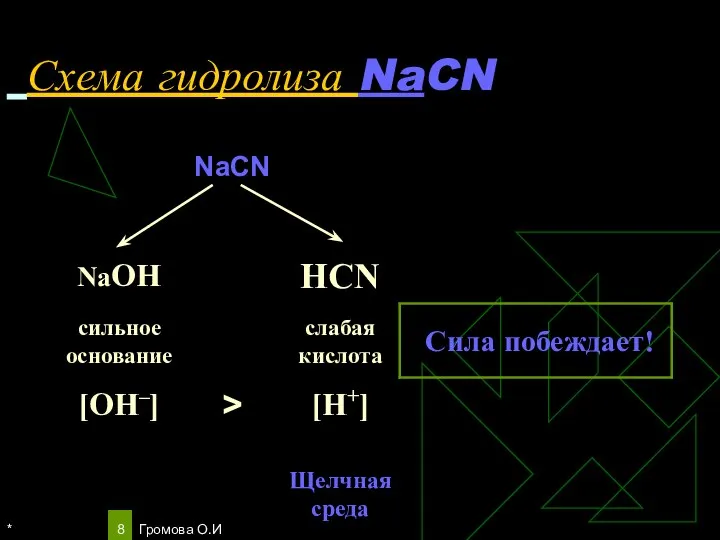
- 8. * Громова О.И Схема гидролиза NaCN
- 9. * Громова О.И Уравнения гидролиза NaCN NaCN ↔Na+ + CN‾ Н2О ↔ OH ‾ + H+
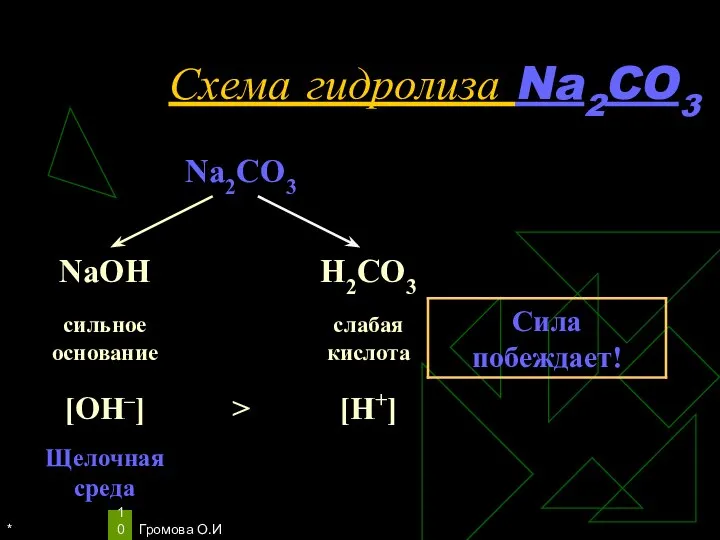
- 10. * Громова О.И Схема гидролиза Na2CO3
- 11. * Громова О.И Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН–
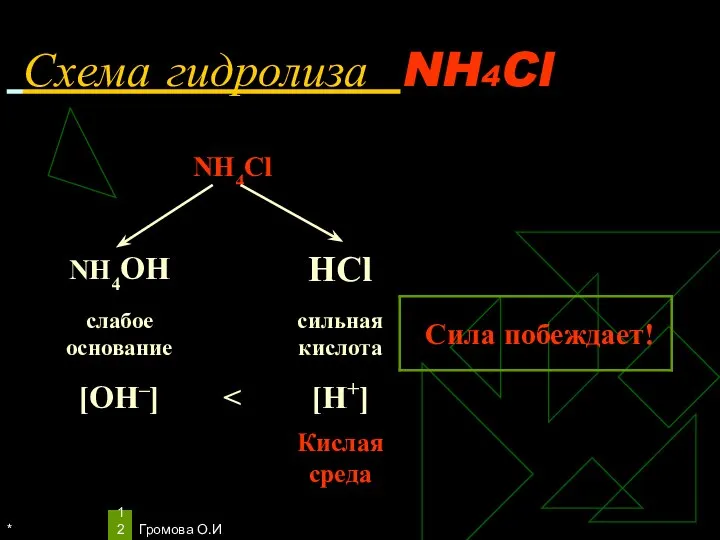
- 12. * Громова О.И Схема гидролиза NH4Cl
- 13. * Громова О.И Уравнения гидролиза NH4Cl NH4Cl ↔ NH4+ + Сl– Н2O ↔ Н+ + ОН–
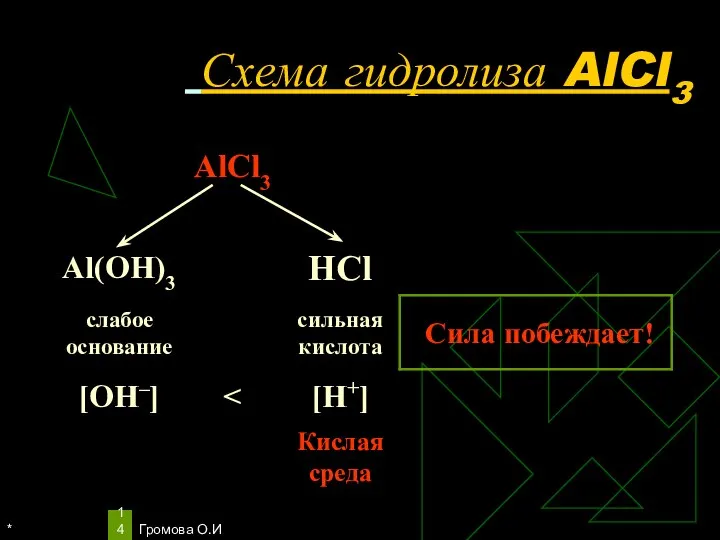
- 14. * Громова О.И Схема гидролиза AlCl3
- 15. * Громова О.И Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН–
- 16. * Громова О.И Схема гидролиза Al2S3
- 17. * Громова О.И Уравнения гидролиза Al2S3 Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Гидролиз по катиону и аниону.
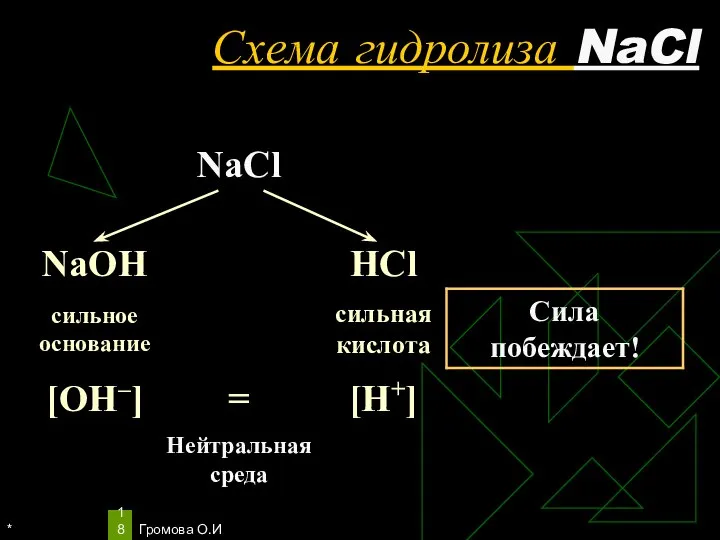
- 18. * Громова О.И Схема гидролиза NaCl
- 19. * Громова О.И Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН–
- 20. * Громова О.И Выполните следующие задания Какую среду будут иметь водные растворы следующих солей: 1 вариант
- 21. * Громова О.И Ответы
- 22. * Громова О.И Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+
- 23. б) 1 вариант K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – _____________________________________ 2K+
- 24. * Громова О.И Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+
- 25. * Громова О.И Задания ЕГЭ
- 26. * Громова О.И Задания В-4 (ЕГЭ) 1. Установите соответствие между составом соли и реакцией среды её
- 27. * Громова О.И 2. Установите соответствие между составомсоли и реакцией среды её водного раствора.
- 28. * Громова О.И 3. Установите соответствие между названием соли и средой её водного раствора.
- 29. * Громова О.И Задние на дом: Параграф 18, № 1-11. В контакте. Ru, в заметках, материал
- 31. Скачать презентацию























 Металлы II, побочной подгруппы ПСХЭ
Металлы II, побочной подгруппы ПСХЭ Рідкі кристали
Рідкі кристали Метаморфогенные месторождения
Метаморфогенные месторождения Фармацевтические эмульсии
Фармацевтические эмульсии Массообменные процессы
Массообменные процессы Химические свойства металлов
Химические свойства металлов Эластомеры (резины)
Эластомеры (резины) Сіль амонію
Сіль амонію  Термодинамика. Законы термодинамики
Термодинамика. Законы термодинамики Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть
Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть  Липиды. Химические свойства
Липиды. Химические свойства Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Великие русские химики
Великие русские химики Аттестационная работа. Методическая разработка исследователького урока Строение вещества. Молекулы и атомы
Аттестационная работа. Методическая разработка исследователького урока Строение вещества. Молекулы и атомы Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Коррозия металлов в машиностроении.
Коррозия металлов в машиностроении. Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Химическая номенклатура
Химическая номенклатура Алкины. Пропин
Алкины. Пропин ВЕЩЕСТВА МОЛЕКУЛЯРНОГО СТРОЕНИЯ. ЗАКОН ПОСТОЯНСТВА СОСТАВА.
ВЕЩЕСТВА МОЛЕКУЛЯРНОГО СТРОЕНИЯ. ЗАКОН ПОСТОЯНСТВА СОСТАВА. Розчини електролітів
Розчини електролітів Нобелевская премия по химии
Нобелевская премия по химии Роль химии в жизни человека
Роль химии в жизни человека Полярография и измерение рН
Полярография и измерение рН Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10)
Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10) Cellulase. Introduction (source)
Cellulase. Introduction (source) Текстиль
Текстиль