Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей
Содержание
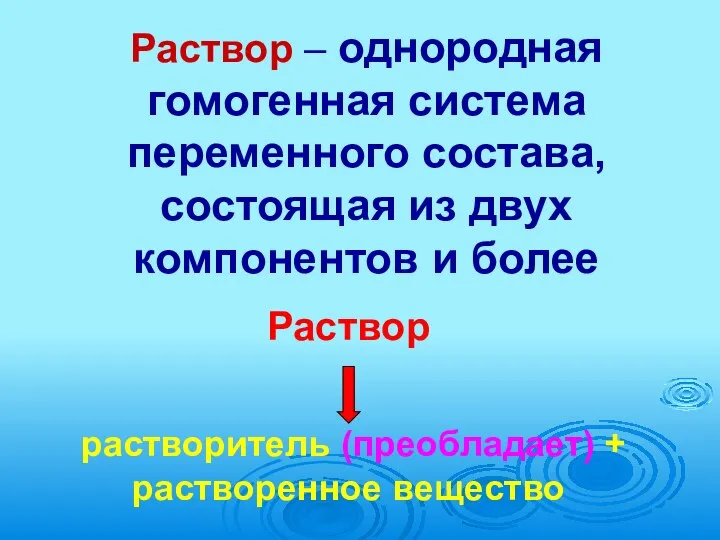
- 2. Раствор – однородная гомогенная система переменного состава, состоящая из двух компонентов и более Раствор растворитель (преобладает)
- 3. от размеров распределенных частиц: взвеси (размер частиц – 10-5 – 10-7 м.) истинные (менее 10-9 м.)
- 4. качественная характеристика растворов: разбавленный (низкое содержание растворенного вещества) концентрированный (высокое содержание)
- 5. количественный состав раствора молярная концентрация - количество растворенного вещества, содержащееся в 1 литре раствора, моль\л
- 6. количественный состав раствора моляльность - количество растворенного вещества, содержащееся в 1000 г. растворителя, моль\г
- 7. количественный состав раствора массовая доля растворенного вещества (W) - отношение массы вещества к массе раствора, %
- 8. РАСТВОРЕНИЕ – самопроизвольный физико-химический процесс, при котором происходит взаимодействие между частицами растворителя и растворенного вещества обратный
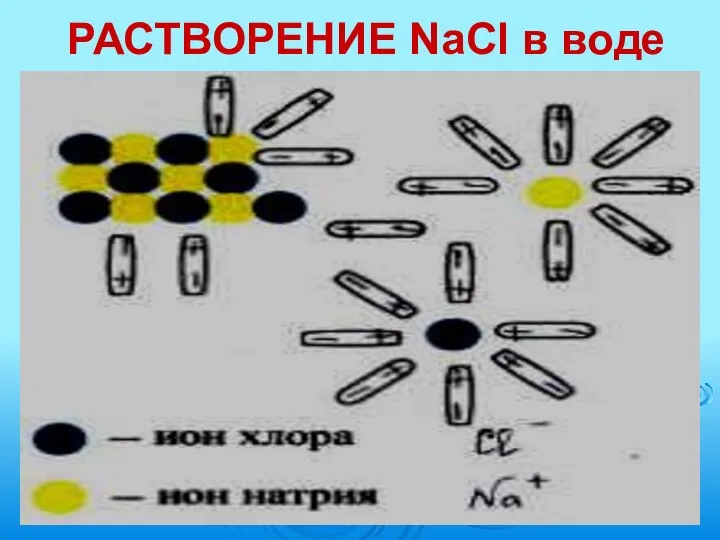
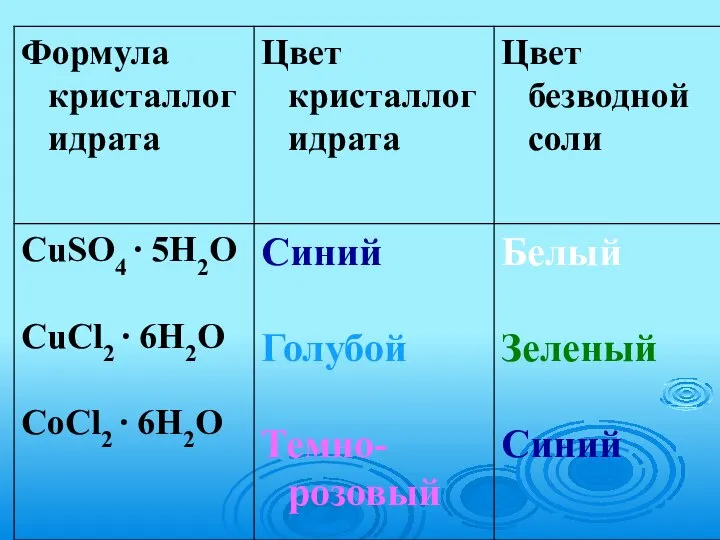
- 9. РАСТВОРЕНИЕ NaCl в воде
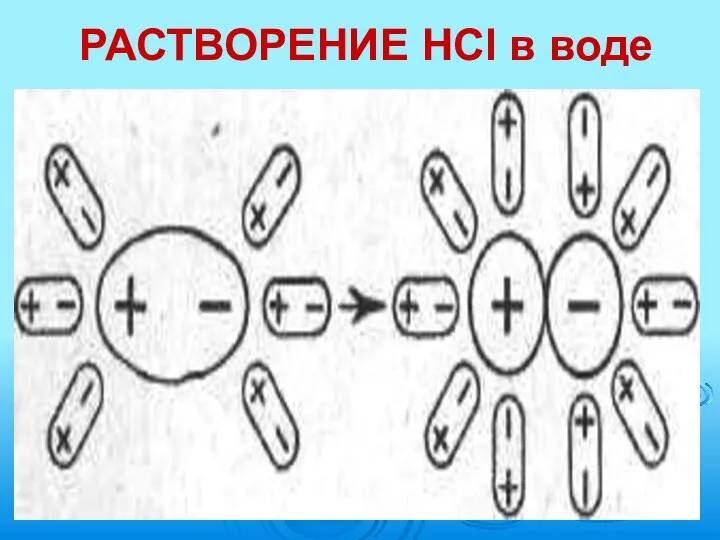
- 10. РАСТВОРЕНИЕ HCl в воде
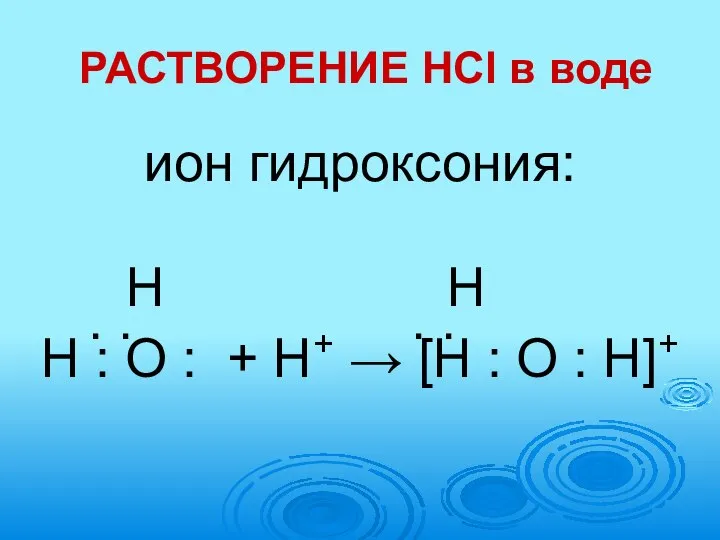
- 11. РАСТВОРЕНИЕ HCl в воде ион гидроксония: Н Н . . . . Н : О :
- 12. Механизм диссоциации веществ с ионным типом связи ориентация молекул – диполей воды около ионов кристалла
- 13. Механизм диссоциации веществ с ионным типом связи гидратация (взаимодействие) молекул воды с противоположными ионами поверхностного слоя
- 14. Механизм диссоциации веществ с ионным типом связи диссоциация (распад) кристалла электролита на гидратированные ионы.
- 15. Механизм диссоциации веществ с ковалентной полярной связью ориентация молекул – диполей воды вокруг полюсов молекулы электролита
- 16. Механизм диссоциации веществ с ковалентной полярной связью гидратация (взаимодействие) молекул воды с молекулами электролита
- 17. Механизм диссоциации веществ с ковалентной полярной связью ионизация молекул электролита (превращение ковалентной полярной связи в ионную)
- 18. Механизм диссоциации веществ с ковалентной полярной связью диссоциация (распад) кристалла электролита на гидратированные ионы.
- 19. Гидратная оболочка – окружение иона, состоящее из одного или нескольких слоев определенным образом ориентированных молекул воды.
- 20. теплота растворения - тепловая энергия, выделяемая или поглощаемая при растворении веществ
- 21. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Аррениус, 1877 г. ОСНОВНЫЕ ПОЛОЖЕНИЯ 1. При растворении в воде электролиты диссоциируют на
- 22. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ОСНОВНЫЕ ПОЛОЖЕНИЯ 2. Диссоциация – обратимый процесс. Кристаллизация.
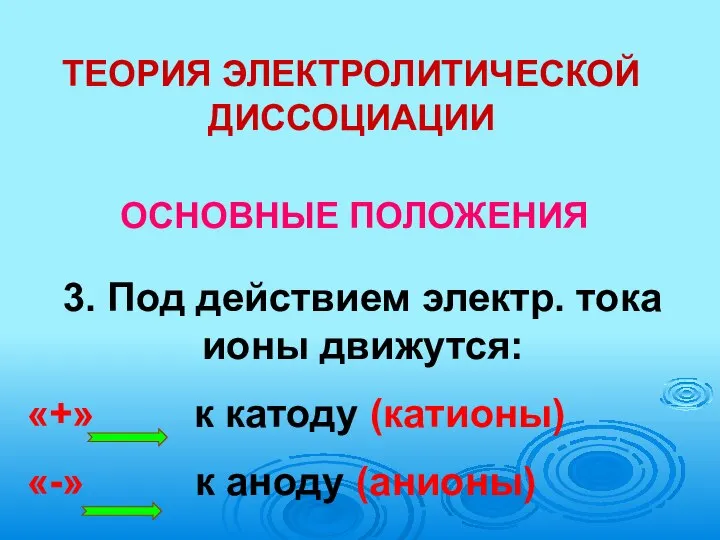
- 23. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ОСНОВНЫЕ ПОЛОЖЕНИЯ 3. Под действием электр. тока ионы движутся: «+» к катоду (катионы)
- 24. Электролиты - вещества, водные растворы которых диссоциируют на ионы и проводят электрический ток (это соединения с
- 25. электролитическая диссоциация - распад электролитов на ионы AB ↔ A+ + B-
- 26. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Д. Менделеев, И. Каблуков, В. Кистяковский В растворе находятся не свободные ионы, а
- 28. Степень диссоциации (α - альфа) - отношение числа молекул, распавшихся на ионы, к исходному числу молекул
- 29. Степень диссоциации зависит от: природы электролита, температуры, концентрации раствора
- 30. В зависимости от α: сильные электролиты (α ≥ 30%) HCl, NaOH, почти все соли слабые (α
- 31. Водородный показатель рН – мера активности Н+ в растворе (1909 г., Сёренсен – «сила водорода»)
- 32. Н2О ↔ Н+ + ОН- При 250С И.П. = [Н+] . [ОН-] = 10-14 моль2\л2 [Н+]
- 33. Водородный показатель «-» десятичный логарифм молярной концентрации ионов Н+ Нейтральная среда – [H+] = [ОH-], рН
- 34. Кислоты - электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода HNO3 ↔ H+
- 35. Многоосновные кислоты H3PO4 ↔ H+ + H2PO4- (α = 27%) H2PO4- ↔ H+ + HPO42- (α
- 36. Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы KOH ↔ K+ +
- 37. Многокислотные основания Ba(OH)2 ↔ BaOH+ + OH- BaOH+ ↔ Ba2+ + OH-
- 38. Амфотерные соединения в кислой среде ведут себя как основания: Zn(OH)2 + 2HCL ↔ ZnCL2 + 2H2O
- 39. Амфотерные соединения в щелочной среде – как кислоты: Zn(OH)2 + 2NaOH ↔Na2ZnO2 + 2H2O
- 40. Амфотерные соединения в общем виде: 2H+ + ZnO22- ↔ H2ZnO2 ↔ Zn(OH)2 ↔ Zn2+ + 2OH-
- 41. Амфотерные соединения H+ + RO- ↔ ROH ↔ R+ + OH- В щелочной среде В кислой
- 42. Соли – электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
- 43. Средние соли CuSO4 ↔ Cu2+ + SO42- Al2(SO4)3 ↔ 2Al3+ + 3SO42-
- 44. Кислые соли NaHCO3 ↔ Na+ + HCO3- HCO3- ↔ H+ + CO32-
- 45. Основные соли BaOHCl ↔ BaOH+ + Cl- BaOH+ ↔ Ba2+ + OH-
- 46. Ионные реакции KCl + AgNO3 = KNO3 + AgCl↓ - молекулярное уравнение K+ + Cl- +
- 47. Ионные реакции Реакции обмена в р-рах электролитов происходят, если образуется: малодиссоциирующее в-во, осадок, газ.
- 48. Задание 1. Напишите полные и сокращенные ионные уравнения реакций между растворами: - гидроксида калия и нитрата
- 49. Задание 1. Напишите полные и сокращенные ионные уравнения реакций между растворами: - гидроксида калия и серной
- 50. Задание 1. Напишите полные и сокращенные ионные уравнения реакций между растворами: - хлорида железа (III) и
- 51. Задание 1. Напишите полные и сокращенные ионные уравнения реакций между растворами: - карбоната калия и хлорида
- 52. Гидролиз солей Na2SiO3 - щелочные свойства р-ра Al2(SO4)3 – кислые NaCl - нейтральные Почему?
- 53. Гидролиз Разложение воды («гидро» - вода, «лизис» – разложение) HOH ↔ H+ + OH-
- 54. Гидролиз – взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и к избыточному
- 55. Гидролиз Соль образована сильным основанием и слабой кислотой Соль образована слабым основанием и сильной кислотой Соль
- 56. Как определить слабое или сильное? В школьной таблице растворимости три сильных кислоты (H2SO4, HCl, HNO3), остальные
- 57. Как определить слабое или сильное? Cлабые основания нерастворимы. Исключения: NН4ОН - растворимое, но слабое а Ca(OH)2
- 58. Как определить слабое или сильное? Вывод о силе кислородсодержащей кислоты можно сделать, если выразить ее состав
- 59. Хлорная: HClO4 Мышьяковая: H3AsO4 Ортоборная: H3BO3 Телуровая: H6TeO6
- 60. ГИДРОЛИЗ Соль образована сильным основанием и слабой кислотой Например, CH3COONa (образована СH3COOH – слабая кислота и
- 61. CH3COONa + HOH ↔ CH3COOH + NaOH CH3COO- + Na+ + HOH ↔ CH3COOH + Na+
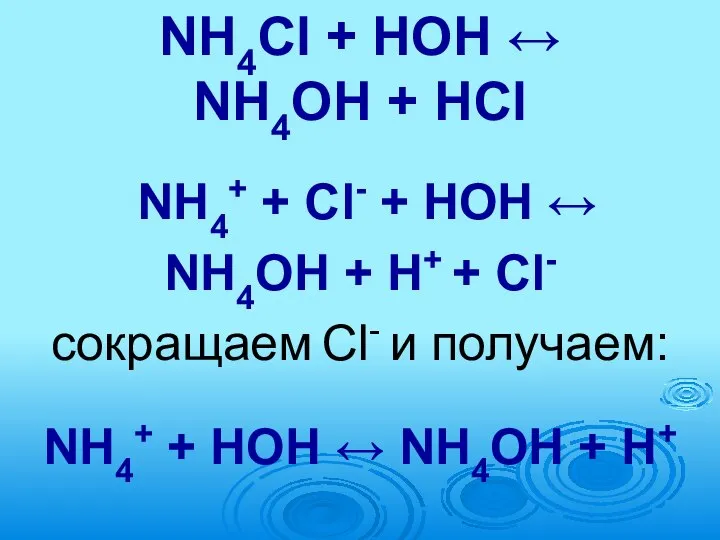
- 62. ГИДРОЛИЗ 2. Соль образована слабым основанием и сильной кислотой Например, NH4Cl (образована NH4OH – слабое основание
- 63. NH4Cl + НОН ↔ NH4ОН + HСl NH4+ + Cl- + НОН ↔ NH4ОН + H+
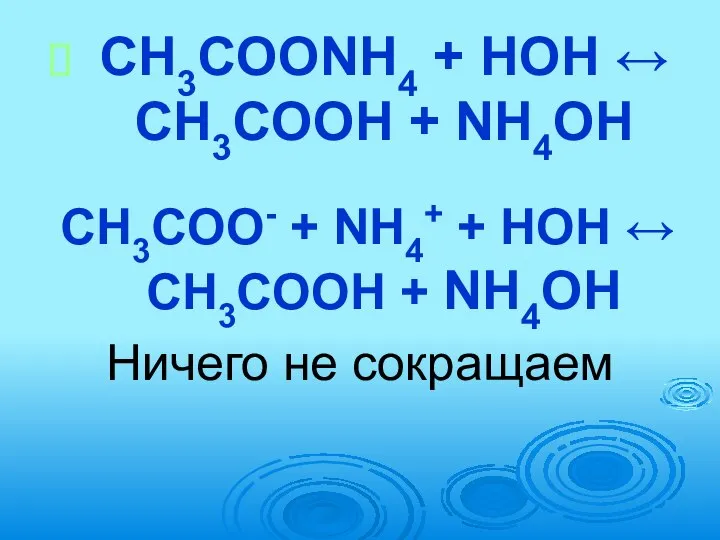
- 64. ГИДРОЛИЗ 3. Соль образована слабым основанием и слабой кислотой Например, CH3COONH4 (образована CH3COОН – слабая кислота
- 65. CH3COONH4 + HOH ↔ CH3COOH + NH4OH CH3COO- + NH4+ + HOH ↔ CH3COOH + NH4OH
- 66. Константы диссоциации уксусной кислоты и гидроксида аммония близки между собой (1,76 х 10-5 и 1,79 х
- 67. ГИДРОЛИЗ 4. Соль образована сильным основанием и сильной кислотой гидролизу не подвергается pH = 7 Например,
- 68. Ступенчатый ГИДРОЛИЗ Соль образована слабой многоосновной кислотой и сильным основанием На промежуточных стадиях образуются кислые соли
- 69. Например, Na2CO3 (образована – H2CO3 - слабая двухосновная кислота и NaOH – сильное основание) На промежуточной
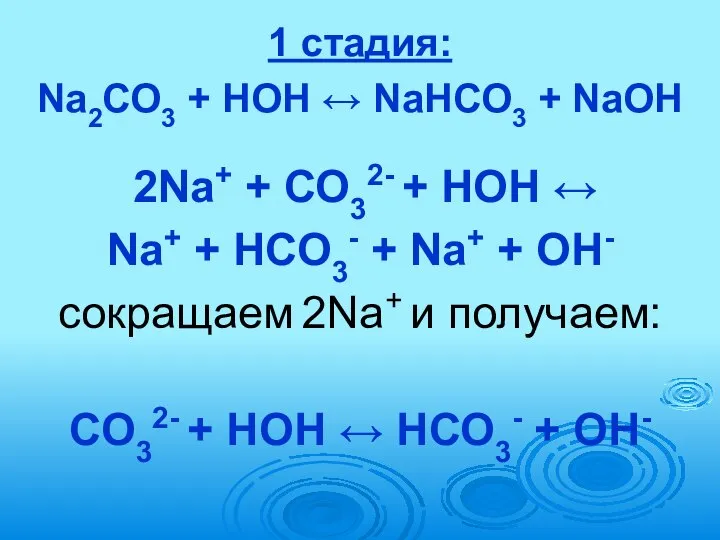
- 70. 1 стадия: Na2СО3 + HOH ↔ NaНСО3 + NaOH 2Na+ + СО32- + HOH ↔ Na+
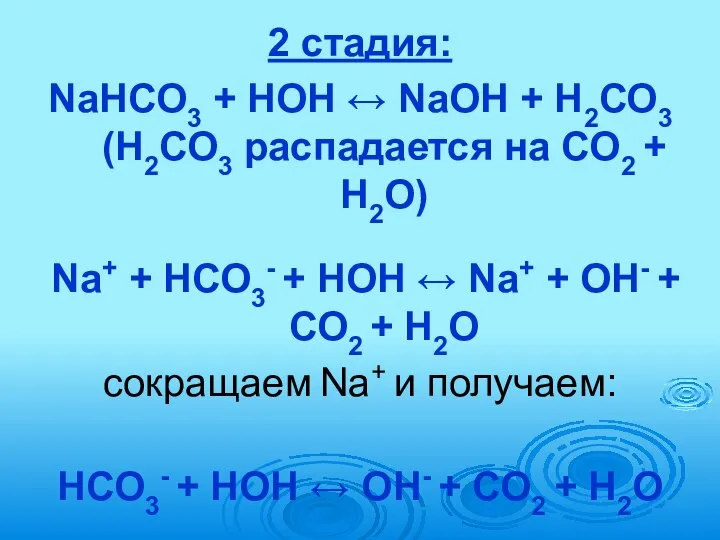
- 71. 2 стадия: NaНСО3 + HOH ↔ NaOH + Н2СО3 (Н2СО3 распадается на СО2 + Н2О) Na+
- 72. Ступенчатый ГИДРОЛИЗ Соль образована слабым многокислотным основанием и сильной кислотой На промежуточных стадиях образуются основные соли
- 73. Например, CuCl2 (образована – Сu(OH)2 - слабое двухкислотное основание и HCl – сильная кислота) На промежуточной
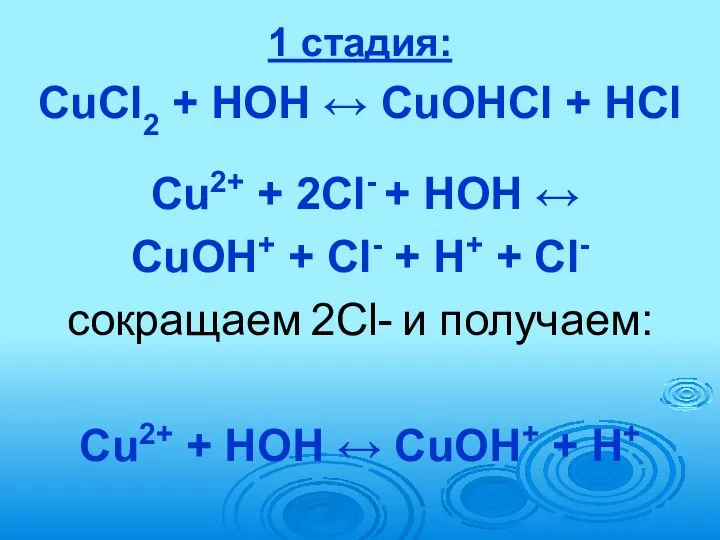
- 74. 1 стадия: CuCl2 + HOH ↔ CuOHCl + HCl Cu2+ + 2Сl- + HOH ↔ CuOH+
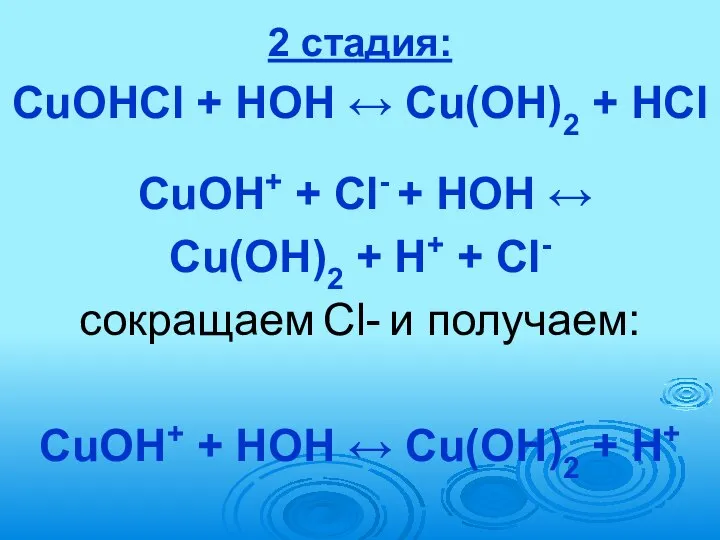
- 75. 2 стадия: CuOHCl + HOH ↔ Cu(OH)2 + HCl CuOH+ + Сl- + HOH ↔ Cu(OH)2
- 76. ГИДРОЛИЗ Обратимый Усиливается при: нагревании разбавлении р-ра удалении продуктов гидролиза
- 77. ГИДРОЛИЗ Необратимый (если продукты нерастворимы или летучи)
- 78. Задание 2. Составьте ионные уравнения, отвечающие гидролизу: - цианида калия, - нитрата калия, - сульфида натрия,
- 79. Задание 2. Составьте ионные уравнения, отвечающие гидролизу: - карбоната калия, - хлорида железа (II), - сульфата
- 81. Скачать презентацию
























![Н2О ↔ Н+ + ОН- При 250С И.П. = [Н+] .](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/643885/slide-31.jpg)









































 Биохимия нервной ткани
Биохимия нервной ткани Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Минералы. Галенит
Минералы. Галенит Химические свойства хрома
Химические свойства хрома Функции белков
Функции белков Кремний и его соединения
Кремний и его соединения Химические свойства полимеров
Химические свойства полимеров Классификация органических реакций в органической химии
Классификация органических реакций в органической химии Водород. Получение водорода
Водород. Получение водорода Атмосфера. Химические и физико-химические процессы в атмосфере
Атмосфера. Химические и физико-химические процессы в атмосфере Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Одноатомные спирты
Одноатомные спирты Фенол қосылыстары
Фенол қосылыстары Белки, или протеины
Белки, или протеины Именные реакции в органической химии
Именные реакции в органической химии Кристаллы вокруг нас
Кристаллы вокруг нас Установление структуры биополимеров
Установление структуры биополимеров Рибофлавин - витамин красоты
Рибофлавин - витамин красоты Загальна характеристика рослинних кормiв. (Тема 1)
Загальна характеристика рослинних кормiв. (Тема 1) Ферменты гидролиза и биосинтеза нуклеиновых кислот
Ферменты гидролиза и биосинтеза нуклеиновых кислот ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите
ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см
Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см Використання натуральних та штучних добавок при виготовленні харчових продукцій
Використання натуральних та штучних добавок при виготовленні харчових продукцій Крахмал. Физические свойства
Крахмал. Физические свойства Оксиды
Оксиды  Синтетикалық полимерлер (пластиктер)
Синтетикалық полимерлер (пластиктер)