Содержание
- 2. ЭЛЕМЕНТ ВОДОРОД Самый лёгкий Ar(H) = 1 а.е.м. Самый маленький радиус атома Hydrogenium – рождающий воду
- 3. ПРОСТОЕ ВЕЩЕСТВО ВОДОРОД Простое вещество – двухатомная молекула H2 Газ б/цв., б/запаха, плохо растворим в воде
- 4. ПОЛУЧЕНИЕ ВОДОРОДА H2 В лаборатории (Генри Кавендиш XVII в.): Me + кислота = соль + H2↑
- 5. Допишите уравнения химических реакций: Mg + 2HCl (соляная кислота) → MgIIClI2 + H2↑ Al + HCl
- 6. В промышленности: C + H2O → CO↑ + H2↑ (синтез-газ) газопаровая конверсия угля CH4 + H2O
- 7. ХИМИЧЕСКИЕ СВОЙСТВА H2 : O2 = 2 : 1 – гремучий газ Me + H2 →
- 8. БИНАРНЫЕ СОЕДИНЕНИЯ ВОДОРОДА С металлами MenH-1n гидриды LiIHI – гидрид лития NaIHI – гидрид натрия KIHI
- 9. Cl2 + H2 → S + H2 → C + H2 → O2 + H2 →
- 10. ПРИМЕНЕНИЕ ВОДОРОДА
- 11. ГЛАВА III КИСЛОТЫ
- 12. КИСЛОТА – это сложное вещество, состоящее из атомов водорода (способных замещаться на металл) и кислотного остатка.
- 14. КЛАССИФИКАЦИЯ КИСЛОТ
- 15. КЛАССИФИКАЦИЯ КИСЛОТ
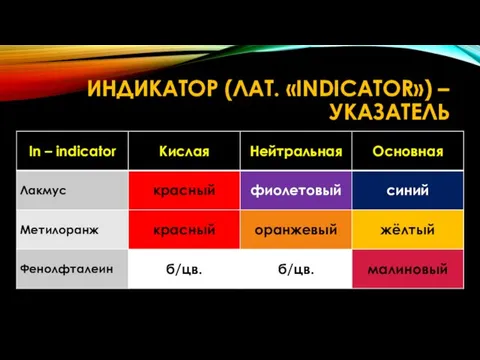
- 16. ИНДИКАТОР (ЛАТ. «INDICATOR») – УКАЗАТЕЛЬ
- 17. ГЛАВА III СОЛИ
- 18. СОЛЬ – это сложное вещество, состоящее из атомов металла и кислотного остатка. Mex(SO4)у
- 19. ФИЗИЧЕСКИЕ СВОЙСТВА Все соли твёрдые вещества Многие хорошо растворимы в воде (см. таблица растворимостей) Могут содержать
- 20. ПОЛУЧЕНИЕ СОЛЕЙ Me + кислота → соль + H2↑, где Me – активный или средней активности
- 21. ПОЛУЧЕНИЕ СОЛЕЙ Me1 + соль1 → Me2 + соль2, где Me1 – более активный, чем Me2,
- 22. СОСТАВЛЕНИЕ ФОРМУЛ СОЛЕЙ Названия солей составляют из названия кислотного остатка (в именительном падеже) и металла (в
- 23. ГЛАВА III КИСЛОТНЫЕ ОКСИДЫ
- 24. КИСЛОТНЫЙ ОКСИД (или ангидрид кислоты) – это оксид, которому соответствует кислородсодержащая кислота. «ангидрид» – «безводный» !!!
- 25. B2O3 + 3H2O = 2H3BO3 оксид бора(III) борная кислота CO2 + H2O = H2CO3 оксид углерода(IV)
- 27. Скачать презентацию























 Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства
Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть
Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть  Termodünaamika. Entroopia. (Loeng 8)
Termodünaamika. Entroopia. (Loeng 8) Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях
Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка
Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка  Тема: хімія та їжа
Тема: хімія та їжа Устойчивость дисперсных систем
Устойчивость дисперсных систем Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Сульфаты и оксиды металлов
Сульфаты и оксиды металлов Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов
Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов Структурная химия катионов переходных элементов
Структурная химия катионов переходных элементов Окислительно-восстановительные реакции. Химическое равновесие
Окислительно-восстановительные реакции. Химическое равновесие Силикатное производство
Силикатное производство Амины
Амины Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації в організмі
в організмі  Презентация Углекислый газ СО2
Презентация Углекислый газ СО2  Электролитическая диссоциация
Электролитическая диссоциация Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Изучение свойств природных индикаторов, содержащихся в растениях
Изучение свойств природных индикаторов, содержащихся в растениях Презентация Строение и свойства циклоалканов.
Презентация Строение и свойства циклоалканов.  Композитные материалы
Композитные материалы Дисперсные системы Эмульсии. Пены. Порошки
Дисперсные системы Эмульсии. Пены. Порошки Сложные эфиры. Жиры
Сложные эфиры. Жиры Аттестационная работа. Программа регионального компонента образовательной области Химия
Аттестационная работа. Программа регионального компонента образовательной области Химия