Содержание
- 2. Химическая связь Ковалентная Ионная Металлическая Водородная
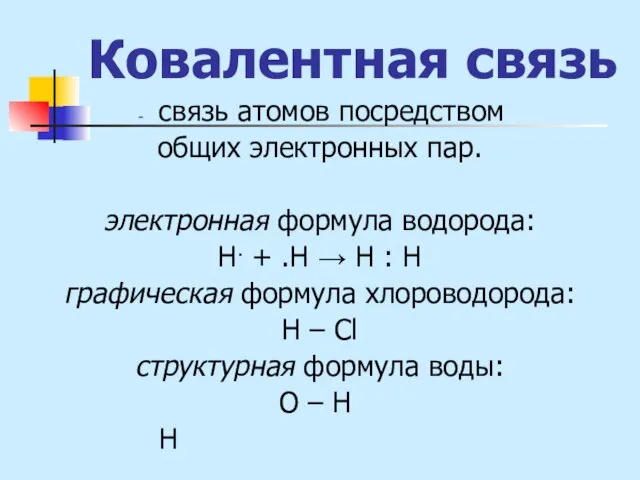
- 3. Ковалентная связь связь атомов посредством общих электронных пар. электронная формула водорода: Н. + .Н → Н
- 4. Электроотрицательность – свойство атомов оттягивать к себе общие электронные пары, связывающие их с другими атомами. Ряд
- 5. Ковалентная связь Неполярная - в простых веществах, состоящих из одинаковых атомов (Н : Н), е пара
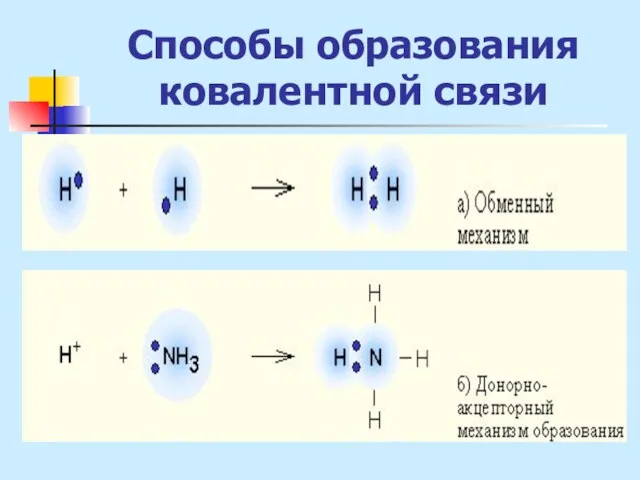
- 6. Способы образования ковалентной связи 1. Обменный механизм: за счет неспаренных е невозбужденного атома (Н2О, NН3) за
- 7. Способы образования ковалентной связи 2. Донорно-акцепторный механизм - при взаимодействии одного атома с заполненной атомной орбиталью
- 8. Способы образования ковалентной связи
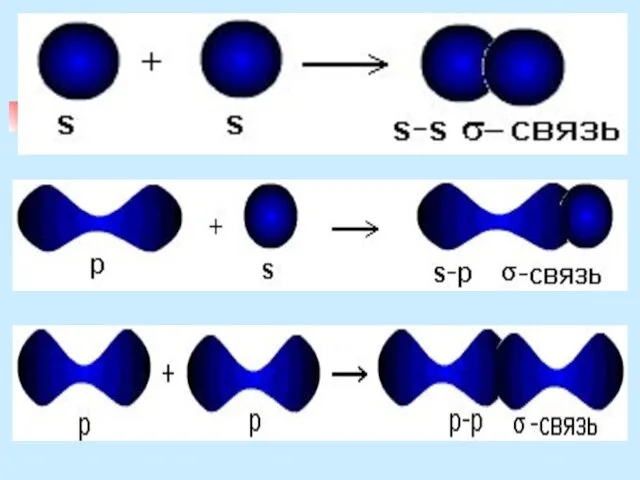
- 9. Классификация ковалентных связей В зависимости от направления перекрывания атомных орбиталей различают σ- и π-связи. σ -связь
- 10. σ-связь за счет перекрывания s-орбиталей атомов за счет перекрывания s- и р-орбиталей за счет перекрывания р-
- 12. π – связь за счет перекрывания двух р-орбиталей, расположенных перпендикулярно оси, соединяющей ядра атомов при перекрывании
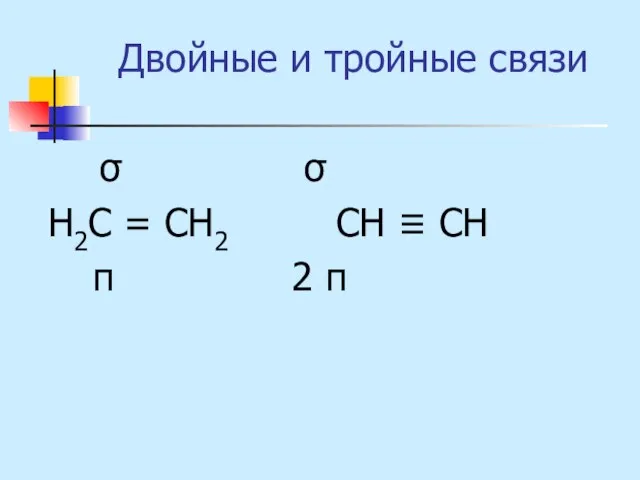
- 14. Двойные и тройные связи σ σ Н2С = СН2 СН ≡ СН π 2 π
- 15. Гибридизация атомных орбиталей смешивание s- и р-орбиталей атома
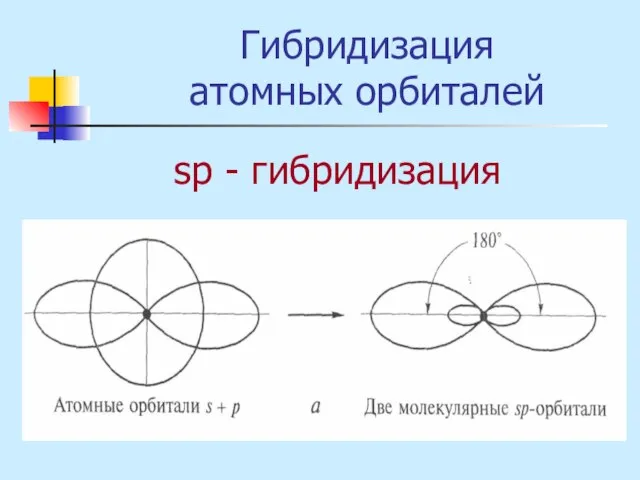
- 16. Гибридизация атомных орбиталей sр - гибридизация
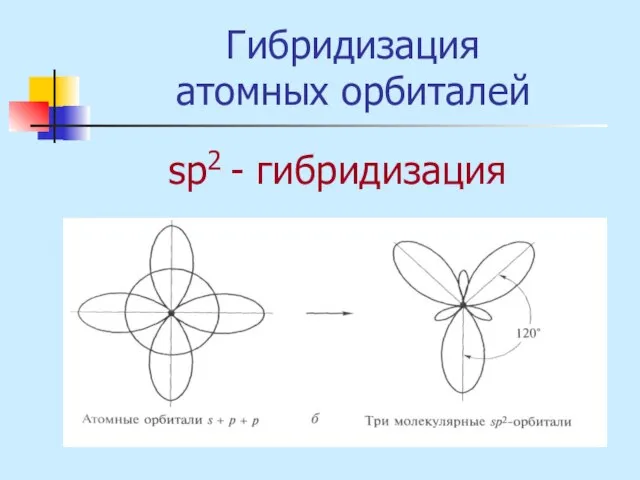
- 17. Гибридизация атомных орбиталей sр2 - гибридизация
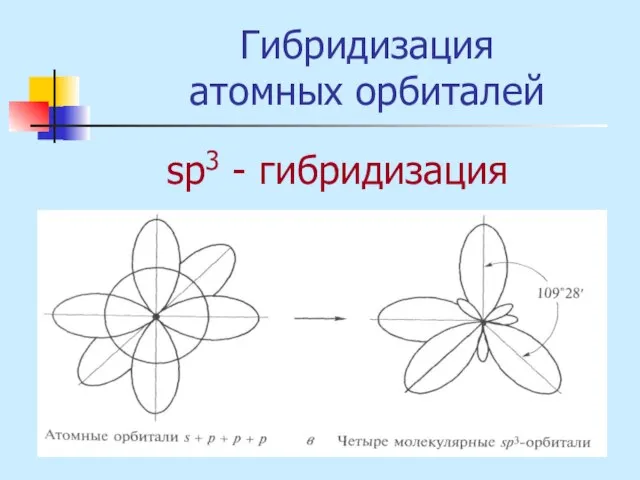
- 18. Гибридизация атомных орбиталей sр3 - гибридизация
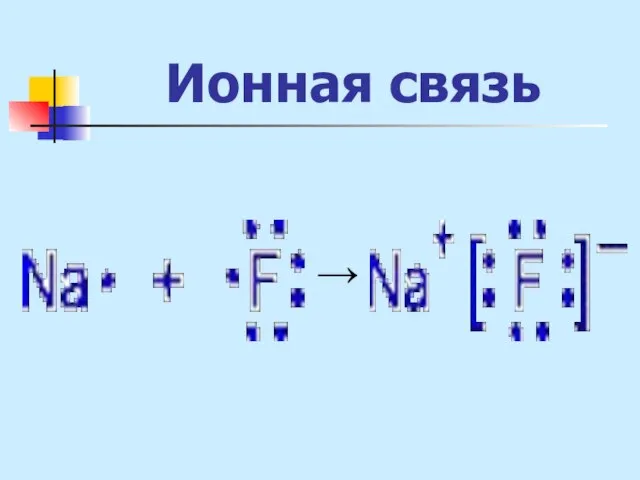
- 19. Ионная связь - связь между атомами за счет электростатического притяжения ионов, образующихся вследствие полного перехода е
- 20. Ионная связь Если разница электроотрицательностей атомов по шкале Полинга превышает 2,0 , то между ними ионная
- 21. Ионная связь
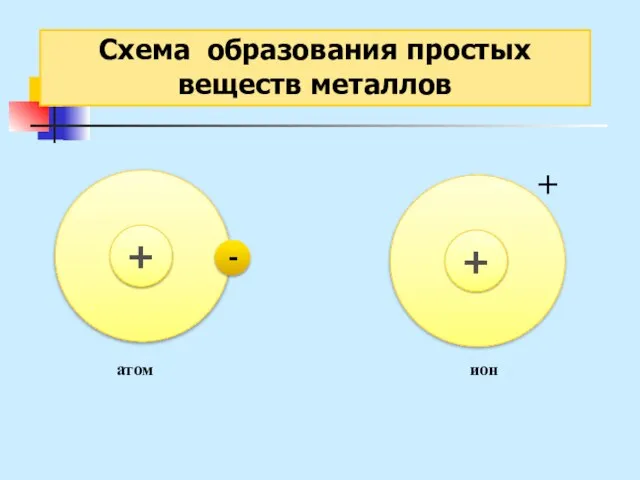
- 22. Металлическая связь - связь, основанная на обобществлении внешних е, принадлежащих не двум, а практически всем атомам
- 23. Схема образования простых веществ металлов атом ион
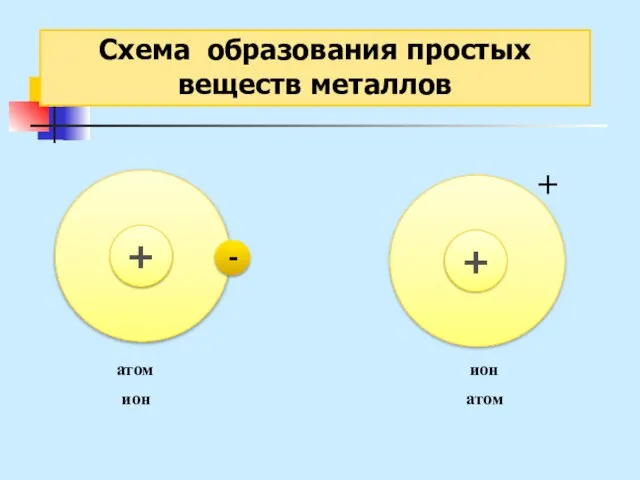
- 24. Схема образования простых веществ металлов - + + атом ион ион атом
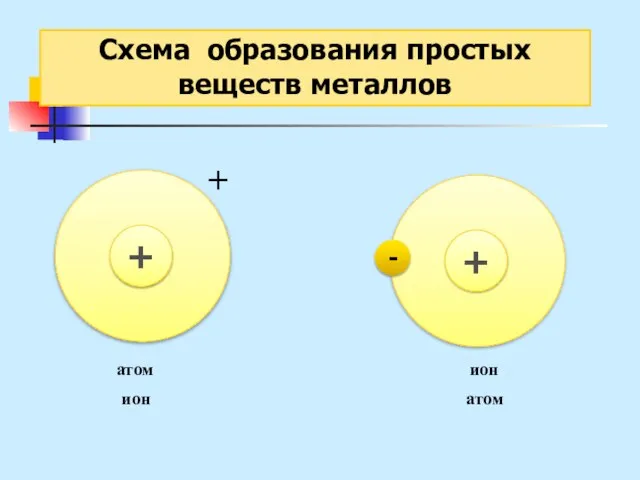
- 25. Схема образования простых веществ металлов - + + ион атом атом ион
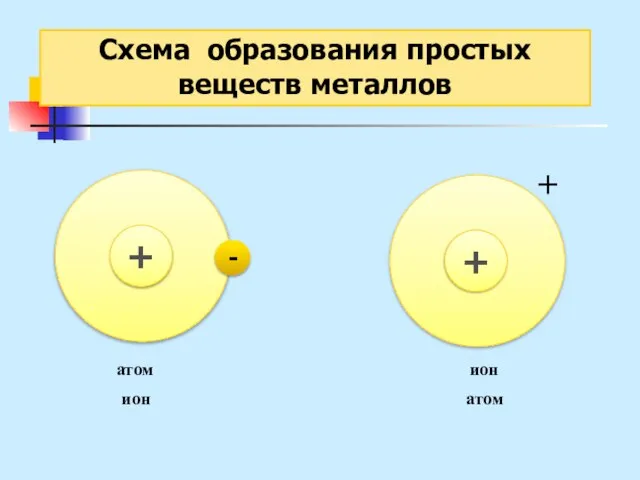
- 26. Схема образования простых веществ металлов - + + атом ион ион атом
- 27. Схема образования простых веществ металлов Металлическая связь – это связь в металлах или сплавах, образуемая между
- 28. неМе + неМе (простое вещество неметалл) Э.О. = Э.О. – ковалентная неполярная связь Ме + неМе
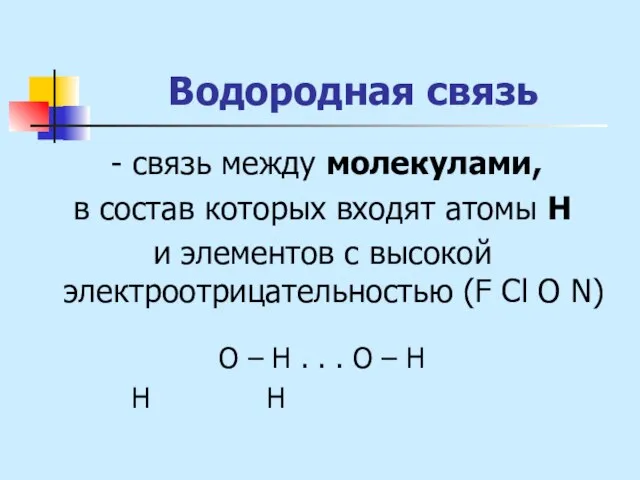
- 29. Водородная связь - связь между молекулами, в состав которых входят атомы Н и элементов с высокой
- 31. Скачать презентацию















 Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Конкурс проектных работ «Химический элемент … – и это все о нем»
Конкурс проектных работ «Химический элемент … – и это все о нем» Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу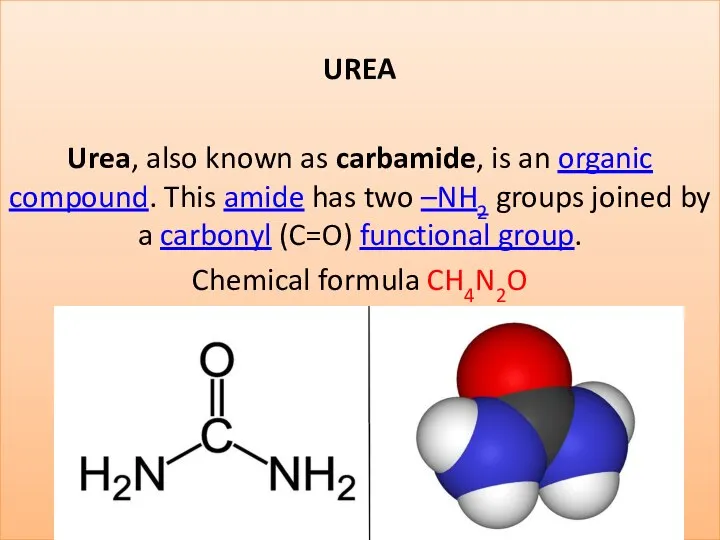 Urea (carbamide)
Urea (carbamide) Процессы минералообразования
Процессы минералообразования Предельные одноатомные спирты
Предельные одноатомные спирты  Занимательные опыты по химии
Занимательные опыты по химии Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2)
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. (Лекция 2) Дифференциация магмы
Дифференциация магмы Элементы кристаллохимии
Элементы кристаллохимии Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1
Основные объекты исследования биофизики клеточных и мембранных процессов. Лекция 3-1 “B” (бор) как химический элемент
“B” (бор) как химический элемент Металлы в природе
Металлы в природе Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Термохимия. Расчетные задачи. (Лекция 4.2)
Термохимия. Расчетные задачи. (Лекция 4.2) Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Металлы и их соединения
Металлы и их соединения Введение в термические процессы вторичной переработки нефти
Введение в термические процессы вторичной переработки нефти Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Тайна Е-621" - скачать смотреть
Презентация по Химии "Тайна Е-621" - скачать смотреть  Методические рекомендации по изучению курса «Коррозия и защита металлов»
Методические рекомендации по изучению курса «Коррозия и защита металлов» Применение этанола
Применение этанола Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы
Гликольді қышқыл. Алма қышқылы. Сүт қышқылы. Шарап қышқылы. Лимон қышқылы Презентация по Химии "Галогены" - скачать смотреть
Презентация по Химии "Галогены" - скачать смотреть