Содержание
- 2. Что называют химической реакцией?
- 3. Перечислите условия протекания химических реакций.
- 4. Перечислите внешние признаки протекания химических реакций.
- 5. Что называют уравнением химической реакции?
- 6. На основании какого закона составляют уравнения химических реакций?
- 7. Перечислите признаки классификации химических реакций.
- 8. Как классифицируют химические реакции по числу и составу исходных веществ и продуктов реакции?
- 9. Как классифицируют химические реакции по тепловому эффекту?
- 10. Как классифицируют химические реакции по изменению степеней окисления атомов ХЭ?
- 11. Можно ли управлять ходом химической реакции?
- 12. Скорость химических реакций Тема урока:
- 13. Что мы узнаем: Что такое скорость химических реакций. Как можно измерить скорость реакции. От чего зависит
- 14. Химические реакции в природе протекают с разными скоростями. Очень быстро протекают реакции в водных растворах, взрывы.
- 15. Быстро, но не мгновенно горит сера, цинк растворяется в соляной кислоте. Медленно образуется ржавчина на железных
- 16. Что называют скоростью в физике?
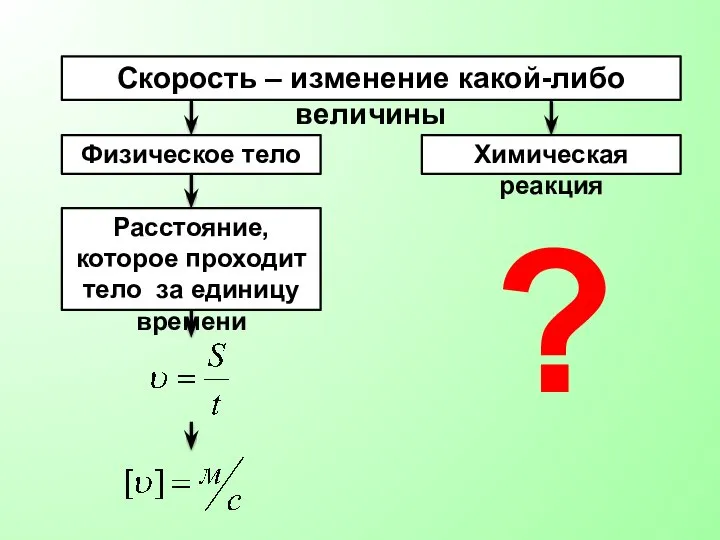
- 17. Скорость – изменение какой-либо величины Физическое тело Химическая реакция Расстояние, которое проходит тело за единицу времени
- 18. Как можно применить понятие «скорость» к химическим реакциям?
- 19. Как можно измерить скорость химической реакции? S + O2 = SO2 При взаимодействии 1 моль серы
- 20. n2 – n1 t2 – t1 ⋅ V ( ) = υ = + – C2
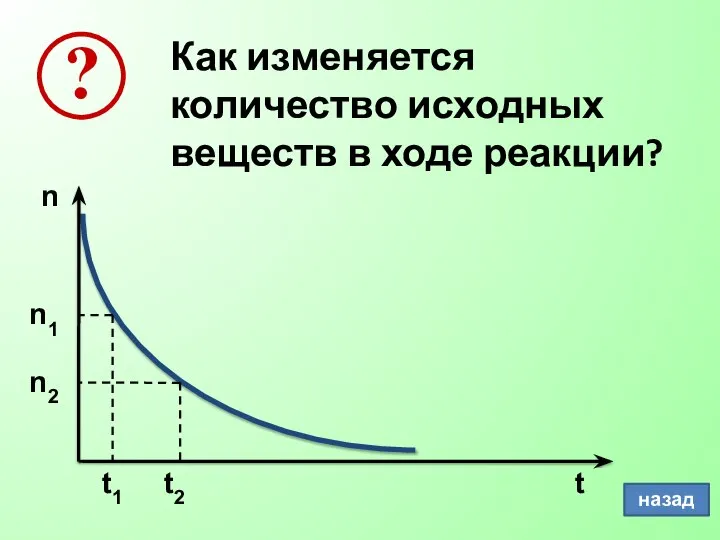
- 21. Как изменяется количество исходных веществ в ходе реакции? n1 n2 t1 t2 назад
- 22. Скорость химической реакции – изменение концентрации одного из веществ в единицу времени.
- 23. В каких единицах измеряют скорость химической реакции?
- 24. Демонстрационный опыт Опыт 1. Взаимодействие двух веществ, взятых в твердом виде. Опыт 2. Взаимодействие двух веществ,
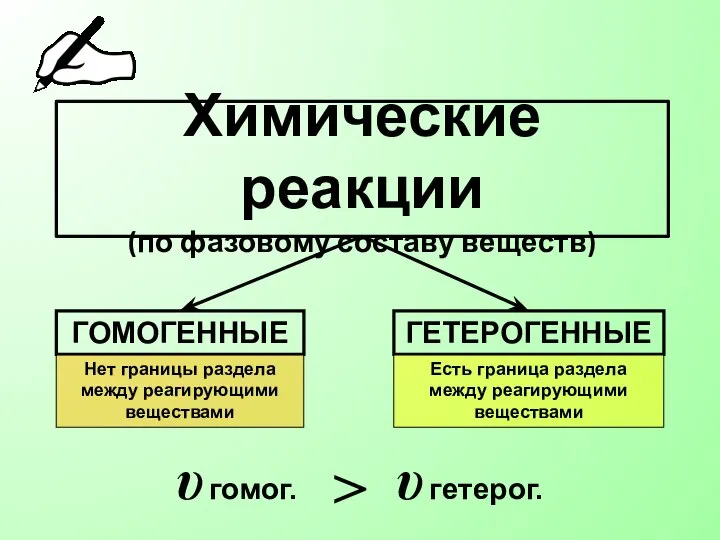
- 25. Химические реакции (по фазовому составу веществ) ГОМОГЕННЫЕ ГЕТЕРОГЕННЫЕ Нет границы раздела между реагирующими веществами Есть граница
- 26. Выберите гетерогенные системы: кислород – водород цинк – соляная кислота цинк – сера вода – спирт
- 27. От каких факторов зависит скорость химических реакций?
- 28. Скорость химических реакций зависит от: температуры; концентрации исходных веществ (давления – для газов); площади соприкосновения исходных
- 30. Демонстрационный опыт «Природа реагирующих веществ» 1) Mg + HCl = 2) Zn + HCl = 3)
- 31. Демонстрационный опыт «Концентрация веществ» 1) Zn + HCl(20%) = 2) Zn + HCl(10%) = ZnCl2 +
- 32. Закон действующих масс aA + bB = dD + fF C – концентрации исходных веществ k
- 33. Демонстрационный опыт «Температура» 1) Zn + 2HCl = 2) Zn + 2HCl = ZnCl2 + H2↑
- 34. Правило Вант-Гоффа При увеличении температуры на каждые 10о скорость химических реакций увеличивается в 2-4 раза. γ
- 35. Якоб Хендрик Вант-Гоффа Голландский химик. Один из основателей физической химии. Исследовал кинетику реакций, растворы, строение органических
- 36. Демонстрационный опыт «Площадь соприкосновения реагирующих веществ» 1) Zn(гранула) + 2HCl = 2) Zn(порошок) + 2HCl =
- 38. Скачать презентацию































 Periodic Table of the Elements
Periodic Table of the Elements Аэробное окисление углеводов. (Часть 1)
Аэробное окисление углеводов. (Часть 1) Химический элемент кремний
Химический элемент кремний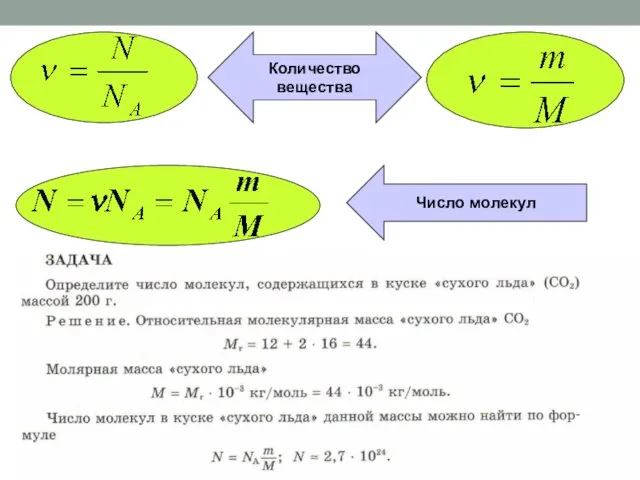 Виды состояния вещества
Виды состояния вещества Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Массовая доля вещества в растворе Задачи урока Выяснить: 1. Что такое «раствор». 2. Что такое «массовая доля» 3. Как использовать у
Массовая доля вещества в растворе Задачи урока Выяснить: 1. Что такое «раствор». 2. Что такое «массовая доля» 3. Как использовать у Су мен электролиттер алмасуы
Су мен электролиттер алмасуы Н2, NaCl, Ca, HCl
Н2, NaCl, Ca, HCl Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Медь
Медь Химия и производство. Химическая промышленность и химические технологии
Химия и производство. Химическая промышленность и химические технологии Основные классы неорганических соединений
Основные классы неорганических соединений Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Тест: полимеры
Тест: полимеры Ионы. Определение кислотности раствора
Ионы. Определение кислотности раствора Виды химической связи. Кристаллические решетки
Виды химической связи. Кристаллические решетки Жиры. Классификация жиров
Жиры. Классификация жиров Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Stereochemistry.Isomers are different compounds
Stereochemistry.Isomers are different compounds Химия и сельское хозяйство
Химия и сельское хозяйство Вермикулитовый концентрат
Вермикулитовый концентрат Презентация по Химии "Многоатомные спирты" - скачать смотреть бесплатно_
Презентация по Химии "Многоатомные спирты" - скачать смотреть бесплатно_ Презентация по Химии "Органическая химия" - скачать смотреть бесплатно
Презентация по Химии "Органическая химия" - скачать смотреть бесплатно Углеводы содержатся в клетках растительных и животных организмов
Углеводы содержатся в клетках растительных и животных организмов Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Презентация по Химии "Взаимосвязь химии и русского языка" - скачать смотреть
Презентация по Химии "Взаимосвязь химии и русского языка" - скачать смотреть  Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Презентация по Химии "окислительно- восстановительные реакции" - скачать смотреть
Презентация по Химии "окислительно- восстановительные реакции" - скачать смотреть