Содержание
- 2. K2SO4 --K2S– S HCl H2S Br2 C CuCl2
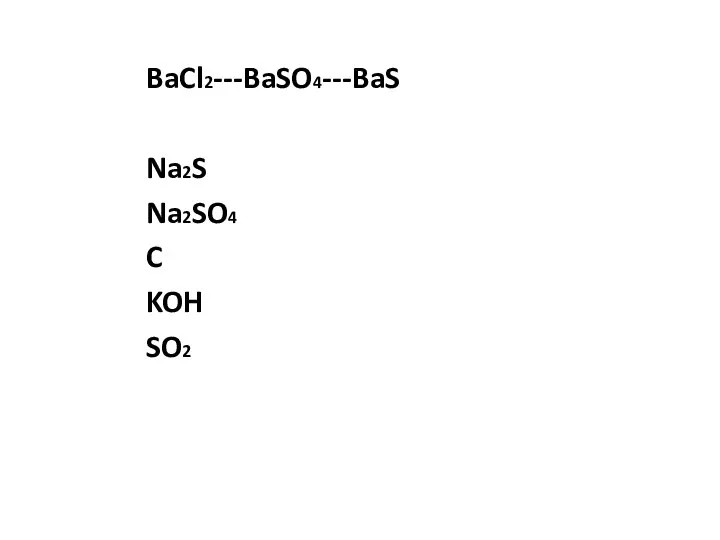
- 3. BaCl2---BaSO4---BaS Na2S Na2SO4 C KOH SO2
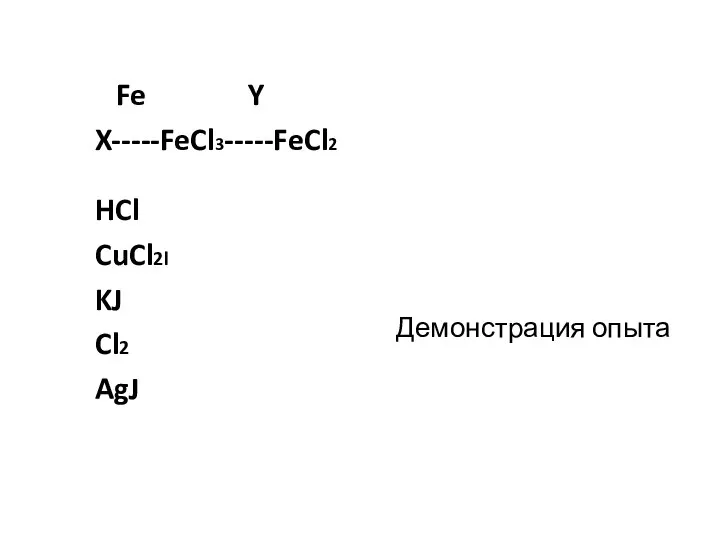
- 4. Демонстрация опыта Fe Y X-----FeCl3-----FeCl2 HCl CuCl2l KJ Cl2 AgJ
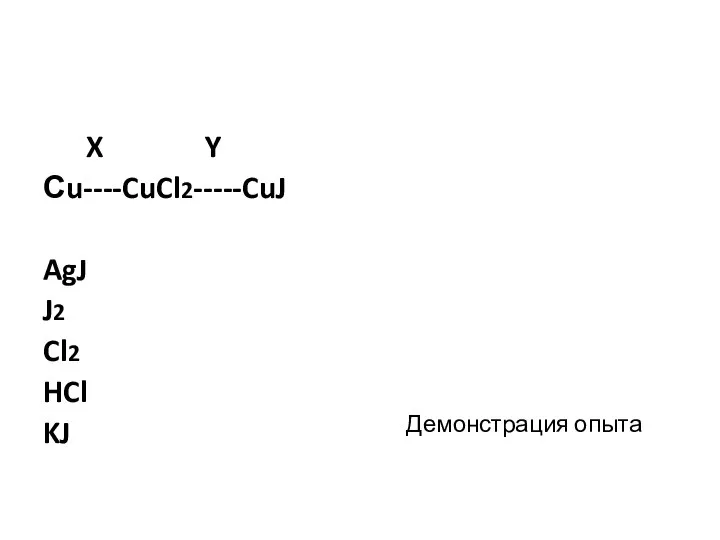
- 5. X Y Сu----CuCl2-----CuJ AgJ J2 Cl2 HCl KJ Демонстрация опыта
- 7. https://www.youtube.com/watch?v=HwlgknbeHVo жидкий азот и туман с водой (мин. 2.39 -3.09) H2O Y X- ------NH3------Cu N2 CuO
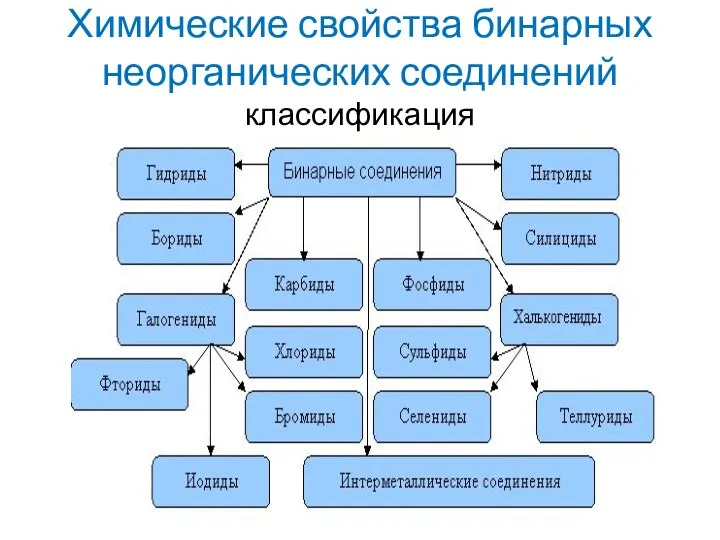
- 8. Химические свойства бинарных неорганических соединений классификация
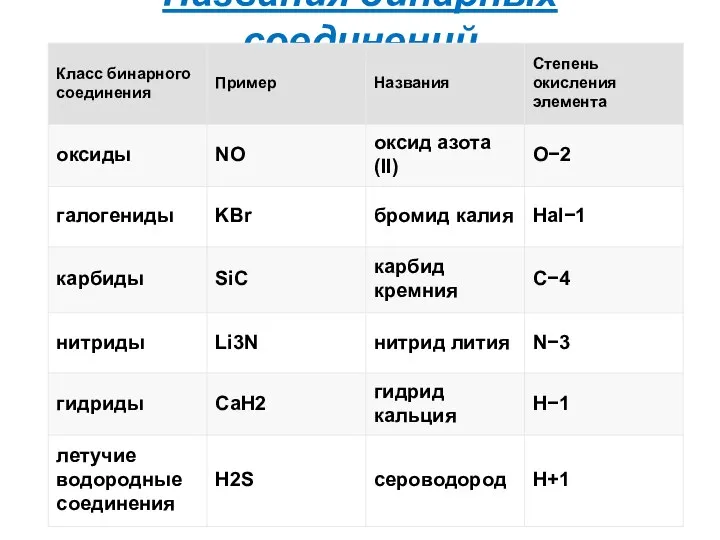
- 9. Названия бинарных соединений
- 10. Гидриды аммиак
- 11. Химические свойства бинарных неорганических соединений
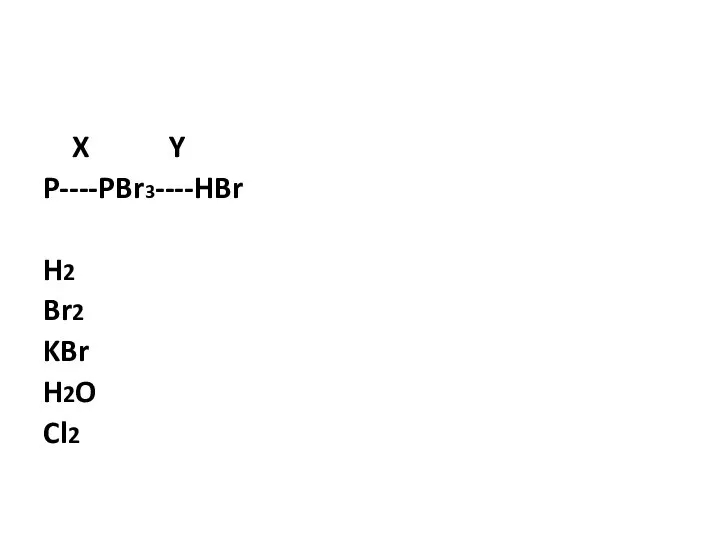
- 13. X Y P----PBr3----HBr H2 Br2 KBr H2O Cl2
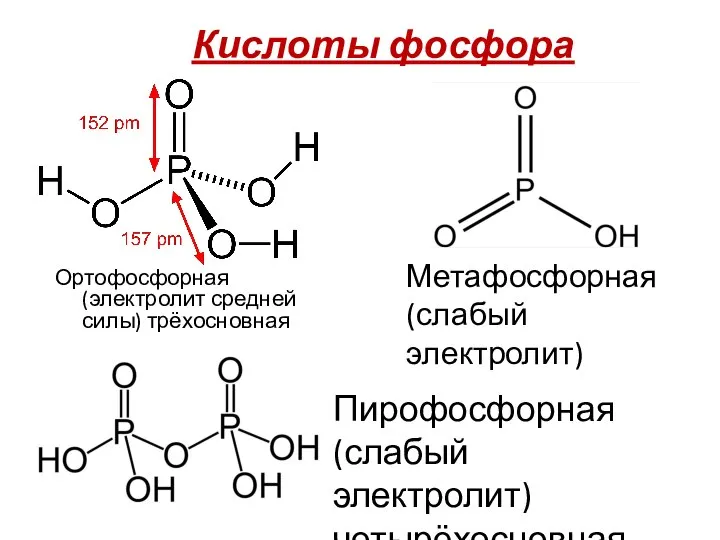
- 14. Кислоты фосфора Ортофосфорная (электролит средней силы) трёхосновная Метафосфорная (слабый электролит) Пирофосфорная (слабый электролит) четырёхосновная
- 16. Кислоты фосфора (С.О.+5)
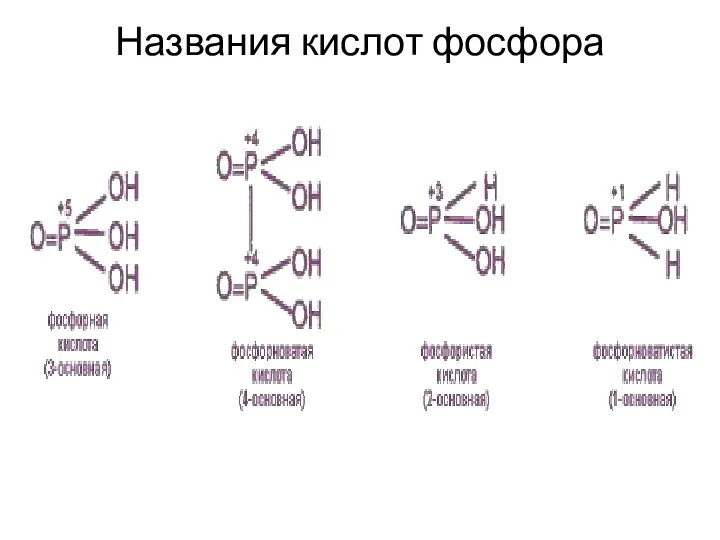
- 17. Названия кислот фосфора
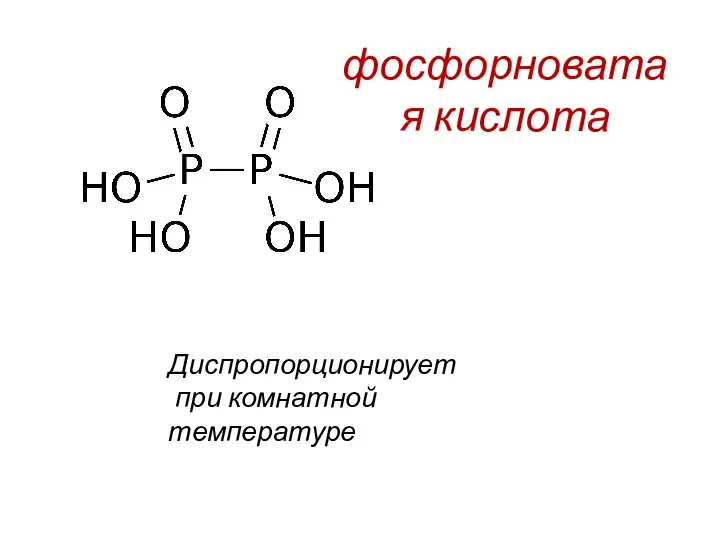
- 18. фосфорноватая кислота Диспропорционирует при комнатной температуре
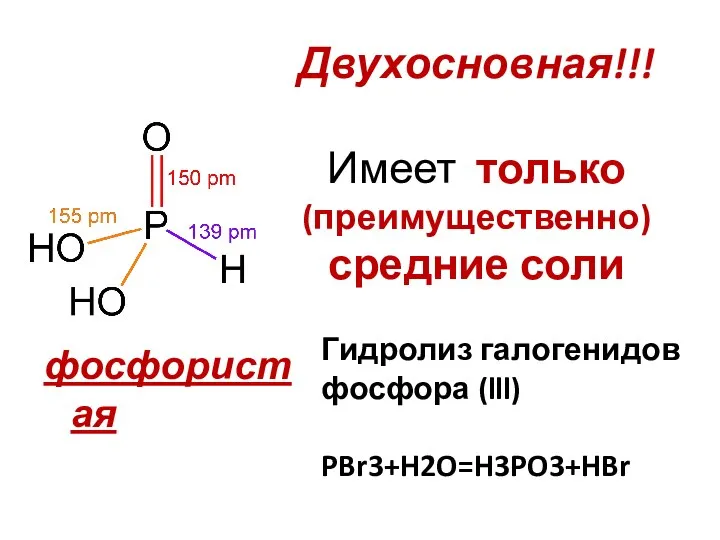
- 19. Двухосновная!!! Имеет только (преимущественно) средние соли фосфористая Гидролиз галогенидов фосфора (lll) PBr3+H2O=H3PO3+HBr
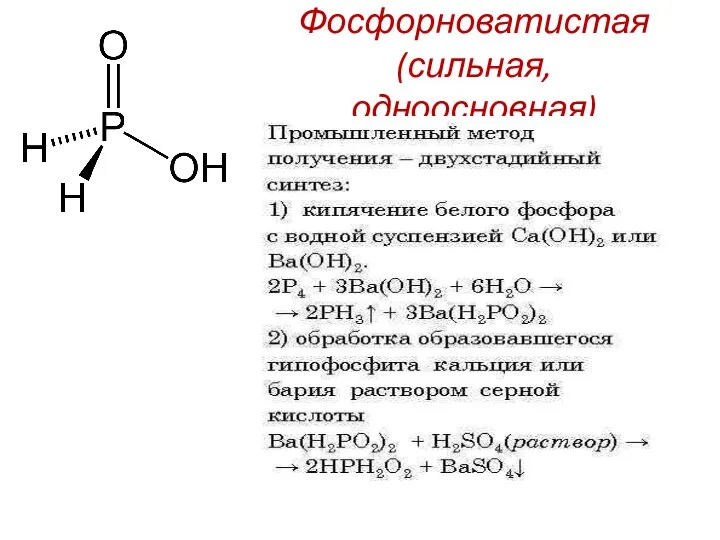
- 20. Фосфорноватистая (сильная, одноосновная)
- 21. Соли фосфорноватистой кислоты (гипофосфиты) образуются при взаимодействии белого фосфора со щелочами https://www.youtube.com/watch?v=g1ujYPHn3Fo
- 24. Классификация неорганических веществ Формула оксида NO Cr2O3 CrO MnO2 MnO Mn2O7 SiO SiO2 Li2O PbO PbO2
- 25. ФОРМУЛА KH2PO2 Na2H2P2O7 KFe(SO4) KHPO4 Na[Al(OH)4] Cr(OH)2NO3 Na2MnO4 Na2Cr2O7 Na[Ag(CN)2] CuSO4*5H2O NaCl*KCl Mg2(OH)2CO2 (CuOH)2CO3 Na2HPO3 KH2PO3
- 26. ТРИВИАЛЬНЫЕ НАЗВАНИЯ Красная кровяная соль K3[Fe(CN)6] Реактив на определение железа (II) 2 К3[Fe(CN)6 ] +3 Fe
- 27. https://www.youtube.com/watch?v=- → →OvtjGb15EE K4[Fe(CN)6] Используется для обнаружения Fe3+: образуется малорастворимый синий осадок «берлинской лазури»: FeIIICl3 +
- 28. Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия: 3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓ + 6KCl, Cu2+: из нейтральных
- 29. Железная окалина (железный сурик) FeO*Fe2O3 Свинцовый сурик 2PbO*PbO2 или Pb2PbO4 (ортоплюмбат свинца)
- 31. Свинцовые белила реставрация Pb(ОН)2CO3
- 32. Свинцовые белила на воздухе очень медленно реагирует с сероводородом, часто содержащемся в загрязненной атмосфере, при этом
- 33. Поташ К2СО3 Гипс CaSO4·2H2O KNO3 Калийная селитра
- 34. Негашеная известь Гашеная известь («пушонка») СаО Ca(OH)2
- 35. Корунд Al2O3 рубин сапфир
- 36. Кремнезём SiO2 SiO2 не реагирует с водой. Химически стоек к действию кислот, но реагирует с газообразным
- 37. SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли
- 39. Скачать презентацию












![ФОРМУЛА KH2PO2 Na2H2P2O7 KFe(SO4) KHPO4 Na[Al(OH)4] Cr(OH)2NO3 Na2MnO4 Na2Cr2O7 Na[Ag(CN)2] CuSO4*5H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/664739/slide-24.jpg)
![ТРИВИАЛЬНЫЕ НАЗВАНИЯ Красная кровяная соль K3[Fe(CN)6] Реактив на определение железа (II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/664739/slide-25.jpg)
![https://www.youtube.com/watch?v=- → →OvtjGb15EE K4[Fe(CN)6] Используется для обнаружения Fe3+: образуется малорастворимый синий](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/664739/slide-26.jpg)
![Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия: 3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/664739/slide-27.jpg)









 Понятие «Эффективность». Принцип Ле-Шателье
Понятие «Эффективность». Принцип Ле-Шателье Выращивание кристаллов
Выращивание кристаллов Волшебные кристалы
Волшебные кристалы Алкены
Алкены Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение Презентация по Химии "Органическая химия" - скачать смотреть
Презентация по Химии "Органическая химия" - скачать смотреть  Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Классификация основных пород
Классификация основных пород Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Жири як компоненти їжі. Їхня роль в організмі
Жири як компоненти їжі. Їхня роль в організмі  Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде
Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы
Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Жиры в питании спортсмена
Жиры в питании спортсмена Оже спектроскопия
Оже спектроскопия Legătura chimică
Legătura chimică Энтропия и уравнение состояния идеального газа
Энтропия и уравнение состояния идеального газа Стандартизація лікарської рослинної сировини
Стандартизація лікарської рослинної сировини Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть
Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть  Булану мен конденсация
Булану мен конденсация Презентация по Химии "Молекула в расчетных методах" - скачать смотреть
Презентация по Химии "Молекула в расчетных методах" - скачать смотреть  Материаловедение. Основы металловедения
Материаловедение. Основы металловедения ТЕМА УРОКА:
ТЕМА УРОКА: Классификация металлов
Классификация металлов Роль ученых в становлении органической химии
Роль ученых в становлении органической химии Дорогие и дешёвые лекарства: «Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: «Чем похожи и чем отличаются друг от друга? Химия атмосферы
Химия атмосферы