Содержание
- 3. Распространение запаха духов Испарение и замерзание воды Горение сахара Извержение вулкана Образование инея Гниение листьев осенью
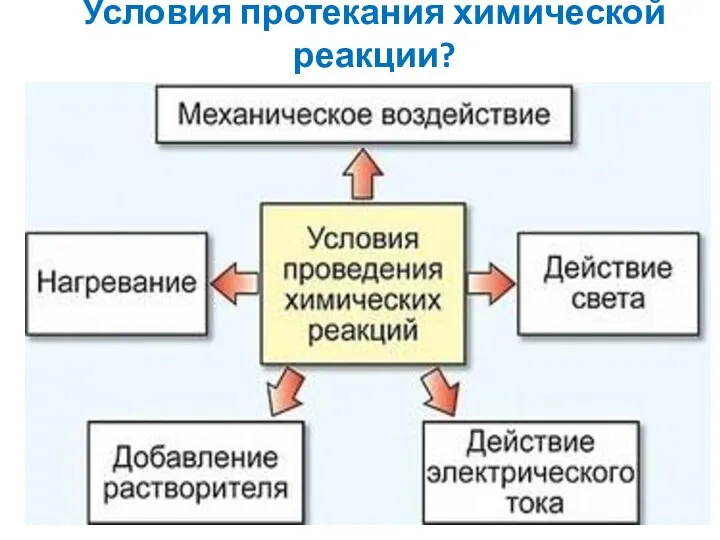
- 4. Условия протекания химической реакции?
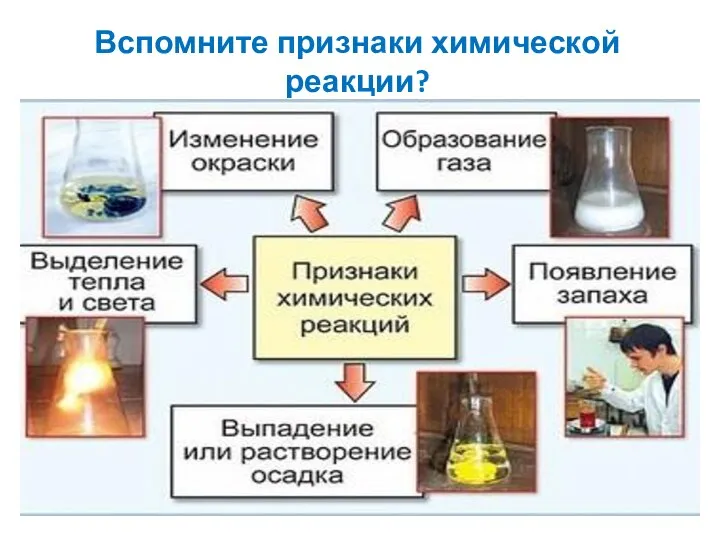
- 6. Вспомните признаки химической реакции?
- 8. Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Эндотермическая реакция — химическая реакция, сопровождающаяся поглощением теплоты.
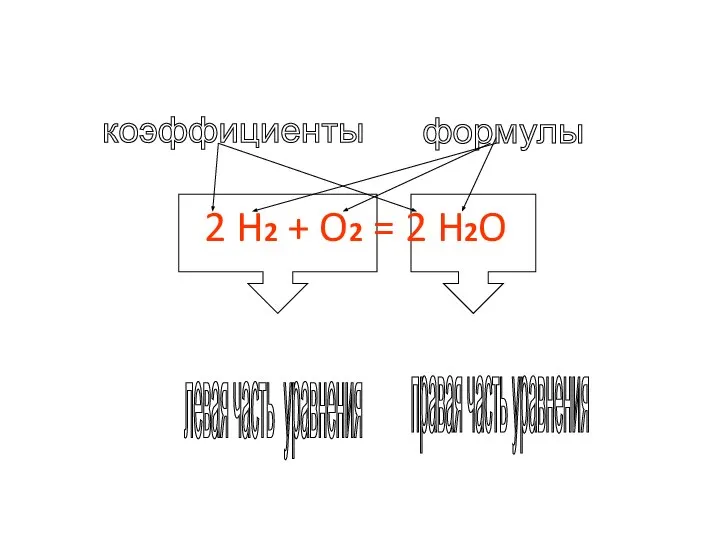
- 12. Химические уравнения - это условная запись химической реакции с помощью химических формул, коэффициентов и математических знаков
- 13. По уравнению можно определить тип химической реакции
- 14. 2 H2 + O2 = 2 H2O формулы коэффициенты левая часть уравнения правая часть уравнения
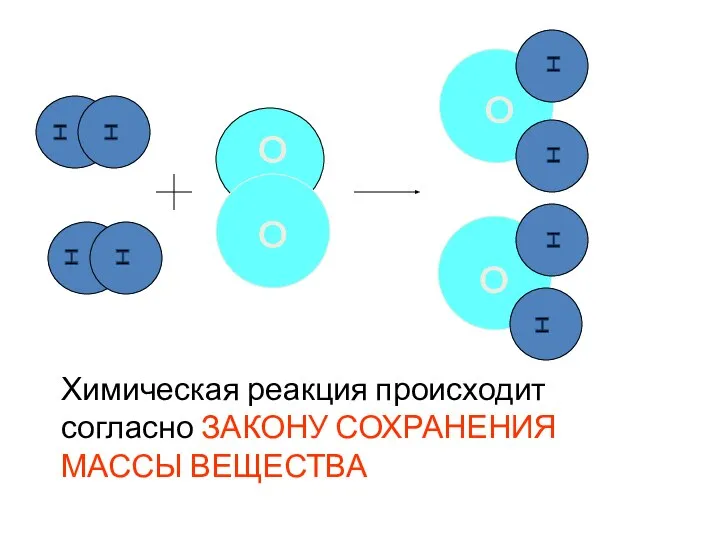
- 15. Химическая реакция происходит согласно ЗАКОНУ СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВА H H H H H H H H
- 16. Закон сохранения массы вещества ( М.В. Ломоносов – 1756 г.) Масса веществ, вступивших в химическую реакцию,
- 17. NaOH + HCl = NaCl + H2O
- 18. Реакции соединения Несколько простых или сложных веществ соединяются в одно, более сложное Zn + S =
- 19. Реакции разложения Являются обратными реакциям соединения Из одного сложного вещества получаются несколько других веществ CaCO3 =
- 20. Реакции замещения Это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы
- 21. Реакции обмена Это реакции, при которых два сложных вещества обмениваются своими составными частями CuSO4 + 2
- 22. Составьте уравнения химических реакций: Горение угля Взаимодействие цинка с соляной кислотой Разложение воды электрическим током Прокаливание
- 23. Составьте уравнения химических реакций по схемам, определите тип реакций: Cu(OH)2 Na2O + H2O Zn + S
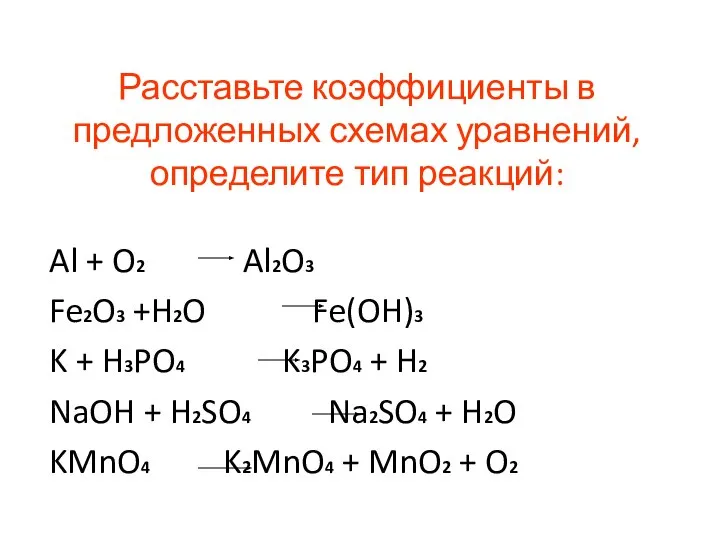
- 24. Расставьте коэффициенты в предложенных схемах уравнений, определите тип реакций: Al + O2 Al2O3 Fe2O3 +H2O Fe(OH)3
- 26. Скачать презентацию


















 Биогенді аминдер
Биогенді аминдер Очистка воды. Лабораторная работа в домашних условиях
Очистка воды. Лабораторная работа в домашних условиях Непрерывные реакторы для гомогенных гомофазных процессов
Непрерывные реакторы для гомогенных гомофазных процессов Магний. Нахождение в природе
Магний. Нахождение в природе Эндогенная серия. Гидротермальная группа
Эндогенная серия. Гидротермальная группа «Многоатомные спирты»
«Многоатомные спирты»  Granite
Granite Презентация по Химии "«Тверда вода»" - скачать смотреть бесплатно
Презентация по Химии "«Тверда вода»" - скачать смотреть бесплатно Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Химическая связь
Химическая связь Научные принципы химического производства. Производство аммиака
Научные принципы химического производства. Производство аммиака Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Предмет кристаллографии. Связь с другими науками. История развития
Предмет кристаллографии. Связь с другими науками. История развития Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Алкины
Алкины Абсорбционная осушка газа
Абсорбционная осушка газа Презентация по Химии "Жуёшь, жуёшь, не пережуёшь" - скачать смотреть
Презентация по Химии "Жуёшь, жуёшь, не пережуёшь" - скачать смотреть  Типы химических реакций на примере свойств воды Автор: учитель химии, МКОУ «Касторенская СОШ №1», п.г.т. Касторн
Типы химических реакций на примере свойств воды Автор: учитель химии, МКОУ «Касторенская СОШ №1», п.г.т. Касторн Ферменттер – тіршілік негізі
Ферменттер – тіршілік негізі Методика преподавания химии
Методика преподавания химии Презентация Дисперсные системы
Презентация Дисперсные системы  С + 6 ) ) 2 4 Подготовила: учитель химии Липадкина Г.И.
С + 6 ) ) 2 4 Подготовила: учитель химии Липадкина Г.И. МЕТАЛЛЫ Подготовила: преподаватель химии и биологии Уалихановского сельскохозяйственного колледжа Сыздыкова Карлыгаш Казбеков
МЕТАЛЛЫ Подготовила: преподаватель химии и биологии Уалихановского сельскохозяйственного колледжа Сыздыкова Карлыгаш Казбеков Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно
Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку Химическая связь (Лекция 3)
Химическая связь (Лекция 3) Классификация волокон и нитей
Классификация волокон и нитей Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного
Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного